2023-2024学年高中化学必修第一册2.1 钠及其化合物(人教版)
试卷更新日期:2023-07-26 类型:同步测试
一、选择题
-
1. 下列对实验的评价正确的是( )A、实验测得熔融NaCl能导电,说明NaCl属于电解质 B、向久置的Na2O2粉末中滴加稀盐酸,产生无色气体,说明Na2O2已变质 C、向某溶液中滴加AgNO3溶液,产生白色沉淀,该溶液中一定有Cl- D、向KI-淀粉溶液中滴加氯水,溶液变蓝,说明氧化性:I2>Cl22. 下列关于钠的叙述中,错误的是A、具有很强的氧化性 B、很软,能用刀切割 C、能与水发生化学反应 D、可保存在煤油中3. 将一块金属钠投入滴有紫色石蕊溶液的盛冷水的烧杯中,甲同学认为可观察到下列现象,其中正确的有( )
①钠投入水中,先沉入水底,后浮出水面②钠立即与水反应,并有气体产生③反应后溶液变红④钠熔成闪亮的小球⑤小球在水面上四处游动⑥有“嘶嘶”的响声发出
A、①②③④ B、②③④⑤ C、②④⑤⑥ D、③④⑥4. 下列离子方程式正确的是( )A、钠与水的反应:Na+2H2O=Na++2OH-+H2↑ B、澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O C、NaHCO3溶液与足量Ba(OH)2溶液:HCO+OH-+Ba2+= BaCO3↓+H2O D、硫酸溶液与氢氧化钡溶液反应:H++SO+OH-+Ba2+= H2O+BaSO4↓5. 2022年10月1日,天安门广场举行庆祝中华人民共和国成立73周年升旗仪式。下列说法不正确的是A、清晨第一缕阳光光芒万丈,该现象为丁达尔效应 B、国旗杆材料是高碳钢无缝钢管,属于金属材料 C、庆祝节日燃放了五彩的烟花,其色彩来自碱金属及锶、钡等金属元素的焰色 D、天安门城楼所涂的红色颜料,主要成分为6. 有关Na2O2的叙述不正确的是( )A、是淡黄色固体 B、可以作供氧剂 C、应密封保存 D、氧元素的化合价为−2价二、多选题
-
7. 下列说法正确的有( )A、电解、电镀、电离都需要通电才可以进行 B、碱性氧化物均为金属氧化物,酸性氧化物中也有金属氧化物 C、金属元素由化合态变成游离态一定是被还原 D、某无色溶液中加入溶液产生白色沉淀,再加入稀盐酸,沉淀不消失,则该无色溶液中一定含有8. 将10mL淀粉胶体和5mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中,如图所示,2min后,分别取袋内和烧杯内液体进行实验。下列说法正确的是( )
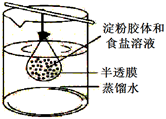 A、烧杯内液体加入硝酸银溶液后产生白色沉淀 B、袋内液体加入硝酸银溶液后产生白色沉淀 C、袋内液体加入碘水后不变蓝 D、烧杯内液体加入碘水后变蓝9. 下列说法错误的是( )A、钠是电和热的良导体 B、在水中的溶解性:NaHCO3大于Na2CO3 C、明矾净水是由于明矾在水中形成Al(OH)3胶体具有吸附作用 D、某溶液焰色反应时,火焰呈黄色就说明该溶液一定有钠元素,一定没有钾元素10. 关于钠的叙述中,不正确的是( )A、钠是银白色金属,硬度很大 B、金属钠的熔点很高 C、金属钠通常保存在空气中 D、钠的密度比水大11. 下列关于Na及其化合物的性质的说法正确的是( )A、Na和均可与水发生置换反应生成气体单质 B、可用作膨松剂主要是因为其能与酸反应 C、等物质的量的Na和分别与足量溶液反应,生成沉淀的质量之比为1∶2 D、将等物质的量的、分别投入100mL水中,充分反应后所得溶液的质量分数相同(不考虑水的蒸发)12. 观察是研究物质性质的一种基本方法。一位同学将一小块金属钠露置于空气中,观察到下列现象:银白色 变灰暗变白色出现液滴白色固体(粉末)。下列说法正确的是( )A、银白色→变灰暗是因为钠转化为过氧化钠 B、过程③是因为NaOH易潮解 C、过程④只发生了物理变化 D、如果时间够长,最后得到的白色固体是Na2CO313. 将与按一定比例混合后在密闭容器中加热充分反应,冷却到室温,得到。经检验容器内无、和存在,下列说法错误的是( )A、产物中一定含有NaOH B、与的质量比为 C、在反应中既作氧化剂又作还原剂 D、由过氧化钠转化得到的碳酸钠的质量为212g14. 下列实验操作、现象、解释或结论都正确的是( )
A、烧杯内液体加入硝酸银溶液后产生白色沉淀 B、袋内液体加入硝酸银溶液后产生白色沉淀 C、袋内液体加入碘水后不变蓝 D、烧杯内液体加入碘水后变蓝9. 下列说法错误的是( )A、钠是电和热的良导体 B、在水中的溶解性:NaHCO3大于Na2CO3 C、明矾净水是由于明矾在水中形成Al(OH)3胶体具有吸附作用 D、某溶液焰色反应时,火焰呈黄色就说明该溶液一定有钠元素,一定没有钾元素10. 关于钠的叙述中,不正确的是( )A、钠是银白色金属,硬度很大 B、金属钠的熔点很高 C、金属钠通常保存在空气中 D、钠的密度比水大11. 下列关于Na及其化合物的性质的说法正确的是( )A、Na和均可与水发生置换反应生成气体单质 B、可用作膨松剂主要是因为其能与酸反应 C、等物质的量的Na和分别与足量溶液反应,生成沉淀的质量之比为1∶2 D、将等物质的量的、分别投入100mL水中,充分反应后所得溶液的质量分数相同(不考虑水的蒸发)12. 观察是研究物质性质的一种基本方法。一位同学将一小块金属钠露置于空气中,观察到下列现象:银白色 变灰暗变白色出现液滴白色固体(粉末)。下列说法正确的是( )A、银白色→变灰暗是因为钠转化为过氧化钠 B、过程③是因为NaOH易潮解 C、过程④只发生了物理变化 D、如果时间够长,最后得到的白色固体是Na2CO313. 将与按一定比例混合后在密闭容器中加热充分反应,冷却到室温,得到。经检验容器内无、和存在,下列说法错误的是( )A、产物中一定含有NaOH B、与的质量比为 C、在反应中既作氧化剂又作还原剂 D、由过氧化钠转化得到的碳酸钠的质量为212g14. 下列实验操作、现象、解释或结论都正确的是( )选项
实验操作
实验现象
解释或结论
A
用铁丝蘸取某种粉末做焰色试验
火焰呈黄色
证明含有钠单质
B
将饱和氯化铁溶液滴入沸水中
产生某种红褐色液体
该红褐色液体为胶体
C
用红色激光笔照射雾
看到一条光亮的“通路”
雾能产生丁达尔效应
D
加热碳酸氢钠溶液
产生能使澄清石灰水变浑浊的气体
碳酸氢钠热稳定性较差
A、A B、B C、C D、D三、非选择题
-
15. 简述实验室检验Cl﹣的方法.16. Fe(OH)3胶体在生活中有重要应用,利用FeCl3和沸水反应制备的Fe(OH)3胶体中常混有FeCl3和HCl。试回答下列有关问题:(1)、实验室制取Fe(OH)3胶体的方法是 , 用方法除去胶体中的浑浊物。(2)、Fe(OH)3胶体中混有的FeCl3和HCl可以用方法分离提纯。如何用实验的方法证明胶体和Cl-已经分离? 。(3)、高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水反应的化学方程式是:4K2FeO4+10H2O=4Fe(OH)3(胶体)+3O2↑+8KOH(已知K2FeO中氧元素不变价)。
高铁酸钾在与水反应过程中,O2是 (填“氧化产物”或“还原产物”),每当反应生成8gO2 , 被氧化的水质量是g。说明该净水剂的净水原理。
17. 物质的分类是学习化学的一种重要方法,科学合理的分类对于系统掌握知识、提高学习效率、解决问题都有着重要的意义。下表是生活生产中常见的物质,表中列出了它们的成分编号
①
②
③
④
⑤
⑥
⑦
名称
醋酸
酒精
火碱
食盐
苏打
小苏打
铜丝
成分
(1)、水溶液呈碱性的是(填序号);(2)、①~⑦中的成分属于电解质的是(填序号);(3)、纯碱中含有少量 , 设计实验检验此混合物中的、。实验操作步骤:将少量混合物加水溶解后,分别置于两支试管中。向第一支试管中加入稀盐酸,可观察到产生无色气泡,该反应的离子方程式为 , 说明溶液中存在;向第二支试管中先加入足量稀硝酸,再加入溶液(填化学式),可观察到白色沉淀,说明溶液中存在。18. 钠在生活、生产、科研中有重要应用。(1)、钠灯是道路照明的主要光源。钠灯照明时产生色光,其穿雾能力很强。(2)、用镊子取一小块钠,用滤纸吸干表面的后,进行图I所示的实验(夹持仪器已略去),试管中发生反应的化学方程式是。充分反应后,待试管冷却,进行图II所示的实验,发生反应的化学方程式是 , 再向其中滴加几滴酚酞溶液,可能观察到的现象是。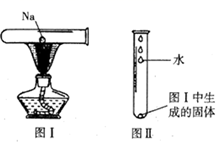 19. 某兴趣小组探究金属钠与水在不同实验装置中的反应情况。
19. 某兴趣小组探究金属钠与水在不同实验装置中的反应情况。 (1)、钠与水反应的化学方程式是。(2)、钠放入甲中水槽后的实验现象是。(3)、按图乙所示方法收集钠与水反应产生的气体并进行定量计算。实验方法是:先在某金属箔纸上扎一些小孔,然后用此金属箔纸包住钠,将钠放入水中的同时用试管收集气体。为达到实验目的,金属箔纸应该是(填“铜箔”或“铝箔”)。(4)、向丙中试管放入一小块钠,开始钠沉入煤油和水的交界处与水反应,而后又浮到煤油层,在煤油和水层界面之间上下跳动,持续进行直至钠消耗完全,解释产生上述现象的原因。20. 写出与下列事实相符的金属钠的主要物理性质:
(1)、钠与水反应的化学方程式是。(2)、钠放入甲中水槽后的实验现象是。(3)、按图乙所示方法收集钠与水反应产生的气体并进行定量计算。实验方法是:先在某金属箔纸上扎一些小孔,然后用此金属箔纸包住钠,将钠放入水中的同时用试管收集气体。为达到实验目的,金属箔纸应该是(填“铜箔”或“铝箔”)。(4)、向丙中试管放入一小块钠,开始钠沉入煤油和水的交界处与水反应,而后又浮到煤油层,在煤油和水层界面之间上下跳动,持续进行直至钠消耗完全,解释产生上述现象的原因。20. 写出与下列事实相符的金属钠的主要物理性质:(1)用小刀切割金属钠,表现其
(2)金属钠能浮在水面上,表现其
(3)金属钠微微受热时会熔化成一个闪亮的小球,表现其 .
21. 某同学将一小块钠投入到硫酸铜溶液中,观察到与钠跟水反应相同的现象 , 钠在硫酸铜溶液中还可观察到的现象是。写出有关的化学方程式、。22. 将一块质量为10.8g表面已被氧化的金属钠投入100g水中,产生0.20g气体,求:①氧化钠的质量;②所得溶液的质量分数.(请写出计算过程)23. 钠是活泼金属的代表,钠和钠的化合物是中学化学的基础知识。请回答下列有关问题。(1)、某同学炒菜时发现,汤汁溅到液化气的火焰上时,火焰呈黄色。据此他判断汤汁中含有元素;(2)、钠有两种氧化物,其中能用于呼吸面具和潜水艇中作为氧气来源的氧化物是;(3)、厨房中用的食盐和纯碱外观相似。某同学为区分这两种物质,各取少量置于玻璃杯中,滴加食醋,有气体产生的是(填化学式)(4)、固体碳酸钠中含有碳酸氢钠杂质,除去此杂质的简单方法是。(5)、胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打,能治疗胃酸过多,请写出其反应的离子方程式:。24. A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A为单质,其化合物的焰色都为黄色。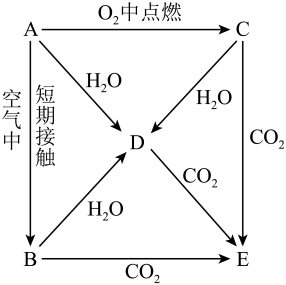 (1)、写出的化学式:A;B;C;E。(2)、写出反应的化学方程式:
(1)、写出的化学式:A;B;C;E。(2)、写出反应的化学方程式::;
:;
:。
25. A~H为中学化学中常见的物质,转化关系如下所示,其中“○”框着的物质代表化合物,“□”框着的物质代表单质,A为医疗上治疗胃酸过多的一种药剂,G为淡黄色固体,C在通常状况下为无色液体。
请回答下列问题:
(1)、检验A中阳离子的常用方法:。(2)、写出①的化学反应方程式:。(3)、写出③的化学反应方程式:。26. 有如下物质:①Na;②NaOH溶液;③固体;④;⑤酒精();⑥蒸馏水;⑦溶液;⑧晶体。(1)、以上物质中,属于电解质的是(填序号,右同),属于非电解质的是。(2)、将②与⑦进行混合,该过程中发生反应的离子方程式是。(3)、向氢氧化钡溶液中加入物质③的溶液至恰好沉淀完全,其离子方程式为。(4)、向100mL②溶液中通入一定量的④,然后向该溶液中逐滴加入2的盐酸,所加盐酸的体积与产生的体积(标准状况)关系如图所示: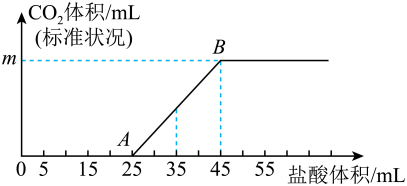
回答下列问题:
①0A段发生反应的离子方程式为。
②m=mL。
③原②溶液的物质的量浓度为。
(5)、将0.1mol⑤在足量氧气中充分燃烧,再将全部产物缓慢通过足量的固体,固体质量增加g。27.(1)、【任务一】某小组研究和的性质,实验如下:步骤
实验操作
观察到的实验现象
①
在两支试管中分别加入、固体,再加入蒸馏水,振荡;将温度计分别插入其中
放置至室温时,全部溶解,得到透明溶液
放置至室温时,部分溶解,试管底部有少许固体
②
将步骤①的试管中溶液分别分成两份,其中1份溶液中各滴加2滴酚酞溶液
溶液变红色
溶液变浅红色
③
在步骤②的另两份溶液中各滴加2滴10%盐酸,振荡
没有气泡产生
产生少量气泡
室温时,的溶解度大于的实验证据是。
(2)、该实验(填“能”或“不能”)说明溶液的碱性强于溶液,若不能,请说明理由。(3)、实验③中溶液没有气泡产生,学生甲得出结论:溶液与盐酸不反应。学生乙认为甲的结论不正确,支持学生乙观点的客观事实是(用离子方程式说明)。(4)、【任务二】为进一步探究和的性质,利用传感器继续做如下实验:编号
实验操作
实验数据
④

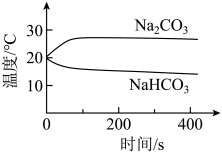
⑤


信息提示:溶液越小,的浓度越小,溶液碱性越弱。
实验④中,溶解时吸收热量的物质是(填化学式)。
(5)、实验⑤中,溶液和澄清石灰水反应的离子方程式为 , 未参与该反应的实验证据是。(6)、【任务三】探究和的热稳定性。
观察到的实验现象如下表所示:
物质
装置B中现象
装置C中现象
无明显变化
开始断断续续产生气泡,一会儿后,没有气泡,溶液保持澄清
白色粉末变蓝色
开始断断续续产生气泡,一会儿后,产生连续气泡,溶液变浑浊
根据上述实验现象,回答下列问题:
加热时,装置C中产生气泡的原因是。
(7)、该实验所得结论是。28. 将70克过氧化钠和氧化钠的混和物跟98克水充分反应后,所得氢氧化钠溶液的质量百分比浓度为50%.试分别写出过氧化钠和氧化钠跟水反应的化学方程式,并计算原混和物中过氧化钠和氧化钠的质量各为多少克.29. 在4种无机物①氯化钠、②碳酸钠、③次氯酸钙、④过氧化钠中,可用作食用碱的是(填序号,下同),可用作调味品的是 , 可用作呼吸面具供氧剂的是 , 可用作消毒剂的是(每种物质仅限填一次)。30.如图中的每一方格表示有关的一种反应物或生成物,其中粗框表示初始反应物( 反应时加入或生成的水,以及生成沉淀J时的其它产物均已略去).
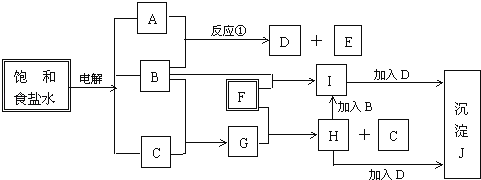
请填写下列空白:
(1)物质B是 ,F是 ,J是 ;
(2)反应①的离子方程式是 .
31. 某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。药品
NaNO2 (亚硝酸钠)
性质
①在酸性溶液中有较强氧化性,能将Fe2+ 氧化成Fe3+ ;
①AgNO2是一种难溶于水、易溶于酸的盐。
(1)、已知NaNO2能发生如下反应: 2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目。该反应中氧化剂是;若有0.75mol 电子转移,则被还原的氧化剂粒子数为。
(2)、误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是______(填序号)。A、NaNO2被还原 B、维生素C具有还原性 C、还原性:维生素C>Fe2+ D、NaNO2是还原剂(3)、下列方法中,可用来区分NaNO2和NaCl的是______ (填序号)。A、焰色反应 B、分别滴加酸化FeSO4溶液和KSCN溶液 C、在酸性条件下加入KI淀粉溶液 D、分别滴加AgNO3溶液(4)、某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:。32.(1)、I.以下物质:①NaCl溶液②二氧化碳③HCl气体④熔融KHSO4⑤Fe⑥无水乙醇⑦NaHCO3固体以上物质中属于电解质的是(填序号),以上物质中属于非电解质的是(填序号),上述状态下的物质能导电的是(填序号)。
(2)、利用①做焰色试验,火焰呈色。(3)、写出④在水溶液中的电离方程式: , ①电离出的阴离子为A,写出检验未知溶液中阴离子A的方法:。(4)、II.向NaOH溶液中滴加等浓度的盐酸,测定溶液的导电能力(用导电率表示)变化如图所示,回答下列问题: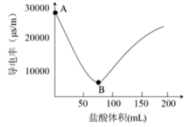
A~B段,发生的离子反应方程式是:。
(5)、B点所对应的溶液中存在的微粒主要有H2O、。33. 完成下列问题(1)、钠元素有多种化合物。下列关于、、NaOH、、的说法正确的有(选填序号)a.均属于电解质 b.溶于水立即加入酚酞试液最终均为红色
c.均能通过化合反应一步生成 d.溶于水均伴随着放热现象
(2)、探究和的相互转化。实验1:加热碳酸氢钠固体,装置如下图所示。
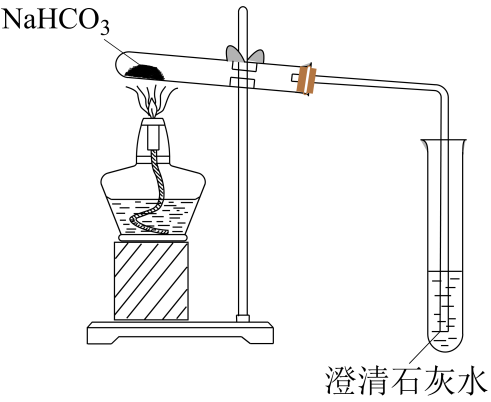
①利用上述装置可实现向的转化,被加热的试管中发生反应的化学方程式为。
实验2:分别向滴有2滴酚酞的和溶液中滴加稀盐酸,实验记录如下:
实验内容
实验现象

实验2-1
溶液浅红色褪去,立即产生大量气泡。

实验2-2
开始时,溶液的红色没有明显变化,电没有明显的气泡产生。继续滴加盐酸,当溶液的红色明显变浅时,气泡的数量血逐渐增多。当溶液的颜色变为浅红色,继续滴加盐酸,溶液的浅红色褪去,有大量气泡出现。
②实验2-1中,反应的离子方程式是。
③实验2-2中,实现碳酸钠向碳酸氢钠转化的现象是 , 反应的化学方程式:。
④碳酸也可实现上述转化,写出将通入溶液中发生反应的离子方程式:。