2023-2024学年高中化学必修第一册1.3氧化还原反应(人教版)
试卷更新日期:2023-07-26 类型:同步测试
一、选择题
-
1. 亚硝酸盐中毒,又名乌鸦病、紫绀病、肠源性青紫病。亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,血红蛋白中的铁元素由二价变为三价,失去携氧能力,使组织出现缺氧现象。美蓝是亚硝酸盐中毒的有效解毒剂。下列说法中,不正确的是( )A、中毒时亚硝酸盐发生氧化反应 B、在中毒过程中血红蛋白被氧化 C、药品美蓝应具有还原性 D、解毒时血红蛋白被还原2. 科研小组用氧化—沉淀法从废电池浸出液中去除铁:用氧化废电池没出液中的Fe2+(),再加适量调pH使转化为沉淀。研究发现pH对的氧化率和铁去除率的影响如图1和图2所示。

已知:i.pH越大,越小;
ii.酸性条件下被还原为
下列说法不合理的是
A、由图1可知,氧化率随浸出液pH增大而减小 B、若起始浸出液pH=1,与Fe2+反应一段时间后,浸出液pH会减小 C、转变为沉淀的离子方程式为: D、推测若用调溶液pH也可以使转化为沉淀3. 某化学兴趣小组同学采用如图所示装置来制备氯气并检验其性质,仪器a中反应的化学方程式为(未配平),下列说法正确的是(忽略空气对反应的影响) A、该反应中,浓盐酸只体现了还原性 B、生成的氯气中的氯全部来自 C、随着反应进行,烧杯中溶液颜色由绿色变为黄色再变为蓝色 D、由该实验可判断出氧化性:4. 食盐中所加的碘以碘酸钾形式存在,已知反应: , 可用该反应设计实验来证明加碘食盐中存在的 , 关于上述反应的说法不正确的是( )A、反应中I-被氧化 B、上述反应中氧化剂和还原剂的物质的量之比为5:1 C、当生成3mol2时,电子转移数目为 D、该反应可证明I-的还原性强于I25. 过氧化钙晶体CaO2•8H2O不溶于水,遇水缓慢地分解,放出氧气,是一种用途广泛的优良供氧剂。某学习小组利用工业废渣CaCl2(含少量熟石灰)制取CaO2•8H2O,设计了以下工业流程:
A、该反应中,浓盐酸只体现了还原性 B、生成的氯气中的氯全部来自 C、随着反应进行,烧杯中溶液颜色由绿色变为黄色再变为蓝色 D、由该实验可判断出氧化性:4. 食盐中所加的碘以碘酸钾形式存在,已知反应: , 可用该反应设计实验来证明加碘食盐中存在的 , 关于上述反应的说法不正确的是( )A、反应中I-被氧化 B、上述反应中氧化剂和还原剂的物质的量之比为5:1 C、当生成3mol2时,电子转移数目为 D、该反应可证明I-的还原性强于I25. 过氧化钙晶体CaO2•8H2O不溶于水,遇水缓慢地分解,放出氧气,是一种用途广泛的优良供氧剂。某学习小组利用工业废渣CaCl2(含少量熟石灰)制取CaO2•8H2O,设计了以下工业流程:
已知:①CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O↓+2NH4Cl
②Ca(OH)2与H2O2直接反应,生成杂质较多。
下列说法不正确的是( )
A、“混合”操作中,选择的试剂X可以是Ca(OH)2 B、“搅拌”操作中,温度过高或温度过低,都不利于反应的进行 C、“真空过滤”的目的是加快过滤速率,减少过氧化钙晶体和水的反应 D、“搅拌”操作中,加入的H2O2与含氨的CaCl2溶液发生了氧化还原反应6. 古代典籍富载化学知识,下述之物见其还原性者为A、石胆(CuSO4•5H2O):“石胆能化铁为铜。” B、强水(HNO3):“性最烈,能蚀五金,……” C、矶(FeSO4•7H2O):“盖此矶色绿味酸,烧之则赤。” D、金箔(Au):“凡金箔,每金七厘造方寸金一千片,……”7. 铁在浓度极稀的硝酸中发生的反应为(未配平),下列说法正确的是A、该反应出现的物质中,属于氧化物的有4种 B、溶液可以导电,故溶液属于电解质 C、该反应中,参与反应的氧化剂与还原剂的总物质的量之比为15∶4 D、该反应中,每消耗 , 同时转移电子8. 工业上用发烟HClO4将潮湿的CrCl3氧化为棕色的烟[CrO2(ClO4)2],来除去Cr(Ⅲ),离子方程式为ClO+Cr3++→CrO2(ClO4)2+Cl-+。下列说法正确的是A、HClO4属于弱酸 B、CrO2(ClO4)2为还原产物 C、该反应中,参加反应的氧化剂与还原剂的物质的量之比为19∶8 D、反应过程中溶液的pH减小9. 高铁酸钾是高效多功能的新型非氯绿色消毒剂,主要用于饮用水处理。工业上制备的一种方法是向溶液中通入氯气,然后再加入溶液:①(未配平);
②。
下列说法错误的是
A、在杀菌消毒过程中还可以净水 B、反应①中每消耗 , 吸收标准状况下22.4L(忽略和水的反应) C、若反应①中 , 则还原产物与氧化产物的物质的量之比为 D、若反应①的氧化产物只有 , 则得到时最少消耗二、多选题
-
10. 已知常温下,在溶液中发生如下反应:
①;
②;
③。
由此推断下列说法错误的是( )
A、反应可以进行 B、Z元素在反应①中被还原,在反应③中被氧化 C、可以置换出溶液中的X D、氧化性由强到弱的顺序是11. 催化某反应的一种催化机理如图所示。下列叙述正确的是( ) A、该机理的总反应为 B、催化过程中,所发生的反应均为氧化还原反应 C、图中和HCHO均属于氧化物 D、反应过程中,溶液的酸性增强12. 高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,化学方程式如下(未配平):
A、该机理的总反应为 B、催化过程中,所发生的反应均为氧化还原反应 C、图中和HCHO均属于氧化物 D、反应过程中,溶液的酸性增强12. 高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,化学方程式如下(未配平):____________________________。
下列说法正确的是( )
A、是氧化剂,是还原产物 B、的还原性强于 C、化学方程式配平后的化学计量数是6 D、配平后高锰酸钾与的系数比为2∶513. ①②③④ , 根据上述化学方程式,下列说法错误的是( )A、氧化性由强到弱的顺序为 B、还原性由强到弱的顺序为 C、气体能使湿润的KI-淀粉试纸变蓝 D、预测新制氯水和二氧化硫的水溶液反应后溶液的酸性减弱14. 已知还原性:I->Fe2+>Br- , 且有下列三个反应:①Cl2(少量)+FeI2=FeCl2+I2②2Fe2++Br2=2Fe3++2Br-③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O。下列说法正确的是( )A、①②③中的氧化产物分别是I2、Fe3+、Cl2 B、根据以上方程式可以得到氧化性Cl2>Fe3+>Co2O3 C、可以推理得到Cl2(少量)+FeBr2=FeCl2+Br2 D、在反应③中HCl体现了酸性和还原性15. 硝酸厂的烟气中含有大量的氮氧化物(),将烟气与的混合气体通入与(为铈元素)的混合溶液中实现无害化处理,其转化过程如图所示。下列说法正确的是( ) A、过程Ⅰ发生反应的离子方程式为 B、时,过程Ⅱ中氧化剂与还原剂的物质的量之比为 C、处理过程中,混合溶液中和总数减少 D、该转化过程的实质为被还原16. 下列气体与水能发生氧化还原反应的是( )A、Cl2 B、SO2 C、NH3 D、NO217. 某小组探究Na2S溶液与KMnO4溶液反应,实验过程如下:
A、过程Ⅰ发生反应的离子方程式为 B、时,过程Ⅱ中氧化剂与还原剂的物质的量之比为 C、处理过程中,混合溶液中和总数减少 D、该转化过程的实质为被还原16. 下列气体与水能发生氧化还原反应的是( )A、Cl2 B、SO2 C、NH3 D、NO217. 某小组探究Na2S溶液与KMnO4溶液反应,实验过程如下:实验序号
I
II
实验过程
滴加10滴(约0.3mL)0.1mol/L Na2S溶液

滴加10滴(约0.3mL)0.01mol/L酸性KMnO4溶液(H2SO4酸化至pH=0)

实验现象
紫色变浅(pH<1),生成棕褐色沉淀(MnO2)
溶液呈淡黄色(pH≈8),生成浅粉色沉淀(MnS)
资料:i.MnO在强酸性条件下被还原为Mn2+ , 在近中性条件下被还原为MnO2。
ii.单质硫可溶于硫化钠溶液,溶液呈淡黄色。下列说法正确的是( )
A、取少量实验I所得溶液进行实验,检测到有SO , 说明S2-被MnO氧化为SO B、实验I中生成棕褐色沉淀的原因: C、实验II中所有参加反应的S2-均表现还原性 D、实验现象说明:物质变化除与自身性质有关,还与浓度、用量、溶液的酸碱性有关三、非选择题
-
18. 为治理汽车尾气中的NO和CO对环境的污染,可在汽车排气管上安装催化转化器,发生的反应为: , 该反应中:氮元素化合价(填“升高”或“降低”);发生氧化反应的物质是(填化学式);氧化剂是(填化学式)。19. 饮用水中的 , 对人类健康会产生危害,为了降低饮用水中的浓度,可以在碱性条件下用铝粉将 , 还原为N2 , 其化学方程式为:
Al+NaNO3+NaOH=NaAlO2+N2+H2O。请配平该反应
上述反应中,元素的化合价升高,则该元素的原子 (填“得到”或“失去”)电子。用“单线桥法”表示反应中电子转移的方向和数目。
20. 在标况下,将128g铜投入到足量的浓硝酸溶液中,求生成气体的体积.21. 二氧化氯()是一种高效的饮用水消毒剂。(1)、在酸性条件下,可与反应生成。写出发生反应的离子方程式:。(2)、某泡腾片的有效成分为、、 , 其溶于水时反应可得到溶液,并逸出大量气体。和反应生成和 , 每生成1mol消耗的物质的量为mol,逸出气体的主要成分是(填化学式)(3)、消毒时会产生少量的 , 可利用将转化为除去。控制其他条件相同,去除率随温度变化如图所示。温度高于50℃时,ClO去除率随温度升高而降低的原因可能是 (4)、为测定某二氧化氯溶液中的浓度,进行如下实验:准确量取5.00mL溶液,酸化后加入过量的KI溶液,充分反应,加入几滴淀粉溶液,用溶液滴定至终点。重复上述操作2~3次,平均消耗溶液27.50mL。已知: ,
(4)、为测定某二氧化氯溶液中的浓度,进行如下实验:准确量取5.00mL溶液,酸化后加入过量的KI溶液,充分反应,加入几滴淀粉溶液,用溶液滴定至终点。重复上述操作2~3次,平均消耗溶液27.50mL。已知: ,①滴定终点的现象为。
②计算该二氧化氯溶液中的物质的量浓度(写出计算过程)。
22. 工业上常用绿矾()做处理剂,处理废水中含有的重铬酸根离子(),反应的离子方程式如下:。(1)、在该反应中,氧化剂是(填离子符号,下同),被氧化的是。(2)、该反应每消耗1mol离子,生成的物质的量为mol,转移电子的物质的量为mol。23. 按要求填空,已知反应:①SO3+H2O=H2SO4
②3NO2+H2O=2HNO3+NO
③2F2+2H2O=4HF+O2
④2Na+2H2O=2NaOH+H2↑
⑤Na2O+2HCl=2NaCl+H2O
⑥Al2O3+2NaOH=2NaAlO2+H2O
(1)、上述反应不属于氧化还原反应的有(填序号,下同)。H2O被氧化的是 , H2O被还原的是 , 属于氧化还原反应,但其中的H2O既不被氧化又不被还原的是。(2)、在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,是还原剂;元素被还原。用双线桥表示电子的转移:(3)、用双线桥法表示反应②的电子转移方向和数目:。(4)、用单线桥法表示反应③的电子转移方向和数目:。(5)、写出反应④的离子方程式:。24. 已知反应:ⅰ.
ⅱ.
ⅲ.
(1)、反应ⅰ中,做氧化剂的是 , 氯元素的化合价(填“升高”或“降低”)。在该反应中,若消耗了1mol , 生成mol,转移电子的物质的量为mol。(2)、依据ⅰ、ⅱ、ⅲ判断,物质氧化性由强到弱的顺序是。25. 某兴趣小组利用下列试剂:铁粉、锌粉、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。(1)、用所给试剂写出体现Fe2+具有还原性的反应的离子反应方程式:。(2)、设计实验方案,完成下列表格。探究内容
实验方案
实验现象
探究Fe3+的化学性质
取少量0.1 mol ·L-1 FeCl3溶液,往溶液中加入 足量铁粉,再加入少量KSCN溶液
加入铁粉后 ,溶液颜色为 ;
加入KSCN溶液后,溶液颜色
结论:Fe3+具有性
(3)、该兴趣小组未说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为。(4)、某反应中反应物与生成物有Fe2+ 、Fe3+、、H2O、H+和一种未知离子X。①已知氧化性:>Fe3+ ,则X离子是。
②该反应的离子方程式是 。
26. 反应2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O中,氧化剂是 , 还原剂是。27. 请补充反应:2Na+2H2O=2+H2↑,指出氧化剂。28. 硒和硫是同一主族元素,二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或H2SO4反应生成SeO2以回收Se。完成下列填空:(1)、Se和一定量的浓HNO3反应的还原产物为NO和NO2 , 且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3反应的化学方程式:。(2)、已知:Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O=Se+ +4H+ , SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是。(3)、回收得到的SeO2的含量,可以通过下面的方法测定:①SeO2+KI+_HNO3=Se+I2+KNO3+H2O
②I2+2Na2S2O3=Na2S4O6+2NaI
配平化学方程①,并标出电子转移的方向和数目。
(4)、实验中,准确称量SeO2样品0.1500g,消耗了0.2000mol·L-1的Na2S2O3溶液25.00mL,所测样品中SeO2的质量分数为。29. 铁是人类较早使用的金属之一。化学研究中涉及到铁及其化合物的相关文献种类很多。请回答下列问题:(1)、I.现有下列八种物质:①绿矾、②铁、③铁红、④Fe(OH)3胶体、⑤FeCl3溶液、⑥FeCl2、⑦K2FeO4、⑧FeO。下列说法正确的有____(填字母)。
A、不属于电解质的有①②④ B、④与⑤可用丁达尔效应区分 C、③⑧都属于碱性氧化物 D、①⑥⑧中均含有二价铁元素(2)、写出利用上述物质发生化合反应制备⑥的化学方程式:。(3)、部分含铁物质的分类与相应化合价的关系如图所示: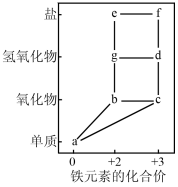
①写出g→d的化学方程式:。
②根据上述“价一类”二维图信息,下列说法正确的是(填字母)。
A.d胶体可用于饮用水消毒和净化
B.a转化为c只需控制纯氧的量即可实现
C.a→b→c→d之间的转化均可以通过一步反应实现
D.将a加入f的溶液中,溶液质量增加
(4)、II.高铁酸钾(K2FeO4)是一种暗紫色固体,易与水反应得到氧气和Fe(OH)3沉淀,是一种环保、高效、多功能饮用水处理剂,制备流程如图所示: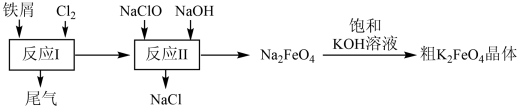
写出反应II的离子方程式:。
(5)、该条件下,物质的溶解性:Na2FeO4K2FeO4(填“>”或“<”)。(6)、现有两份失去标签的紫色K2FeO4固体和KMnO4固体,请设计相关实验方案加以鉴别:。30. A和B两支试管所盛的溶液中共含有K+、Ag+、Mg2+、Cl−、OH−、六种离子,向试管A的溶液中滴入酚酞溶液,溶液呈红色。请回答下列问题:
(1)、若向某试管中滴入稀盐酸产生沉淀,则该试管为(填“A”或“B”)。(2)、若向试管B的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是(填化学式)。(3)、若将试管A和试管B中的溶液按一定体积比混合后过滤,蒸干所得滤液可得到一种纯净物,则混合过程中发生反应的离子方程式为、(不考虑Ag+与OH−的反应)。(4)、配平下列氧化还原反应方程式 H2S +
H2S +  HNO3(稀) =
HNO3(稀) =  H2O +
H2O +  S↓+
S↓+  NO↑
NO↑