2023-2024学年高中化学必修第一册1.1 物质的分类及转化(人教版)
试卷更新日期:2023-07-25 类型:同步测试
一、选择题
-
1. 高温下可用铝粉与氧化铁反应来焊接钢轨,其反应原理为2Al+Fe2O3Al2O3+2Fe,该反应属于( )A、化合反应 B、置换反应 C、分解反应 D、复分解反应2. 不能使悬浊液变澄清的是( )A、硫酸溶液 B、盐酸 C、氢氧化钠溶液 D、氨水3. 2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。从物质分类看,醋酸钠属于( )A、酸 B、盐 C、碱 D、混合物4. 下列关于FeCl3稀溶液、Fe(OH)3胶体、Fe(OH)3悬浊液的说法,正确的是A、三者均属于纯净物 B、三者的本质区别是能否发生丁达尔效应 C、分别对三者进行过滤操作,只有FeCl3溶液中的分散质粒子能穿过滤纸 D、向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续加热至红褐色可制得Fe(OH)3胶体5. 关于溶液和胶体说法正确的是( )A、两者都属于分散系 B、前者能通过滤纸而后者不能 C、用激光笔照射均有光亮通路 D、分散质粒子直径前者大于后者6. 纳米材料备受重视的今天,胶体化学的发展对纳米材料的制备有着重要意义,如图所示是制备胶体的实验装置,相关表述合理的是( )
 A、溶液与胶体的本质区别是能否产生丁达尔现象 B、胶体的直径在范围 C、由图可知制备胶体的离子方程式为(胶体) D、根据溶液与胶体的分散质大小可以判断1mol不可能产生1mol胶体7. 下列物质与化学品安全使用标志的对应关系错误的是
A、溶液与胶体的本质区别是能否产生丁达尔现象 B、胶体的直径在范围 C、由图可知制备胶体的离子方程式为(胶体) D、根据溶液与胶体的分散质大小可以判断1mol不可能产生1mol胶体7. 下列物质与化学品安全使用标志的对应关系错误的是 A、浓硫酸 B、二氧化硫 C、过氧化钠 D、硫化氢
A、浓硫酸 B、二氧化硫 C、过氧化钠 D、硫化氢二、多选题
-
8. 已知在一定条件下发生反应 , 下列判断正确的是( )A、若A、B为两种化合物,则该反应不一定为复分解反应 B、若C为硝酸铜,则该反应一定为复分解反应 C、若该反应的离子方程式中生成了水,则A,B一定是酸和碱 D、若A,B为碱和盐,则C,D中一定有一种为盐9. 下列物质既能与盐酸反应,又能与NaOH反应的是( )A、NaCl B、(NH4)2CO3 C、Na2SO4 D、NaHCO310. 下列物质分类错误的是( )
酸
碱
盐
碱性氧化物
酸性氧化物
A
硫酸
烧碱
食盐
氧化镁
干冰
B
硝酸
生石灰
硫酸铜
一氧化碳
二氧化硫
C
氯化氢
氢氧化钾
纯碱
生石灰
三氧化硫
D
醋酸
氢氧化钠
氯化铜
氧化铁
一氧化碳
A、A B、B C、C D、D11. 酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3PO2(次磷酸)与足量的NaOH反应只生成一种盐NaH2PO2 , 则下列说法正确的是( )A、H3PO2属于一元酸 B、H3PO2属于三元酸 C、NaH2PO2属于酸式盐 D、NaH2PO2属于正盐12. 许多马路两旁的树干都均匀地涂抹了石灰水.下列有关说法正确的是( )A、饱和石灰水加入生石灰,若温度不变,则溶液中Ca2+的物质的量不变 B、饱和石灰水加入生石灰,若温度不变,则pH不变 C、升高饱和石灰水的温度时,Ca(OH)2的溶度积常数Ksp不变 D、石灰水显碱性,能使蛋白质变性,所以有防治树木害虫病的作用13. 在物质混合、反应等过程中,会存在“1+1≠2”的现象.通常情况下,下列各种混合或反应过程中,“1+1”不等于“2”的是( )A、1g酒精和1g水混合后的总质量 B、1mL酒精与1mL水混合均匀后所得溶液的总体积 C、1g氢氧化钠溶液和1g醋酸溶液中和后溶液的总质量 D、温度一定时,1g饱和硝酸钾溶液中加入1g硝酸钾后,所得溶液的质量14. 下列关于胶体的说法正确的是( )A、向煮沸的水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 B、胶体和溶液的本质区别是能否产生丁达尔效应 C、胶体和溶液可以利用滤纸分离,这种提纯方式是渗析 D、丁达尔效应是胶体粒子对光线散射形成的,是一种物理现象15. 已知实验室制备胶体的化学方程式为:(胶体)某同学取的溶液于小试管中,加入适量粉末,有大量气体产生,固体溶解,液体颜色加深。过滤后用激光笔照射滤液,有明显的丁达尔现象。下列说法错误的是( )A、实验室制备氢氧化铁胶体需要继续不断加热 B、化学小组实验过程中产生的气体为 C、溶液与胶体的本质区别是丁达尔效应 D、用过量粉末代替粉末,胶体会发生聚沉16. 下列包装标错了的是( )选项
A
B
C
D
物质
浓硫酸
汽油
小苏打
胆矾
标识



 A、A B、B C、C D、D
A、A B、B C、C D、D三、非选择题
-
17. 钙元素存在如图循环转化关系。回答下列问题:
 (1)、上述转化关系中的、、、溶液、、六种物质中,属于电解质的有种,能导电有种,属于氧化物的是(填化学式);(2)、反应①~④中不涉及四个基本反应类型中的;(3)、写出反应③的化学方程式:。18. 二氧化碳通入澄清石灰水中,石灰水变浑浊,请用三种方法将浑浊的石灰水变澄清.19.
(1)、上述转化关系中的、、、溶液、、六种物质中,属于电解质的有种,能导电有种,属于氧化物的是(填化学式);(2)、反应①~④中不涉及四个基本反应类型中的;(3)、写出反应③的化学方程式:。18. 二氧化碳通入澄清石灰水中,石灰水变浑浊,请用三种方法将浑浊的石灰水变澄清.19.图中方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型.请分别填出:

(1)若图中B圈表示化合反应,则C圈表示 反应(填反应所属的基本类型)
(2)属于区域3的化学反应是
A.Cl2+2KBr═Br2+2KCl
B.2NaHCO3═Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O
 4Fe(OH)3
4Fe(OH)3D.CH4+2O2
 CO2+2H2O.20. 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4﹣(绿色)、Cr2O72﹣(橙红色)、CrO42﹣(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
CO2+2H2O.20. 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4﹣(绿色)、Cr2O72﹣(橙红色)、CrO42﹣(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是 . 产生这些现象的所有反应的离子方程式
21. 有四种物质:①氧化铝 ②稀硫酸 ③碳酸氢钠 ④氢氧化钠(1)、属于盐的物质是(填序号,下同).(2)、既能与强酸反应,又能与强碱反应的物质是 .(3)、分析铝与稀硫酸反应,i表示的内容为 .a.得到e﹣×6,化合价升高,被还原b.得到e﹣×6,化合价降低,被还原c.失去e﹣×6,化合价升高,被氧化.
 22. 在我们的日常生活中蕴含下列常识:
22. 在我们的日常生活中蕴含下列常识:①纯碱(Na2CO3)去油污,②小苏打(NaHCO3),③醋酸(CH3COOH)作为调味剂,④铁锈的主要成分为 , ⑤金刚石是自然界中最硬的一种物质,⑥可以杀菌,⑦明矾[]可以净水,⑧铜锈的主要成分为。
(1)、上述涉及的物质中,属于盐的有(填写序号,下同),属于酸的有 , 属于氧化物的有。(2)、金刚石的同素异形体有。(3)、根据交叉分类法,属于哪类物质____。A、酸 B、碱 C、铜盐 D、碱式盐 E、碳酸盐 F、混合物23. 按要求补全下列交叉分类法,在方框内写出相应物质的化学式。、、、。 24. 定性和定量是中学化学研究物质性质、组成的常用方法。胶体是一种重要的分散系(三种分散系分散质粒子大小如图示)。
24. 定性和定量是中学化学研究物质性质、组成的常用方法。胶体是一种重要的分散系(三种分散系分散质粒子大小如图示)。
某兴趣小组按如下实验步骤制备Cu(OH)2胶体:用洁净的烧杯取少量蒸馏水,加热至沸腾,向烧杯中慢慢加入数滴浓CuCl2溶液,得到蓝色透明的液体。制备原理用化学方程式表示为:CuCl2+2H2O(沸水)=Cu(OH)2(胶体)+2HCl。
(1)、Cu(OH)2胶体中分散质微粒直径范围是____。A、小于1nm B、1~10nm C、1~100nm D、大于100nm(2)、Cu(OH)2浊液与Cu(OH)2胶体性质不同,本质原因是____。A、分散剂的种类不同 B、颜色和透明程度不同 C、分散质粒子的大小不同 D、分散质粒子所带电荷不同(3)、下列哪种用于判断胶体制备成功的方法最简单____。A、丁达尔现象 B、半透膜实验 C、聚沉 D、电泳(4)、实验过程中,有一位同学向烧杯中一次性加入大量CuCl2溶液,结果没有制得胶体,反而出现了浑浊,请分析他实验失败的原因。25. 胶体和溶液的本质区别是 , 区分胶体和溶液的现象叫做现象。26. 将少量饱和FeCl3溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:甲:饱和FeCl3溶液滴加到冷水中;
乙:饱和FeCl3溶液滴加到NaOH溶液中;
丙:饱和FeCl3溶液滴加到沸水中。
(1)、将丙继续加热煮沸得到红褐色透明液体,反应的化学方程式为。(2)、用最简单的方法判断丙中是否成功制备胶体,请写出相关的操作、现象和结论。(3)、向经过检验后的丙中逐滴加入稀盐酸,会出现一系列变化:①先出现和乙中相同的现象,原因为。
②随后发生变化得到和甲相同的溶液,此反应的离子反应方程式为。
(4)、向丙中加入电极通电后,Fe(OH)3胶体粒子移向极;(填“阴极”或“阳极”)(5)、可用如图所示的装置除去Fe(OH)3胶体中的杂质离子来提纯Fe(OH)3胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入AgNO3溶液,若(填实验现象),则说明该Fe(OH)3胶体中的杂质离子已经完全除去。 27.
27.如图为甲、乙两种物质的溶解度曲线图,请根据图回答下列问题.
 (1)、P点的意义是(2)、若甲中混有少量乙,提纯甲的方法是(3)、将接近饱和的乙的溶液变成饱和溶液的方法是(4)、t2℃时,50g水中溶解 g甲恰好达到饱和状态,此时溶液中溶质的质量分数为 (精确到0.1%).(5)、将t2℃时甲和乙的饱和溶液分别降温到t1℃,两种溶液中溶质质量分数的关系是甲 (填“>”“<”或“=”)乙.28. 根据氯化钠的溶解度曲线,完成下列问题.
(1)、P点的意义是(2)、若甲中混有少量乙,提纯甲的方法是(3)、将接近饱和的乙的溶液变成饱和溶液的方法是(4)、t2℃时,50g水中溶解 g甲恰好达到饱和状态,此时溶液中溶质的质量分数为 (精确到0.1%).(5)、将t2℃时甲和乙的饱和溶液分别降温到t1℃,两种溶液中溶质质量分数的关系是甲 (填“>”“<”或“=”)乙.28. 根据氯化钠的溶解度曲线,完成下列问题.(1)A点所示溶液为某温度下氯化钠的 (选填“饱和”或“不饱和”)溶液.
(2)将B点所示的溶液升高温度到40℃(忽略水的蒸发),此时溶液中溶质质量分数将 (选填“变大”或“变小”或“不变”).
(3)B点代表20℃时氯化钠的溶解度为36.0g,若将满足B点指标的溶液恒温蒸发10g水,会有 g氯化钠晶体析出.
 29. 某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。(1)、若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是____;A、NaOH浓溶液 B、NaCl浓溶液 C、冷水 D、沸水(2)、从下列选项中选择适当的字母填空:
29. 某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。(1)、若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是____;A、NaOH浓溶液 B、NaCl浓溶液 C、冷水 D、沸水(2)、从下列选项中选择适当的字母填空:A.渗析 B.聚沉 C.电泳 D.丁达尔现象
①氢氧化铁胶体呈红褐色,插入两个惰性电极,通直流电一段时间,阴极附近的颜色逐渐变深,这种现象叫。
②强光通过氢氧化铁胶体,可看到光带,这种现象叫。
③淀粉与食盐的混合液放在肠衣中,并把它悬挂在盛有蒸馏水的烧瓶里,从而使淀粉与食盐分离,这种方法。
④若取少量制得的胶体加入试管中,加入硫酸铵溶液,产生红褐色沉淀,这种现象称为胶体的。
(3)、Fe(OH)3胶体区别于FeCl3溶液最本质的特征是____;A、Fe(OH)3胶体是均一的分散系 B、Fe(OH)3胶体具有丁达尔效应 C、Fe(OH)3胶体粒子的直径在1~100nm之间 D、Fe(OH)3胶体的分散质粒子能透过滤纸(4)、将制得的胶体放入半透膜制成的袋内,如图所示,放置2min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察(填“有”或“无 ”)丁达尔现象,再向试管中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为(填序号)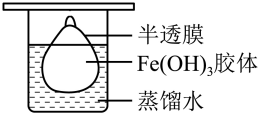
A.无明显现象 B.有白色沉淀产生
30. 现有甲、乙、丙三名同学分别进行胶体的制备实验。甲同学:向的溶液中加少量NaOH溶液。
乙同学:向25mL沸水中逐滴加入5~6滴饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
丙同学:直接加热饱和溶液。
试回答下列问题
(1)、其中操作正确的同学是 , 反应的化学方程式为。(2)、证明有胶体生成的方法是。(3)、将其装入U型管内,用石墨棒做电极,接通直流电源,通电一段时间后发现阴极附近颜色 , 这表明。(4)、向其中逐滴加入过量稀硫酸,现象是。(5)、可用如图所示的装置除去胶体中的杂质离子来提纯胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入溶液,若(填实验现象),则说明该胶体中的杂质离子已经完全除去。