近三年高考化学真题分类汇编:化学综合计算1
试卷更新日期:2023-07-24 类型:二轮复习
一、选择题
-
1. 油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄褪色的主要原因是发生了以下两种化学反应:

下列说法正确的是
A、和的空间结构都是正四面体形 B、反应Ⅰ和Ⅱ中,元素和S都被氧化 C、反应Ⅰ和Ⅱ中,参加反应的:Ⅰ<Ⅱ D、反应Ⅰ和Ⅱ中,氧化转移的电子数之比为3∶72. 葡萄糖酸钙是一种重要的补钙剂,工业上以葡萄糖、碳酸钙为原料,在溴化钠溶液中采用间接电氧化反应制备葡萄糖酸钙,其阳极区反应过程如下:
下列说法错误的是
A、溴化钠起催化和导电作用 B、每生成葡萄糖酸钙,理论上电路中转移了电子 C、葡萄糖酸能通过分子内反应生成含有六元环状结构的产物 D、葡萄糖能发生氧化、还原、取代、加成和消去反应3. 我国古代四大发明之一黑火药的爆炸反应为:。设为阿伏加德罗常数的值,下列说法正确的是A、含键数目为 B、每生成转移电子数目为 C、晶体中含离子数目为 D、溶液中含数目为4. 为阿伏加德罗常数的值。下列叙述正确的是A、异丁烷分子中共价键的数目为 B、标准状况下,中电子的数目为 C、的溶液中的数目为 D、的溶液中的数目为5. 设为阿伏加德罗常数的值。下列说法正确的是( )A、中含有的中子数为 B、分子中含有的键数目为 C、标准状况下,气体中数目为 D、的溶液中数目为6. 常温常压下,电化学还原制氨气的总反应方程式: , 设为阿伏加德罗常数的值,下列说法正确的是( )A、水中含有的孤电子对数为 B、每产生失去的电子数为 C、氨水中,含有的分子数少于 D、消耗(已折算为标况)时,产生的分子数为7. 工业上用N2和H2合成NH3 , NA代表阿伏加德罗常数的值,下列说法正确的是( )A、消耗14gN2生成NH3分子数为2 NA B、消耗1molH2 , 生成N-H键数为2 NA C、生成标准状况下22.4LNH3 , 电子转移数为2 NA D、氧化1molNH3生成NO,需O2分子数为2 NA8. NA是阿伏加德罗常数的值。下列说法正确的是( )A、3.9gNa2O2与足量水反应,转移电子个数为0.1NA B、1.2gMg在空气中燃烧生成MgO和Mg3N2 , 转移电子个数为0.1NA C、2.7gAl与足量NaOH溶液反应,生成H2的个数为0.1NA D、6.0gSiO2与足量NaOH溶液反应,所得溶液中SiO的个数为0.1NA9. 在2.8gFe中加入100mL3mol/LHCl,Fe完全溶解。NA代表阿伏加德罗常数的值,下列说法正确的是( )A、反应转移电子为0.1mol B、HCl溶液中数为3NA C、含有的中子数为1.3NA D、反应生成标准状况下气体3.36L10. 为阿伏加德罗常数的值,下列说法正确的是( )A、中含有个阳离子 B、乙烷和丙烯的混合气体中所含碳氢键数为 C、含有中子数为 D、和于密闭容器中充分反应后,分子总数为11. 甲基丙烯酸甲酯是合成有机玻璃的单体。旧法合成的反应:
新法合成的反应:
下列说法错误的是(阿伏加德罗常数的值为 )( )
A、 的电子式为 B、新法没有副产物产生,原子利用率高 C、 的 溶液中 的微粒数小于 D、 的作用是降低反应的活化能,使活化分子数目增多,百分数不变12. 我国科学家进行了如图所示的碳循环研究。下列说法正确的是( )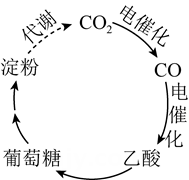 A、淀粉是多糖,在一定条件下能水解成葡萄糖 B、葡萄糖与果糖互为同分异构体,都属于烃类 C、 中含有 个电子 D、 被还原生成13. 化合物可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在以下热分解时无刺激性气体逸出。下列叙述正确的是( )
A、淀粉是多糖,在一定条件下能水解成葡萄糖 B、葡萄糖与果糖互为同分异构体,都属于烃类 C、 中含有 个电子 D、 被还原生成13. 化合物可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在以下热分解时无刺激性气体逸出。下列叙述正确的是( )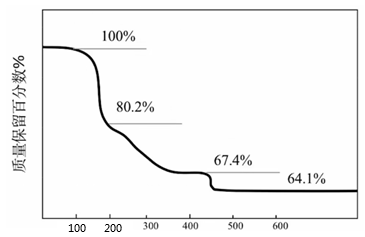 A、W、X、Y、Z的单质常温下均为气体 B、最高价氧化物的水化物的酸性: C、阶段热分解失去4个 D、热分解后生成固体化合物14. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、在25℃时,1LpH为12的Ba(OH)2溶液中含有OH-数目为0.01NA B、1.8g重水(D2O)中所含质子数为NA C、足量的浓盐酸与8.7gMnO2反应,转移电子的数目为0.4NA D、32g甲醇的分子中含有C—H键的数目为4NA15. 下列物质对应的化学式不正确的是( )A、氯仿:CHCl3 B、黄铜矿的主要成分:Cu2S C、芒硝:Na2SO4·10H2O D、铝土矿的主要成分:Al2O3
A、W、X、Y、Z的单质常温下均为气体 B、最高价氧化物的水化物的酸性: C、阶段热分解失去4个 D、热分解后生成固体化合物14. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、在25℃时,1LpH为12的Ba(OH)2溶液中含有OH-数目为0.01NA B、1.8g重水(D2O)中所含质子数为NA C、足量的浓盐酸与8.7gMnO2反应,转移电子的数目为0.4NA D、32g甲醇的分子中含有C—H键的数目为4NA15. 下列物质对应的化学式不正确的是( )A、氯仿:CHCl3 B、黄铜矿的主要成分:Cu2S C、芒硝:Na2SO4·10H2O D、铝土矿的主要成分:Al2O3二、非选择题
-
16. 某工厂采用如下工艺处理镍钴矿硫酸浸取液含(和)。实现镍、钴、镁元素的回收。

已知:
物质
回答下列问题:
(1)、用硫酸浸取镍钴矿时,提高浸取速率的方法为(答出一条即可)。(2)、“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸 , 中过氧键的数目为。(3)、“氧化”中,用石灰乳调节 , 被氧化为 , 该反应的离子方程式为(的电离第一步完全,第二步微弱);滤渣的成分为、(填化学式)。(4)、“氧化”中保持空气通入速率不变,(Ⅱ)氧化率与时间的关系如下。体积分数为时,(Ⅱ)氧化速率最大;继续增大体积分数时,(Ⅱ)氧化速率减小的原因是。 (5)、“沉钴镍”中得到的(Ⅱ)在空气中可被氧化成 , 该反应的化学方程式为。(6)、“沉镁”中为使沉淀完全 , 需控制不低于(精确至0.1)。17. 学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:(1)、铜与浓硝酸反应的装置如下图,仪器A的名称为 , 装置B的作用为。
(5)、“沉钴镍”中得到的(Ⅱ)在空气中可被氧化成 , 该反应的化学方程式为。(6)、“沉镁”中为使沉淀完全 , 需控制不低于(精确至0.1)。17. 学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:(1)、铜与浓硝酸反应的装置如下图,仪器A的名称为 , 装置B的作用为。 (2)、铜与过量反应的探究如下:
(2)、铜与过量反应的探究如下:
实验②中Cu溶解的离子方程式为;产生的气体为。比较实验①和②,从氧化还原角度说明的作用是。
(3)、用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,提纯干燥后的X在惰性氛围下加热,mgX完全分解为ng黑色氧化物Y,。X的化学式为。(4)、取含X粗品0.0500g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用标准溶液滴定,滴定终点时消耗标准溶液15.00mL。(已知: , )标志滴定终点的现象是 , 粗品中X的相对含量为。18. 元素分析是有机化合物的表征手段之一。按下图实验装置(部分装置略)对有机化合物进行C、H元素分析。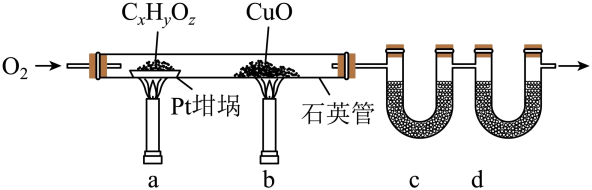
回答下列问题:
(1)、将装有样品的Pt坩埚和CuO放入石英管中,先 , 而后将已称重的U型管c、d与石英管连接,检查。依次点燃煤气灯 , 进行实验。(2)、O2的作用有。CuO的作用是(举1例,用化学方程式表示)。(3)、c和d中的试剂分别是、(填标号)。c和d中的试剂不可调换,理由是。A.CaCl2 B.NaCl C.碱石灰(CaO+NaOH) D.Na2SO3
(4)、Pt坩埚中样品CxHyOz反应完全后,应进行操作:。取下c和d管称重。(5)、若样品CxHyOz为0.0236g,实验结束后,c管增重0.0108g,d管增重0.0352g。质谱测得该有机物的相对分子量为118,其分子式为。19. 磷酸氢二铵[]常用于干粉灭火剂。某研究小组用磷酸吸收氢气制备 , 装置如图所示(夹持和搅拌装置已省略)。
回答问题:
(1)、实验室用和制备氨气的化学方程式为。(2)、现有浓质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的溶液,则需浓mL(保留一位小数)。(3)、装置中活塞的作用为。实验过程中,当出现现象时,应及时关闭 , 打开。(4)、当溶液pH为8.0~9.0时,停止通 , 即可制得溶液。若继续通入 , 当时,溶液中、和(填离子符号)浓度明显增加。(5)、若本实验不选用pH传感器,还可选用作指示剂,当溶液颜色由变为时,停止通。20. 工业上以氟磷灰石[ , 含等杂质]为原料生产磷酸和石膏,工艺流程如下:
回答下列问题:
(1)、酸解时有产生。氢氟酸与反应生成二元强酸 , 离子方程式为。(2)、部分盐的溶度积常数见下表。精制Ⅰ中,按物质的量之比加入脱氟,充分反应后,;再分批加入一定量的 , 首先转化为沉淀的离子是。(3)、浓度(以计)在一定范围时,石膏存在形式与温度、浓度(以计)的关系如图甲所示。酸解后,在所得、为45的混合体系中,石膏存在形式为(填化学式);洗涤时使用一定浓度的硫酸溶液而不使用水,原因是 , 回收利用洗涤液X的操作单元是;一定温度下,石膏存在形式与溶液中和的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是(填标号)。
A.、、 B.、、
C.、、 D.、、
21. 联合生产是化学综合利用资源的有效方法。煅烧石灰石反应:, 石灰石分解需要的能量由焦炭燃烧提供。将石灰石与焦炭按一定比例混合于石灰窑中,连续鼓入空气,使焦炭完全燃烧生成 , 其热量有效利用率为50%。石灰窑中产生的富含的窑气通入氨的氯化钠饱和溶液中,40%的最终转化为纯碱。已知:焦炭的热值为(假设焦炭不含杂质)。
请回答:
(1)、每完全分解石灰石(含 , 杂质不参与反应),需要投料焦炭。(2)、每生产纯碱,同时可获得(列式计算)。22. 化合物X由三种元素组成,某实验小组按如下流程进行相关实验:
化合物X在空气中加热到 , 不发生反应。
请回答:
(1)、组成X的三种元素为;X的化学式为。(2)、溶液C的溶质组成为(用化学式表示)。(3)、①写出由X到A的化学方程式。②X难溶于水,但可溶于氨水中,写出该反应的离子方程式。
(4)、设计实验,检验尾气中相对活泼的2种气体。23. 稀土( )包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下: 
已知:月桂酸 熔点为 ;月桂酸和 均难溶于水。该工艺条件下,稀土离子保持 价不变; 的 ; 开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子
开始沉淀时的pH
8.8
1.5
3.6
6.2~7.4
沉淀完全时的pH
/
3.2
4.7
/
(1)、“氧化调pH”中,化合价有变化的金属离子是。(2)、“过滤1”前,用 溶液调pH至的范围内,该过程中 发生反应的离子方程式为。(3)、“过滤2”后,滤饼中检测不到 元素,滤液2中 浓度为 。为尽可能多地提取 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中 低于 (保留两位有效数字)。(4)、①“加热搅拌”有利于加快 溶出、提高产率,其原因是。②“操作X”的过程为:先 , 再固液分离。
(5)、该工艺中,可再生循环利用的物质有(写化学式)。(6)、稀土元素钇(Y)可用于制备高活性的合金类催化剂 。①还原 和 熔融盐制备 时,生成
 转移 电子。
转移 电子。② 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化 的还原,发生的电极反应为。
24. 油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:(1)、已知下列反应的热化学方程式:①
②
③
计算热分解反应④的。
(2)、较普遍采用的处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解。相比克劳斯工艺,高温热分解方法的优点是 , 缺点是。(3)、在、反应条件下,将的混合气进行热分解反应。平衡时混合气中与的分压相等,平衡转化率为 , 平衡常数。(4)、在、反应条件下,对于分别为、、、、的混合气,热分解反应过程中转化率随时间的变化如下图所示。
①越小,平衡转化率 , 理由是。
②对应图中曲线 , 计算其在之间,分压的平均变化率为。
25. 二草酸合铜(Ⅱ)酸钾()可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:Ⅰ.取已知浓度的溶液,搅拌下滴加足量溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
Ⅱ.向草酸()溶液中加入适量固体,制得和混合溶液。
Ⅲ.将Ⅱ的混合溶液加热至80~85 ℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:
(1)、由配制Ⅰ中的溶液,下列仪器中不需要的是(填仪器名称)。 (2)、长期存放的中,会出现少量白色固体,原因是。(3)、Ⅰ中的黑色沉淀是(写化学式)。(4)、Ⅱ中原料配比为 , 写出反应的化学方程式。(5)、Ⅱ中,为防止反应过于剧烈而引起喷溅,加入应采取的方法。(6)、Ⅲ中应采用进行加热。(7)、Ⅳ中“一系列操作”包括。26. 某同学设计实验确定Al(NO3)3·xH2O的结晶水数目。称取样品7.50g,经热分解测得气体产物中有NO2、O2、HNO3、H2O,其中H2O的质量为3.06g;残留的固体产物是Al2O3 , 质量为1.02g。计算:(1)、x=(写出计算过程)。(2)、气体产物中n(O2)mol。
(2)、长期存放的中,会出现少量白色固体,原因是。(3)、Ⅰ中的黑色沉淀是(写化学式)。(4)、Ⅱ中原料配比为 , 写出反应的化学方程式。(5)、Ⅱ中,为防止反应过于剧烈而引起喷溅,加入应采取的方法。(6)、Ⅲ中应采用进行加热。(7)、Ⅳ中“一系列操作”包括。26. 某同学设计实验确定Al(NO3)3·xH2O的结晶水数目。称取样品7.50g,经热分解测得气体产物中有NO2、O2、HNO3、H2O,其中H2O的质量为3.06g;残留的固体产物是Al2O3 , 质量为1.02g。计算:(1)、x=(写出计算过程)。(2)、气体产物中n(O2)mol。