近三年高考化学真题分类汇编:化学键与物质的性质(2021年)
试卷更新日期:2023-07-24 类型:二轮复习
一、选择题
-
1. 下列有关N、P及其化合物的说法错误的是( )A、N的电负性比P的大,可推断NCl3分子的极性比PCl3的大 B、N与N的π键比P与P的强,可推断N≡N的稳定性比P≡P的高 C、NH3的成键电子对间排斥力较大,可推断NH3的键角比PH3的大 D、HNO3的分子间作用力较小,可推断HNO3的熔点比H3PO4的低2. 某立方晶系的锑钾(Sb—K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构图,图b表示晶胞的一部分。下列说法正确的是( )
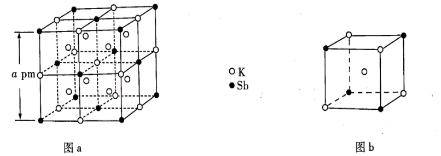 A、该晶胞的体积为a3×10-36cm-3 B、K和Sb原子数之比为3∶1 C、与Sb最邻近的K原子数为4 D、K和Sb之间的最短距离为 apm3. 甲烷单加氧酶(s—mmo)含有双核铁活性中心,是O2氧化CH4生成CH3OH的催化剂,反应过程如图所示。下列叙述错误的是( )
A、该晶胞的体积为a3×10-36cm-3 B、K和Sb原子数之比为3∶1 C、与Sb最邻近的K原子数为4 D、K和Sb之间的最短距离为 apm3. 甲烷单加氧酶(s—mmo)含有双核铁活性中心,是O2氧化CH4生成CH3OH的催化剂,反应过程如图所示。下列叙述错误的是( ) A、基态Fe原子的核外电子排布式为[Ar]3d64s2 B、步骤③有非极性键的断裂和极性键的形成 C、每一步骤都存在铁和氧元素之间的电子转移 D、图中的总过程可表示为:CH4+O2+2H++2e- CH3OH+H2O4. 关于反应 所涉及的物质,下列说法错误的是( )A、H2SO4在该反应中为氧化剂 B、Na2SO3容易被空气中的O2氧化变质 C、Na2SO4是含有共价键的离子化合物 D、SO2是导致酸雨的主要有害污染物5. 下列各组物质的晶体类型相同的是( )A、SiO2和SO3 B、I2和NaCl C、Cu和Ag D、SiC和MgO6. 下列化学用语使用正确的是( )A、基态C原子价电子排布图:
A、基态Fe原子的核外电子排布式为[Ar]3d64s2 B、步骤③有非极性键的断裂和极性键的形成 C、每一步骤都存在铁和氧元素之间的电子转移 D、图中的总过程可表示为:CH4+O2+2H++2e- CH3OH+H2O4. 关于反应 所涉及的物质,下列说法错误的是( )A、H2SO4在该反应中为氧化剂 B、Na2SO3容易被空气中的O2氧化变质 C、Na2SO4是含有共价键的离子化合物 D、SO2是导致酸雨的主要有害污染物5. 下列各组物质的晶体类型相同的是( )A、SiO2和SO3 B、I2和NaCl C、Cu和Ag D、SiC和MgO6. 下列化学用语使用正确的是( )A、基态C原子价电子排布图: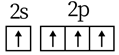 B、 结构示意图:
B、 结构示意图: 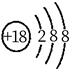 C、 形成过程:
C、 形成过程: 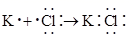 D、质量数为2的氢核素:
7. 有机物a、b、c的结构如图。下列说法正确的是( )
D、质量数为2的氢核素:
7. 有机物a、b、c的结构如图。下列说法正确的是( )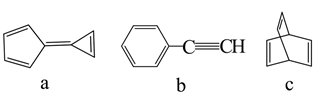 A、a的一氯代物有3种 B、b是
A、a的一氯代物有3种 B、b是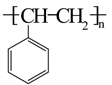 的单体
C、c中碳原子的杂化方式均为
D、a、b、c互为同分异构体
8. 单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。下列说法错误的是( )
的单体
C、c中碳原子的杂化方式均为
D、a、b、c互为同分异构体
8. 单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。下列说法错误的是( ) A、S位于元素周期表p区 B、该物质的化学式为 C、S位于H构成的八面体空隙中 D、该晶体属于分子晶体9. SF6可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关SF6的说法正确的是( )
A、S位于元素周期表p区 B、该物质的化学式为 C、S位于H构成的八面体空隙中 D、该晶体属于分子晶体9. SF6可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关SF6的说法正确的是( ) A、是非极性分子 B、键角 都等于90° C、 与 之间共用电子对偏向S D、 原子满足8电子稳定结构10. 关于CH3OH、N2H4和(CH3)2NNH2的结构与性质,下列说法错误的是( )A、CH3OH为极性分子 B、N2H4空间结构为平面形 C、N2H4的沸点高于(CH3)2NNH2 D、CH3OH和(CH3)2NNH2中C、O、N杂化方式均相同11. 下列“类比”结果不正确的是( )A、 的热稳定性比 的弱,则 的热稳定性比 的弱 B、 的分子构型为V形,则二甲醚的分子骨架( )构型为V形 C、 的溶解度比 的大,则 的溶解度比 的大 D、将丙三醇加入新制 中溶液呈绛蓝色,则将葡萄糖溶液加入新制 中溶液也呈绛蓝色12. W、X、Y、Z为原子序数依次增大的短周期主族元素,Z的最外层电子数是W和X的最外层电子数之和,也是Y的最外层电子数的2倍。W和X的单质常温下均为气体。下列叙述正确的是( )A、原子半径: B、W与X只能形成一种化合物 C、Y的氧化物为碱性氧化物,不与强碱反应 D、W、X和Z可形成既含有离子键又含有共价键的化合物13. 有关
A、是非极性分子 B、键角 都等于90° C、 与 之间共用电子对偏向S D、 原子满足8电子稳定结构10. 关于CH3OH、N2H4和(CH3)2NNH2的结构与性质,下列说法错误的是( )A、CH3OH为极性分子 B、N2H4空间结构为平面形 C、N2H4的沸点高于(CH3)2NNH2 D、CH3OH和(CH3)2NNH2中C、O、N杂化方式均相同11. 下列“类比”结果不正确的是( )A、 的热稳定性比 的弱,则 的热稳定性比 的弱 B、 的分子构型为V形,则二甲醚的分子骨架( )构型为V形 C、 的溶解度比 的大,则 的溶解度比 的大 D、将丙三醇加入新制 中溶液呈绛蓝色,则将葡萄糖溶液加入新制 中溶液也呈绛蓝色12. W、X、Y、Z为原子序数依次增大的短周期主族元素,Z的最外层电子数是W和X的最外层电子数之和,也是Y的最外层电子数的2倍。W和X的单质常温下均为气体。下列叙述正确的是( )A、原子半径: B、W与X只能形成一种化合物 C、Y的氧化物为碱性氧化物,不与强碱反应 D、W、X和Z可形成既含有离子键又含有共价键的化合物13. 有关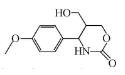 的说法错误的是( ) A、分子中至少有12个原子共平面 B、完全水解后所得有机物分子中手性碳原子数目为1个 C、与FeCl3溶液作用显紫色 D、与足量NaOH溶液完全反应后生成的钠盐只有1种14. 下列含有共价键的盐是( )A、CaCl2 B、H2SO4 C、Ba(OH)2 D、Na2CO3
的说法错误的是( ) A、分子中至少有12个原子共平面 B、完全水解后所得有机物分子中手性碳原子数目为1个 C、与FeCl3溶液作用显紫色 D、与足量NaOH溶液完全反应后生成的钠盐只有1种14. 下列含有共价键的盐是( )A、CaCl2 B、H2SO4 C、Ba(OH)2 D、Na2CO3二、多选题
-
15. 短周期主族元素 、 、 、 的原子序数依次增大, 离子与 分子均含有14个电子;习惯上把电解饱和 水溶液的工业生产称为氯碱工业。下列判断正确的是( )A、原子半径: B、最高价氧化物对应的水化物的酸性: C、化合物 的水溶液呈中性 D、 分子中既有 键又有 键16. 立体异构包括顺反异构、对映异构等。有机物M(2-甲基-2-丁醇)存在如图转化关系,下列说法错误的是( )
 A、N分子可能存在顺反异构 B、L的任一同分异构体最多有1个手性碳原子 C、M的同分异构体中,能被氧化为酮的醇有4种 D、L的同分异构体中,含两种化学环境氢的只有1种
A、N分子可能存在顺反异构 B、L的任一同分异构体最多有1个手性碳原子 C、M的同分异构体中,能被氧化为酮的醇有4种 D、L的同分异构体中,含两种化学环境氢的只有1种三、非选择题
-
17. 铁单质及其化合物的应用非常广泛。(1)、基态Fe原子的价层电子排布式为。(2)、用X射线衍射测定,得到Fe的两种晶胞A、B,其结构如图所示。晶胞A中每个Fe原子紧邻的原子数为。每个晶胞B中含Fe原子数为。
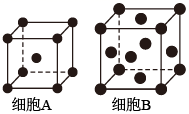 (3)、合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式。从能量角度分析,铁触媒的作用是。
(3)、合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式。从能量角度分析,铁触媒的作用是。 (4)、Fe3+可与H2O、SCN-、F-等配体形成配位数为6的配离子,如 、 、 。某同学按如下步骤完成实验:
(4)、Fe3+可与H2O、SCN-、F-等配体形成配位数为6的配离子,如 、 、 。某同学按如下步骤完成实验:
① 为浅紫色,但溶液Ⅰ却呈黄色,其原因是 , 为了能观察到溶液Ⅰ中 的浅紫色,可采取的方法是。
②已知Fe3+与SCN-、F-的反应在溶液中存在以下平衡: ; ,向溶液Ⅱ中加入NaF后,溶液颜色由红色转变为无色。若该反应是可逆反应,其离子方程式为 , 平衡常数为(用K1和K2表示)。
18. 非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:(1)、基态F原子核外电子的运动状态有 种。(2)、O、F、Cl电负性由大到小的顺序为;OF2分子的空间构型为;OF2的熔、沸点 (填“高于”或“低于”)Cl2O,原因是。(3)、Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为 , 下列对XeF2中心原子杂化方式推断合理的是(填标号)。A.sp B.sp2 C.sp3 D.sp3d
(4)、XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( , , )。已知Xe—F键长为rpm,则B点原子的分数坐标为;晶胞中A、B间距离d=pm。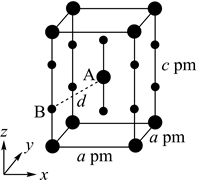 19.(1)、已知3种原子晶体的熔点数据如下表:
19.(1)、已知3种原子晶体的熔点数据如下表:金刚石
碳化硅
晶体硅
熔点/℃
>3550
2600
1415
金刚石熔点比晶体硅熔点高的原因是。
(2)、提纯含有少量氯化钠的甘氨酸样品:将样品溶于水,调节溶液的pH使甘氨酸结晶析出,可实现甘氨酸的提纯。其理由是。20. [选修3:物质结构与性质]很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。
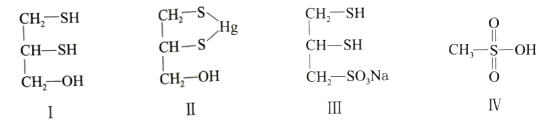 (1)、基态硫原子价电子排布式为。(2)、H2S、CH4、H2O的沸点由高到低顺序为。(3)、汞的原子序数为80,位于元素周期表第周期第ⅡB族。(4)、化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有________。A、在I中S原子采取sp3杂化 B、在Ⅱ中S元素的电负性最大 C、在Ⅲ中C-C-C键角是180° D、在Ⅲ中存在离子键与共价键 E、在Ⅳ中硫氧键的键能均相等(5)、汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是。(6)、理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图9a所示)中部分Ge原子被Hg和Sb取代后形成。
(1)、基态硫原子价电子排布式为。(2)、H2S、CH4、H2O的沸点由高到低顺序为。(3)、汞的原子序数为80,位于元素周期表第周期第ⅡB族。(4)、化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有________。A、在I中S原子采取sp3杂化 B、在Ⅱ中S元素的电负性最大 C、在Ⅲ中C-C-C键角是180° D、在Ⅲ中存在离子键与共价键 E、在Ⅳ中硫氧键的键能均相等(5)、汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是。(6)、理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图9a所示)中部分Ge原子被Hg和Sb取代后形成。
①图9b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是。
②图9c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为;该晶胞中粒子个数比Hg:Ge:Sb = 。
③设X的最简式的式量为Mr , 则X晶体的密度为g/cm3(列出算式)。
21. [化学-选修3:物质结构与性质]我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)、太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为;单晶硅的晶体类型为。SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为。SiCl4可发生水解反应,机理如下: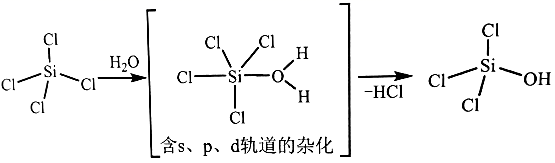 含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2 , 中间体SiCl4(H2O)中Si采取的杂化类型为(填标号)。(2)、CO2分子中存在个 键和个 键。(3)、甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是。(4)、我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是 , 晶胞参数为a pm、a pm、c pm,该晶体密度为g·cm-3(写出表达式)。在ZrO2中掺杂少量ZrO后形成的催化剂,化学式可表示为ZnxZr1-xOy , 则y=(用x表达)。
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2 , 中间体SiCl4(H2O)中Si采取的杂化类型为(填标号)。(2)、CO2分子中存在个 键和个 键。(3)、甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是。(4)、我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是 , 晶胞参数为a pm、a pm、c pm,该晶体密度为g·cm-3(写出表达式)。在ZrO2中掺杂少量ZrO后形成的催化剂,化学式可表示为ZnxZr1-xOy , 则y=(用x表达)。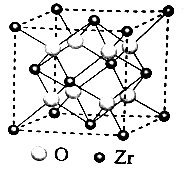 22. [选修3:物质结构与性质]
22. [选修3:物质结构与性质]硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
(1)、基态硅原子最外层的电子排布图为 , 晶体硅和碳化硅熔点较高的是(填化学式);(2)、硅和卤素单质反应可以得到 , 的熔沸点如下表:熔点/K
183.0
203.2
278.6
393.7
沸点/K
187.2
330.8
427.2
560.7
①0℃时, 、 、 、 呈液态的是(填化学式),沸点依次升高的原因是 , 气态 分子的空间构型是;
② 与N-甲基咪唑
 反应可以得到 ,其结构如图所示:
反应可以得到 ,其结构如图所示:
N-甲基咪唑分子中碳原子的杂化轨道类型为 , H、C、N的电负性由大到小的顺序为 , 1个 中含有个 键;
(3)、下图是 、 、 三种元素形成的某化合物的晶胞示意图。
①已知化合物中 和 的原子个数比为1:4,图中Z表示原子(填元素符号),该化合物的化学式为;
②已知该晶胞的晶胞参数分别为anm、bnm、cnm, ,则该晶体的密度 (设阿伏加德罗常数的值为 ,用含a、b、c、 的代数式表示)。
23. [选修3:物质结构与性质]KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:
(1)、在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是(填离子符号)。(2)、原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用- 表示,称为电子的自旋磁量子数.对于基态的磷原子,其价电子自旋磁量子数的代数和为。(3)、已知有关氨、磷的单键和三键的键能(kJ•mol-1)如表:N—N
N≡N
P—P
P≡P
193
946
197
489
从能量角度看,氮以N2、而白磷以P4(结构式可表示为
 )形式存在的原因是。(4)、已知KH2PO2是次磷酸的正盐,H3PO2的结构式为 , 其中P采取杂化方式。(5)、与PO 电子总数相同的等电子体的分子式为。(6)、磷酸通过分子间脱水缩合形成多磷酸,如:
)形式存在的原因是。(4)、已知KH2PO2是次磷酸的正盐,H3PO2的结构式为 , 其中P采取杂化方式。(5)、与PO 电子总数相同的等电子体的分子式为。(6)、磷酸通过分子间脱水缩合形成多磷酸,如: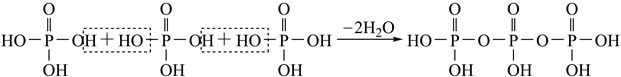 如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。(7)、分别用○、●表示H2PO 和K+ , KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO 、K+在晶胞xz面、yz面上的位置:
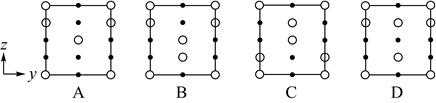
如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。(7)、分别用○、●表示H2PO 和K+ , KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO 、K+在晶胞xz面、yz面上的位置:
①若晶胞底边的边长均为apm、高为cpm,阿伏加德罗常数的值为NA , 晶体的密度__g•cm-3(写出表达式)。
②晶胞在x轴方向的投影图为__(填标号)。
 24. [化学——选修3:物质结构与性质]
24. [化学——选修3:物质结构与性质]过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用,回答下列问题:
(1)、对于基态Cr原子,下列叙述正确的是(填标号)。A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar] 3d54s1
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)、三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是 , 中心离子的配位数为。(3)、[Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如下图所示。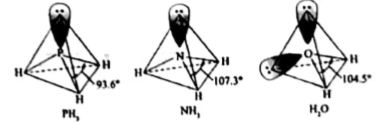
PH3中P的杂化类型是 , NH3的沸点比PH3的 , 原因是。H2O的键角小于NH3的,分析原因。
(4)、在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示。处于顶角位置的是原子。设Cr和Al原子半径分别为 和 ,则金属原子空间占有率为%(列出计算表达式)。25.(1)、用质谱仪检测气态乙酸时,谱图中出现质荷比(相对分子质量)为120的峰,原因是。(2)、金属镓(Ga)位于元素周期表中第4周期IIIA族,其卤化物的熔点如下表:GaF3
GaCl3
GaBr3
熔点/℃
> 1000
77. 75
122. 3
GaF3熔点比GaCl3熔点高很多的原因是。