近三年高考化学真题分类汇编:化学键与物质的性质(2023年)
试卷更新日期:2023-07-24 类型:二轮复习
一、选择题
-
1. 科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为。阿伏加德罗常数的值为。下列说法错误的是
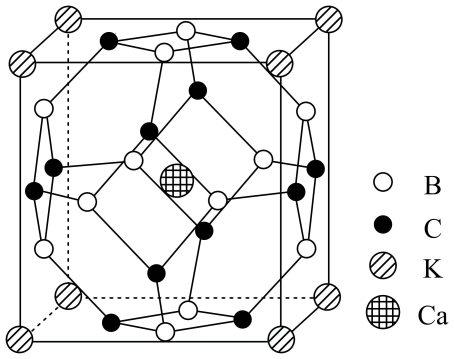 A、晶体最简化学式为 B、晶体中与最近且距离相等的有8个 C、晶胞中B和C原子构成的多面体有12个面 D、晶体的密度为2. 是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某(Ⅱ)催化剂(用表示)能高效电催化氧化合成 , 其反应机理如图所示。
A、晶体最简化学式为 B、晶体中与最近且距离相等的有8个 C、晶胞中B和C原子构成的多面体有12个面 D、晶体的密度为2. 是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某(Ⅱ)催化剂(用表示)能高效电催化氧化合成 , 其反应机理如图所示。
下列说法错误的是
A、(Ⅱ)被氧化至(Ⅲ)后,配体失去质子能力增强 B、M中的化合价为 C、该过程有非极性键的形成 D、该过程的总反应式:3. 下列有关物质结构和性质的说法错误的是A、含有手性碳原子的分子叫做手性分子 B、邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点 C、酰胺在酸或碱存在并加热的条件下可发生水解反应 D、冠醚(18-冠-6)的空穴与K+尺寸适配,两者能通过弱相互作用形成超分子4. 油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄褪色的主要原因是发生了以下两种化学反应:
下列说法正确的是
A、和的空间结构都是正四面体形 B、反应Ⅰ和Ⅱ中,元素和S都被氧化 C、反应Ⅰ和Ⅱ中,参加反应的:Ⅰ<Ⅱ D、反应Ⅰ和Ⅱ中,氧化转移的电子数之比为3∶75. 下列化学用语表述错误的是A、HClO的电子式: B、中子数为10的氧原子:O
C、NH3分子的VSEPR模型:
B、中子数为10的氧原子:O
C、NH3分子的VSEPR模型: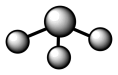 D、基态N原子的价层电子排布图:
D、基态N原子的价层电子排布图: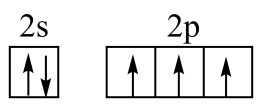 6. 在光照下,螺呲喃发生开、闭环转换而变色,过程如下。下列关于开、闭环螺呲喃说法正确的是
6. 在光照下,螺呲喃发生开、闭环转换而变色,过程如下。下列关于开、闭环螺呲喃说法正确的是 A、均有手性 B、互为同分异构体 C、N原子杂化方式相同 D、闭环螺吡喃亲水性更好7. 晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是
A、均有手性 B、互为同分异构体 C、N原子杂化方式相同 D、闭环螺吡喃亲水性更好7. 晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是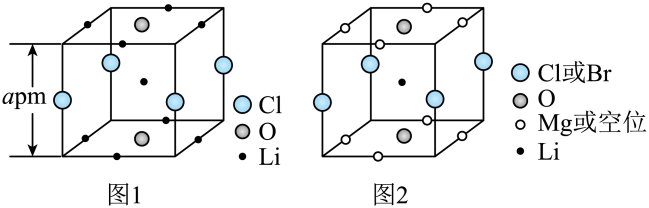 A、图1晶体密度为g∙cm-3 B、图1中O原子的配位数为6 C、图2表示的化学式为 D、取代产生的空位有利于传导8. 下列化学用语或表述正确的是
A、图1晶体密度为g∙cm-3 B、图1中O原子的配位数为6 C、图2表示的化学式为 D、取代产生的空位有利于传导8. 下列化学用语或表述正确的是 A、BeCl2的空间结构:V形 B、P4中的共价键类型:非极性键 C、基态Ni原子价电子排布式:3d10 D、顺—2—丁烯的结构简式:9. 中科院院士研究发现,纤维素可在低温下溶于NaOH溶液,恢复至室温后不稳定,加入尿素可得到室温下稳定的溶液,为纤维素绿色再生利用提供了新的解决方案。下列说法错误的是
A、BeCl2的空间结构:V形 B、P4中的共价键类型:非极性键 C、基态Ni原子价电子排布式:3d10 D、顺—2—丁烯的结构简式:9. 中科院院士研究发现,纤维素可在低温下溶于NaOH溶液,恢复至室温后不稳定,加入尿素可得到室温下稳定的溶液,为纤维素绿色再生利用提供了新的解决方案。下列说法错误的是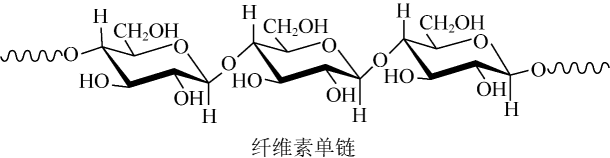 A、纤维素是自然界分布广泛的一种多糖 B、纤维素难溶于水的主要原因是其链间有多个氢键 C、NaOH提供破坏纤维素链之间的氢键 D、低温降低了纤维素在NaOH溶液中的溶解性10. 物质结构决定物质性质。下列性质差异与结构因素匹配错误的是
A、纤维素是自然界分布广泛的一种多糖 B、纤维素难溶于水的主要原因是其链间有多个氢键 C、NaOH提供破坏纤维素链之间的氢键 D、低温降低了纤维素在NaOH溶液中的溶解性10. 物质结构决定物质性质。下列性质差异与结构因素匹配错误的是选项
性质差异
结构因素
A
沸点:正戊烷(36.1℃)高于新戊烷(9.5℃)
分子间作用力
B
熔点:(1040℃)远高于(178℃升华)
晶体类型
C
酸性:()远强于()
羟基极性
D
溶解度(20℃):(29g)大于(8g)
阴离子电荷
A、A B、B C、C D、D11. 工业制备高纯硅的主要过程如下:石英砂粗硅高纯硅
下列说法错误的是
A、制备粗硅的反应方程式为 B、1molSi含Si-Si键的数目约为 C、原料气HCl和应充分去除水和氧气 D、生成的反应为熵减过程12. W、X、Y、Z为原子序数依次增加的同一短周期元素,其中X、Y、Z相邻,W的核外电子数与X的价层电子数相等,是氧化性最强的单质,4种元素可形成离子化合物。下列说法正确的是A、分子的极性: B、第一电离能:X<Y<Z C、氧化性: D、键能:13. 价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是A、和的VSEPR模型均为四面体 B、和的空间构型均为平面三角形 C、和均为非极性分子 D、与的键角相等14. 化学用语可以表达化学过程,下列化学用语的表达错误的是A、用电子式表示的形成: B、用离子方程式表示溶于烧碱溶液:
C、用电子云轮廓图表示H-H的s-sσ键形成的示意图:
B、用离子方程式表示溶于烧碱溶液:
C、用电子云轮廓图表示H-H的s-sσ键形成的示意图: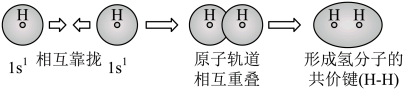 D、用化学方程式表示尿素与甲醛制备线型脲醛树脂:
D、用化学方程式表示尿素与甲醛制备线型脲醛树脂: 15. 镧La和H可以形成一系列晶体材料 , 在储氢和超导等领域具有重要应用。 , 属于立方晶系,晶胞结构和参数如图所示。高压下,中的每个H结合4个H形成类似的结构,即得到晶体。下列说法错误的是
15. 镧La和H可以形成一系列晶体材料 , 在储氢和超导等领域具有重要应用。 , 属于立方晶系,晶胞结构和参数如图所示。高压下,中的每个H结合4个H形成类似的结构,即得到晶体。下列说法错误的是 A、晶体中La的配位数为8 B、晶体中H和H的最短距离: C、在晶胞中,H形成一个顶点数为40的闭合多面体笼 D、单位体积中含氢质量的计算式为16. 一种可吸附甲醇的材料,其化学式为 , 部分晶体结构如下图所示,其中为平面结构。
A、晶体中La的配位数为8 B、晶体中H和H的最短距离: C、在晶胞中,H形成一个顶点数为40的闭合多面体笼 D、单位体积中含氢质量的计算式为16. 一种可吸附甲醇的材料,其化学式为 , 部分晶体结构如下图所示,其中为平面结构。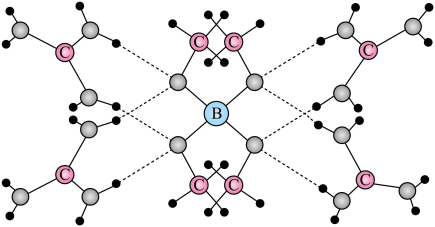
下列说法正确的是
A、该晶体中存在N-H…O氢键 B、基态原子的第一电离能: C、基态原子未成对电子数: D、晶体中B、N和O原子轨道的杂化类型相同17. “肼合成酶”以其中的配合物为催化中心,可将与转化为肼(),其反应历程如下所示。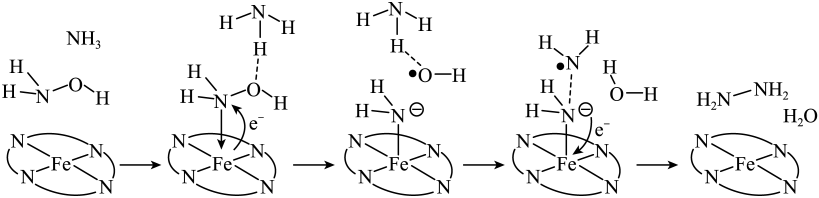
下列说法错误的是
A、、和均为极性分子 B、反应涉及、键断裂和键生成 C、催化中心的被氧化为 , 后又被还原为 D、将替换为 , 反应可得18. 共价化合物中所有原子均满足8电子稳定结构,一定条件下可发生反应: , 下列说法错误的是A、的结构式为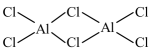 B、为非极性分子
C、该反应中的配位能力大于氯
D、比更难与发生反应
19. 下列物质中属于耐高温酸性氧化物的是A、 B、 C、 D、20. 下列化学用语表示正确的是A、中子数为18的氯原子: B、碳的基态原子轨道表示式:
B、为非极性分子
C、该反应中的配位能力大于氯
D、比更难与发生反应
19. 下列物质中属于耐高温酸性氧化物的是A、 B、 C、 D、20. 下列化学用语表示正确的是A、中子数为18的氯原子: B、碳的基态原子轨道表示式: C、的空间结构:
C、的空间结构: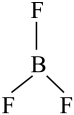 (平面三角形)
D、的形成过程:
(平面三角形)
D、的形成过程:
二、非选择题
-
21. 超纯是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯方面取得了显著成果,工业上以粗镓为原料,制备超纯的工艺流程如下:

已知:①金属的化学性质和相似,的熔点为;
②(乙醚)和(三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
物质
沸点/
55.7
34.6
42.4
365.8
回答下列问题:
(1)、晶体的晶体类型是;(2)、“电解精炼”装置如图所示,电解池温度控制在的原因是 , 阴极的电极反应式为; (3)、“合成”工序中的产物还包括和 , 写出该反应的化学方程式:;(4)、“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是;(5)、下列说法错误的是____;A、流程中得到了循环利用 B、流程中,“合成”至“工序X”需在无水无氧的条件下进行 C、“工序X”的作用是解配 , 并蒸出 D、用核磁共振氢谱不能区分和(6)、直接分解不能制备超纯 , 而本流程采用“配体交换”工艺制备超纯的理由是;(7)、比较分子中的键角大小:(填“>”“<”或“=”),其原因是。22. 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物()。回答下列问题:(1)、基态原子的价电子排布式为。橄榄石中,各元素电负性大小顺序为 , 铁的化合价为。(2)、已知一些物质的熔点数据如下表:
(3)、“合成”工序中的产物还包括和 , 写出该反应的化学方程式:;(4)、“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是;(5)、下列说法错误的是____;A、流程中得到了循环利用 B、流程中,“合成”至“工序X”需在无水无氧的条件下进行 C、“工序X”的作用是解配 , 并蒸出 D、用核磁共振氢谱不能区分和(6)、直接分解不能制备超纯 , 而本流程采用“配体交换”工艺制备超纯的理由是;(7)、比较分子中的键角大小:(填“>”“<”或“=”),其原因是。22. 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物()。回答下列问题:(1)、基态原子的价电子排布式为。橄榄石中,各元素电负性大小顺序为 , 铁的化合价为。(2)、已知一些物质的熔点数据如下表:物质
熔点/℃
800.7
与均为第三周期元素,熔点明显高于 , 原因是。分析同族元素的氯化物、、熔点变化趋势及其原因。的空间结构为 , 其中的轨道杂化形式为。
(3)、一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有个。该物质化学式为 , B-B最近距离为。 23. 氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:(1)、根据图1数据计算反应的。
23. 氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:(1)、根据图1数据计算反应的。 (2)、研究表明,合成氨反应在催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,表示被吸附于催化剂表面的)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为(填步骤前的标号),理由是。(3)、合成氨催化剂前驱体(主要成分为)使用前经还原,生成包裹的。已知属于立方晶系,晶胞参数 , 密度为 , 则晶胞中含有的原子数为(列出计算式,阿伏加德罗常数的值为)。(4)、在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为 , 另一种为。(物质i的摩尔分数:)
(2)、研究表明,合成氨反应在催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,表示被吸附于催化剂表面的)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为(填步骤前的标号),理由是。(3)、合成氨催化剂前驱体(主要成分为)使用前经还原,生成包裹的。已知属于立方晶系,晶胞参数 , 密度为 , 则晶胞中含有的原子数为(列出计算式,阿伏加德罗常数的值为)。(4)、在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为 , 另一种为。(物质i的摩尔分数:)
①图中压强由小到大的顺序为 , 判断的依据是。
②进料组成中含有情性气体的图是。
③图3中,当、时,氮气的转化率。该温度时,反应的平衡常数(化为最简式)。
24. 将酞菁—钴钛—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题:(1)、图1所示的几种碳单质,它们互为 , 其中属于原子晶体的是 , 间的作用力是。 (2)、酞菁和钴酞菁的分子结构如图2所示。
(2)、酞菁和钴酞菁的分子结构如图2所示。
酞菁分子中所有原子共平面,其中轨道能提供一对电子的原子是(填图2酞菁中原子的标号)。钴酞菁分子中,钴离子的化合价为 , 氮原子提供孤对电子与钴离子形成键。
(3)、气态通常以二聚体的形式存在,其空间结构如图3a所示,二聚体中的轨道杂化类型为。的熔点为 , 远高于的 , 由此可以判断铝氟之间的化学键为键。结构属立方晶系,晶胞如图3b所示,的配位数为。若晶胞参数为 , 晶体密度(列出计算式,阿伏加德罗常数的值为)。 25. 硅材料在生活中占有重要地位。请回答:(1)、分子的空间结构(以为中心)名称为 , 分子中氮原子的杂化轨道类型是。受热分解生成和 , 其受热不稳定的原因是。(2)、由硅原子核形成的三种微粒,电子排布式分别为:①、②、③ , 有关这些微粒的叙述,正确的是____。A、微粒半径:③>①>② B、电子排布属于基态原子(或离子)的是:①② C、电离一个电子所需最低能量:①>②>③ D、得电子能力:①>②(3)、Si与P形成的某化合物晶体的晶胞如图。该晶体类型是 , 该化合物的化学式为。
25. 硅材料在生活中占有重要地位。请回答:(1)、分子的空间结构(以为中心)名称为 , 分子中氮原子的杂化轨道类型是。受热分解生成和 , 其受热不稳定的原因是。(2)、由硅原子核形成的三种微粒,电子排布式分别为:①、②、③ , 有关这些微粒的叙述,正确的是____。A、微粒半径:③>①>② B、电子排布属于基态原子(或离子)的是:①② C、电离一个电子所需最低能量:①>②>③ D、得电子能力:①>②(3)、Si与P形成的某化合物晶体的晶胞如图。该晶体类型是 , 该化合物的化学式为。