近三年高考化学真题分类汇编:物质结构
试卷更新日期:2023-07-24 类型:二轮复习
一、选择题
-
1. 日光灯中用到的某种荧光粉的主要成分为3W3(ZX4)2·WY2。已知:X、Y、Z和W为原子序数依次增大的前20号元素,W为金属元素。基态X原子s轨道上的电子数和p轨道上的电子数相等,基态X、Y、Z原子的未成对电子数之比为2:1:3。下列说法正确的是A、电负性:X>Y>Z>W B、原子半径:X<Y<Z<W C、Y和W的单质都能与水反应生成气体 D、Z元素最高价氧化物对应的水化物具有强氧化性2. 下列化学用语表述错误的是A、HClO的电子式:
 B、中子数为10的氧原子:O
C、NH3分子的VSEPR模型:
B、中子数为10的氧原子:O
C、NH3分子的VSEPR模型: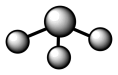 D、基态N原子的价层电子排布图:
D、基态N原子的价层电子排布图: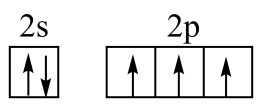 3. 下列化学用语或表述正确的是
3. 下列化学用语或表述正确的是 A、BeCl2的空间结构:V形 B、P4中的共价键类型:非极性键 C、基态Ni原子价电子排布式:3d10 D、顺—2—丁烯的结构简式:4. W、X、Y、Z为原子序数依次增加的同一短周期元素,其中X、Y、Z相邻,W的核外电子数与X的价层电子数相等,是氧化性最强的单质,4种元素可形成离子化合物。下列说法正确的是A、分子的极性: B、第一电离能:X<Y<Z C、氧化性: D、键能:5. 一种可吸附甲醇的材料,其化学式为 , 部分晶体结构如下图所示,其中为平面结构。
A、BeCl2的空间结构:V形 B、P4中的共价键类型:非极性键 C、基态Ni原子价电子排布式:3d10 D、顺—2—丁烯的结构简式:4. W、X、Y、Z为原子序数依次增加的同一短周期元素,其中X、Y、Z相邻,W的核外电子数与X的价层电子数相等,是氧化性最强的单质,4种元素可形成离子化合物。下列说法正确的是A、分子的极性: B、第一电离能:X<Y<Z C、氧化性: D、键能:5. 一种可吸附甲醇的材料,其化学式为 , 部分晶体结构如下图所示,其中为平面结构。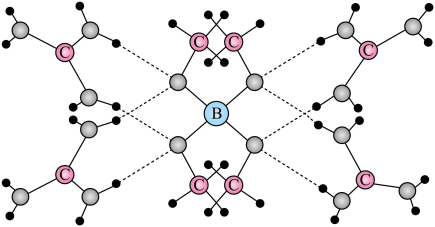
下列说法正确的是
A、该晶体中存在N-H…O氢键 B、基态原子的第一电离能: C、基态原子未成对电子数: D、晶体中B、N和O原子轨道的杂化类型相同6. X、Y、Z、M、Q五种短周期元素,原子序数依次增大。X的轨道全充满,Y的s能级电子数量是p能级的两倍,M是地壳中含量最多的元素,Q是纯碱中的一种元素。下列说法错误的是A、电负性: B、最高正价: C、Q与M的化合物中可能含有非极性共价键 D、最高价氧化物对应水化物的酸性:7. 共价化合物中所有原子均满足8电子稳定结构,一定条件下可发生反应: , 下列说法错误的是A、的结构式为 B、为非极性分子
C、该反应中的配位能力大于氯
D、比更难与发生反应
8. 下列化学用语表示正确的是A、中子数为18的氯原子: B、碳的基态原子轨道表示式:
B、为非极性分子
C、该反应中的配位能力大于氯
D、比更难与发生反应
8. 下列化学用语表示正确的是A、中子数为18的氯原子: B、碳的基态原子轨道表示式: C、的空间结构:
C、的空间结构: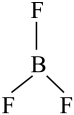 (平面三角形)
D、的形成过程:
(平面三角形)
D、的形成过程: 9. 工业上电解熔融和冰晶石的混合物可制得铝。下列说法正确的是( )A、半径大小: B、电负性大小: C、电离能大小: D、碱性强弱:10. 阅读下列材料,完成5~7题:
9. 工业上电解熔融和冰晶石的混合物可制得铝。下列说法正确的是( )A、半径大小: B、电负性大小: C、电离能大小: D、碱性强弱:10. 阅读下列材料,完成5~7题:周期表中IVA族元素及其化合物应用广泛。甲烷具有较大的燃烧热(890.3 kJ·mol-1),是常见燃料;Si、 Ge是重要的半导体材料,硅晶体表面SiO2能与氢氟酸(HF,弱酸)反应生成H2SiF6 (H2SiF6在水中完全电离为H+和SiF62- ); 1885年德国化学家将硫化锗(GeS2)与H2共热制得了门捷列夫预言的类硅-锗;我国古代就掌握了青铜(铜-锡合金)的冶炼、加工技术,制造出许多精美的青铜器;Pb、PbO2是铅蓄电池的电极材料,不同铅化合物一般具有不同颜色,历史上曾广泛用作颜料。
(1)、下列说法正确的是( )A、金刚石与石墨烯中的夹角都为 B、、都是由极性键构成的非极性分子 C、锗原子()基态核外电子排布式为 D、ⅣA族元素单质的晶体类型相同(2)、下列化学反应表示正确的是( )A、与HF溶液反应: B、高温下还原: C、铅蓄电池放电时的正极反应: D、甲烷的燃烧:(3)、下列物质性质与用途具有对应关系的是( )A、石墨能导电,可用作润滑剂 B、单晶硅熔点高,可用作半导体材料 C、青铜比纯铜熔点低、硬度大,古代用青铜铸剑 D、含铅化合物颜色丰富,可用作电极材料11. 利用反应可制备N2H4。下列叙述正确的是( )A、NH3分子有孤电子对,可做配体 B、NaCl晶体可以导电 C、一个N2H4分子中有4个σ键 D、NaClO和NaCl均为离子化合物,他们所含的化学键类型相同12. (锶)的、稳定同位素在同一地域土壤中值不变。土壤生物中值与土壤中值有效相关。测定土壤生物中值可进行产地溯源。下列说法错误的是( )A、位于元素周期表中第六周期、第ⅡA族 B、可用质谱法区分和 C、和含有的中子数分别为49和48 D、同一地域产出的同种土壤生物中值相同13. 下列化学用语或图示表达错误的是( )A、乙炔的结构简式: B、顺丁烯的分子结构模型: C、基态原子的价层电子的轨道表示式:
C、基态原子的价层电子的轨道表示式: D、的电子式:
D、的电子式: 14. 、的半衰期很短,自然界中不能稳定存在。人工合成反应如下:;。下列说法正确的是( )A、X的中子数为2 B、X、Y互为同位素 C、、可用作示踪原子研究化学反应历程 D、自然界不存在、分子是因其化学键不稳定15. 化合物可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在以下热分解时无刺激性气体逸出。下列叙述正确的是( )
14. 、的半衰期很短,自然界中不能稳定存在。人工合成反应如下:;。下列说法正确的是( )A、X的中子数为2 B、X、Y互为同位素 C、、可用作示踪原子研究化学反应历程 D、自然界不存在、分子是因其化学键不稳定15. 化合物可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在以下热分解时无刺激性气体逸出。下列叙述正确的是( )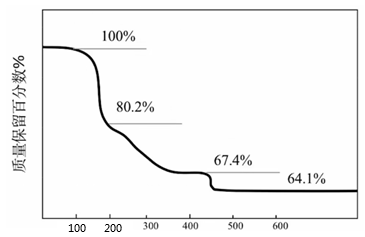 A、W、X、Y、Z的单质常温下均为气体 B、最高价氧化物的水化物的酸性: C、阶段热分解失去4个 D、热分解后生成固体化合物16. 甲烷单加氧酶(s—mmo)含有双核铁活性中心,是O2氧化CH4生成CH3OH的催化剂,反应过程如图所示。下列叙述错误的是( )
A、W、X、Y、Z的单质常温下均为气体 B、最高价氧化物的水化物的酸性: C、阶段热分解失去4个 D、热分解后生成固体化合物16. 甲烷单加氧酶(s—mmo)含有双核铁活性中心,是O2氧化CH4生成CH3OH的催化剂,反应过程如图所示。下列叙述错误的是( ) A、基态Fe原子的核外电子排布式为[Ar]3d64s2 B、步骤③有非极性键的断裂和极性键的形成 C、每一步骤都存在铁和氧元素之间的电子转移 D、图中的总过程可表示为:CH4+O2+2H++2e- CH3OH+H2O17. 下列化学用语表达正确的是( )A、F-的离子结构示意图:
A、基态Fe原子的核外电子排布式为[Ar]3d64s2 B、步骤③有非极性键的断裂和极性键的形成 C、每一步骤都存在铁和氧元素之间的电子转移 D、图中的总过程可表示为:CH4+O2+2H++2e- CH3OH+H2O17. 下列化学用语表达正确的是( )A、F-的离子结构示意图: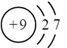 B、基态碳原子的轨道表示式:
B、基态碳原子的轨道表示式:  C、丙炔的键线式:
C、丙炔的键线式: 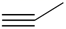 D、H2O分子的球棍模型:
D、H2O分子的球棍模型: 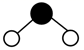 18. 某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法正确的是( )
18. 某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法正确的是( ) A、氢化物沸点: B、原子半径: C、第一电离能: D、阴、阳离子中均有配位键19. 下列化学用语使用正确的是( )A、基态C原子价电子排布图:
A、氢化物沸点: B、原子半径: C、第一电离能: D、阴、阳离子中均有配位键19. 下列化学用语使用正确的是( )A、基态C原子价电子排布图: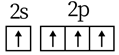 B、 结构示意图:
B、 结构示意图: 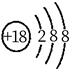 C、 形成过程:
C、 形成过程: 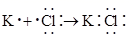 D、质量数为2的氢核素:
20. 单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。下列说法错误的是( )
D、质量数为2的氢核素:
20. 单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。下列说法错误的是( ) A、S位于元素周期表p区 B、该物质的化学式为 C、S位于H构成的八面体空隙中 D、该晶体属于分子晶体21. SF6可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关SF6的说法正确的是( )
A、S位于元素周期表p区 B、该物质的化学式为 C、S位于H构成的八面体空隙中 D、该晶体属于分子晶体21. SF6可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关SF6的说法正确的是( )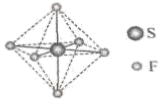 A、是非极性分子 B、键角 都等于90° C、 与 之间共用电子对偏向S D、 原子满足8电子稳定结构22. 下列有关放射性核素氚( H)的表述错误的是( )A、 H原子核外电子数为1 B、 H原子核内中子数为3 C、 与H2化学性质基本相同 D、 具有放射性23. “天问一号”着陆火星,“嫦娥五号”采回月壤。腾飞中国离不开化学,长征系列运载火箭使用的燃料有液氢和煤油等化学品。下列有关说法正确的是( )A、煤油是可再生能源 B、 燃烧过程中热能转化为化学能 C、火星陨石中的 质量数为20 D、月壤中的 与地球上的 互为同位素
A、是非极性分子 B、键角 都等于90° C、 与 之间共用电子对偏向S D、 原子满足8电子稳定结构22. 下列有关放射性核素氚( H)的表述错误的是( )A、 H原子核外电子数为1 B、 H原子核内中子数为3 C、 与H2化学性质基本相同 D、 具有放射性23. “天问一号”着陆火星,“嫦娥五号”采回月壤。腾飞中国离不开化学,长征系列运载火箭使用的燃料有液氢和煤油等化学品。下列有关说法正确的是( )A、煤油是可再生能源 B、 燃烧过程中热能转化为化学能 C、火星陨石中的 质量数为20 D、月壤中的 与地球上的 互为同位素二、非选择题
-
24. 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物()。回答下列问题:(1)、基态原子的价电子排布式为。橄榄石中,各元素电负性大小顺序为 , 铁的化合价为。(2)、已知一些物质的熔点数据如下表:
物质
熔点/℃
800.7
与均为第三周期元素,熔点明显高于 , 原因是。分析同族元素的氯化物、、熔点变化趋势及其原因。的空间结构为 , 其中的轨道杂化形式为。
(3)、一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有个。该物质化学式为 , B-B最近距离为。 25. 硅材料在生活中占有重要地位。请回答:(1)、分子的空间结构(以为中心)名称为 , 分子中氮原子的杂化轨道类型是。受热分解生成和 , 其受热不稳定的原因是。(2)、由硅原子核形成的三种微粒,电子排布式分别为:①、②、③ , 有关这些微粒的叙述,正确的是____。A、微粒半径:③>①>② B、电子排布属于基态原子(或离子)的是:①② C、电离一个电子所需最低能量:①>②>③ D、得电子能力:①>②(3)、Si与P形成的某化合物晶体的晶胞如图。该晶体类型是 , 该化合物的化学式为。
25. 硅材料在生活中占有重要地位。请回答:(1)、分子的空间结构(以为中心)名称为 , 分子中氮原子的杂化轨道类型是。受热分解生成和 , 其受热不稳定的原因是。(2)、由硅原子核形成的三种微粒,电子排布式分别为:①、②、③ , 有关这些微粒的叙述,正确的是____。A、微粒半径:③>①>② B、电子排布属于基态原子(或离子)的是:①② C、电离一个电子所需最低能量:①>②>③ D、得电子能力:①>②(3)、Si与P形成的某化合物晶体的晶胞如图。该晶体类型是 , 该化合物的化学式为。 26. 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为:。回答下列问题:(1)、合成氨反应在常温下(填“能”或“不能”)自发。(2)、温(填“高”或“低”,下同)有利于提高反应速率,温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用。
26. 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为:。回答下列问题:(1)、合成氨反应在常温下(填“能”或“不能”)自发。(2)、温(填“高”或“低”,下同)有利于提高反应速率,温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用。针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
(3)、方案一:双温-双控-双催化剂。使用双催化剂,通过光辐射产生温差(如体系温度为时,的温度为 , 而的温度为)。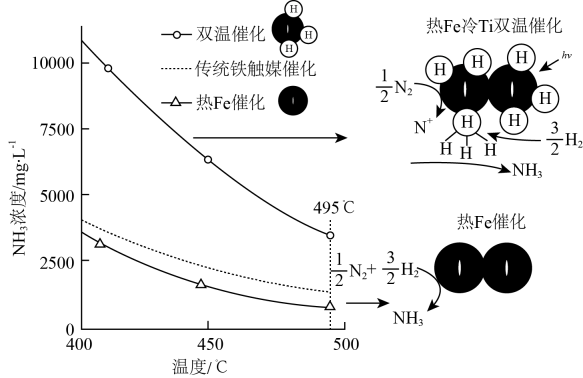
下列说法正确的是。
a.氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b.在“热Fe”表面断裂,有利于提高合成氨反应速率
c.“热Fe”高于体系温度,有利于提高氨的平衡产率
d.“冷Ti”低于体系温度,有利于提高合成氨反应速率
(4)、方案二:复合催化剂。
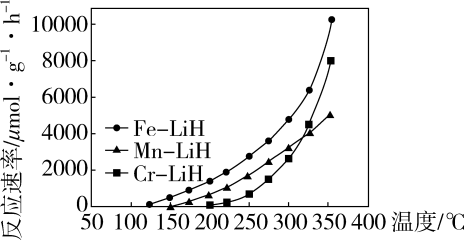
下列说法正确的是。
a.时,复合催化剂比单一催化剂效率更高
b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(5)、某合成氨速率方程为: , 根据表中数据,;实验
1
m
n
p
q
2
2m
n
p
2q
3
m
n
0.1p
10q
4
m
2n
p
2.828q
在合成氨过程中,需要不断分离出氨的原因为。
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
(6)、某种新型储氢材料的晶胞如图,八面体中心为M金属离子,顶点均为配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为 , 则M元素为(填元素符号);在该化合物中,M离子的价电子排布式为。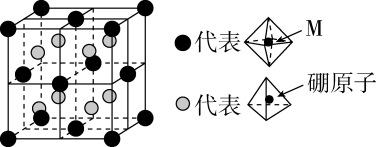 27. 1962年首个稀有气体化合物问世,目前已知的稀有气体化合物中,含氙(54Xe)的最多,氪 (36Kr)次之,氩(18Ar)化合物极少。是与分子形成的加合物,其晶胞如下图所示。
27. 1962年首个稀有气体化合物问世,目前已知的稀有气体化合物中,含氙(54Xe)的最多,氪 (36Kr)次之,氩(18Ar)化合物极少。是与分子形成的加合物,其晶胞如下图所示。
回答下列问题:
(1)、基态原子的价电子排布式为。(2)、原子的活泼性依序增强,原因是。(3)、晶体熔点:(填“>”“<”或“=”),判断依据是。(4)、的中心原子的杂化轨道类型为。(5)、加合物中 , 晶体中的微粒间作用力有(填标号)。a.氢键 b.离子键 c.极性共价键 d.非极性共价键
28. 【选考题】配位化合物X由配体L2-(如图)和具有正四面体结构的[Zn4O]6+构成。 (1)、基态Zn2+的电子排布式为。(2)、L2-所含元素中,电负性最大的原子处于基态时电子占据最高能级的电子云轮廓图为形;每个L2-中采取sp2杂化的C原子数目为个,C与O之间形成σ键的数目为个。(3)、X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入____。(假设X晶胞形状不变)。A、-Cl B、-OH C、-NH2 D、-CH3(4)、X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。
(1)、基态Zn2+的电子排布式为。(2)、L2-所含元素中,电负性最大的原子处于基态时电子占据最高能级的电子云轮廓图为形;每个L2-中采取sp2杂化的C原子数目为个,C与O之间形成σ键的数目为个。(3)、X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入____。(假设X晶胞形状不变)。A、-Cl B、-OH C、-NH2 D、-CH3(4)、X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。
①晶胞中与同一配体相连的两个[Zn4O]6+的不同之处在于。
②X晶体中Zn2+的配位数为。
③已知ZnO键长为dnm,理论上图中A、B两个Zn2+之间的最短距离的计算式为nm。
④已知晶胞参数为2anm,阿伏加德罗常数的值为NA , L2-与[Zn4O]6+的相对分子质量分别为M1和M2 , 则X的晶体密度为g•cm-3(列出化简的计算式)。
29. 【选修3:物质结构与性质】含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1)、基态S原子的价电子中,两种自旋状态的电子数之比为。(2)、Cu与Zn相比,第二电离能与第一电离能差值更大的是 , 原因是。(3)、SnCl的几何构型为 , 其中心离子杂化方式为。(4)、将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是____(填标号)。A、[Cu(NH3)2]Cl B、[Cu(NH3)4]SO4 C、[Zn(NH3)4]SO4 D、Na2[Zn(OH)4](5)、如图是硫的四种含氧酸根的结构:A.
 B.
B. C.
C. D.
D.
根据组成和结构推断,能在酸性溶液中将Mn2+转化为MnO的是(填标号),理由是。
(6)、如图是CZTS四元半导体化合物的四方晶胞。
①该物质的化学式为。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为( , , ),则B原子的坐标为。
30. 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:(1)、基态Na原子的价层电子轨道表示式为。(2)、NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na,电解反应方程式: , 加入的目的是。(3)、的电子式为。在25℃和101kPa时,Na与反应生成1mol 放热510.9kJ,写出该反应的热化学方程式:。(4)、采用空气和Na为原料可直接制备。空气与熔融金属Na反应前需依次通过、(填序号)a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.溶液
(5)、钠的某氧化物晶胞如下图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为。 (6)、天然碱的主要成分为 , 1mol 经充分加热得到的质量为g。31. 工业中可利用生产钛白的副产物和硫铁矿联合制备铁精粉和硫酸,实现能源及资源的有效利用。(1)、结构示意图如图1。
(6)、天然碱的主要成分为 , 1mol 经充分加热得到的质量为g。31. 工业中可利用生产钛白的副产物和硫铁矿联合制备铁精粉和硫酸,实现能源及资源的有效利用。(1)、结构示意图如图1。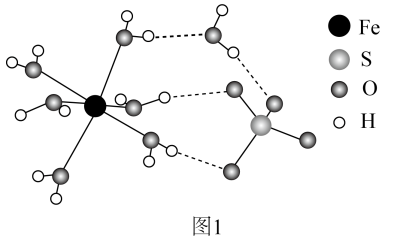
①的价层电子排布式为。
②中O和中S均为杂化,比较中键角和中键角的大小并解释原因。
③中与与的作用力类型分别是。
(2)、晶体的晶胞形状为立方体,边长为 , 结构如图2。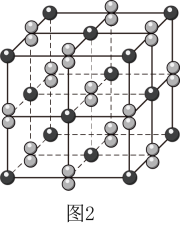
①距离最近的阴离子有个。
②的摩尔质量为 , 阿伏加德罗常数为。
该晶体的密度为。
(3)、加热脱水后生成 , 再与在氧气中掺烧可联合制备铁精粉和硫酸。分解和在氧气中燃烧的能量示意图如图3。利用作为分解的燃料,从能源及资源利用的角度说明该工艺的优点。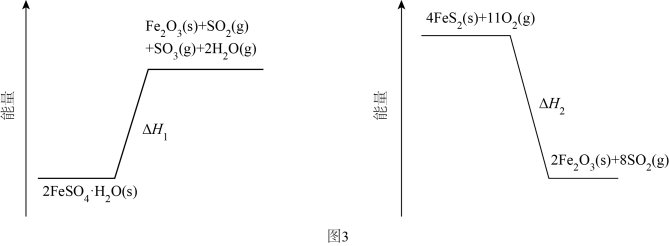 32. 以、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:(1)、基态O原子的电子排布式 , 其中未成对电子有个。(2)、Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是。(3)、酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取杂化。邻苯二甲酸酐(
32. 以、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:(1)、基态O原子的电子排布式 , 其中未成对电子有个。(2)、Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是。(3)、酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取杂化。邻苯二甲酸酐( )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成菁的原料,后者熔点高于前者,主要原因是。
)都是合成菁的原料,后者熔点高于前者,主要原因是。 (4)、金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为。(5)、ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是。(6)、下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面、。
(4)、金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为。(5)、ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是。(6)、下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面、。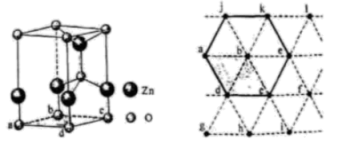 33. 研究笼形包合物结构和性质具有重要意义。化学式为的笼形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。晶胞参数为。回答下列问题:
33. 研究笼形包合物结构和性质具有重要意义。化学式为的笼形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。晶胞参数为。回答下列问题: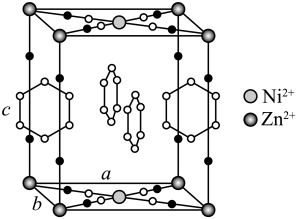 (1)、基态原子的价电子排布式为 , 在元素周期表中位置为。(2)、晶胞中N原子均参与形成配位键,与的配位数之比为;;晶胞中有d轨道参与杂化的金属离子是。(3)、吡啶(
(1)、基态原子的价电子排布式为 , 在元素周期表中位置为。(2)、晶胞中N原子均参与形成配位键,与的配位数之比为;;晶胞中有d轨道参与杂化的金属离子是。(3)、吡啶(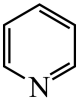 )替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的大键、则吡啶中N原子的价层孤电子对占据____(填标号)。 A、2s轨道 B、2p轨道 C、sp杂化轨道 D、sp2杂化轨道(4)、在水中的溶解度,吡啶远大于苯,主要原因是① , ②。(5)、
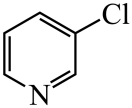
)替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的大键、则吡啶中N原子的价层孤电子对占据____(填标号)。 A、2s轨道 B、2p轨道 C、sp杂化轨道 D、sp2杂化轨道(4)、在水中的溶解度,吡啶远大于苯,主要原因是① , ②。(5)、 、
、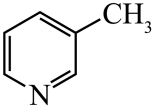 、
、 的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。 34. [选修3:物质结构与性质]
的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。 34. [选修3:物质结构与性质]铁和硒( )都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用。回答下列问题:
(1)、乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:
①基态 原子的核外电子排布式为 ;
②该新药分子中有种不同化学环境的C原子;
③比较键角大小:气态 分子 离子(填“>”“<”或“=”),原因是。
(2)、富马酸亚铁 是一种补铁剂。富马酸分子的结构模型如图所示:
①富马酸分子中 键与 键的数目比为;
②富马酸亚铁中各元素的电负性由大到小的顺序为。
(3)、科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化 ,将 转化为 ,反应过程如图所示:
①产物中N原子的杂化轨道类型为;
②与 互为等电子体的一种分子为(填化学式)。
(4)、钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
①该超导材料的最简化学式为;
② 原子的配位数为;
③该晶胞参数 、 。阿伏加德罗常数的值为 ,则该晶体的密度为 (列出计算式)。
35. 硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含 的新型 分子 的合成路线如下: (1)、 与S同族,基态硒原子价电子排布式为。(2)、 的沸点低于 ,其原因是。(3)、关于I~III三种反应物,下列说法正确的有_________。A、I中仅有 键 B、I中的 键为非极性共价键 C、II易溶于水 D、II中原子的杂化轨道类型只有 与 E、I~III含有的元素中,O电负性最大(4)、IV中具有孤对电子的原子有。(5)、硒的两种含氧酸的酸性强弱为 (填“>”或“<”)。
(1)、 与S同族,基态硒原子价电子排布式为。(2)、 的沸点低于 ,其原因是。(3)、关于I~III三种反应物,下列说法正确的有_________。A、I中仅有 键 B、I中的 键为非极性共价键 C、II易溶于水 D、II中原子的杂化轨道类型只有 与 E、I~III含有的元素中,O电负性最大(4)、IV中具有孤对电子的原子有。(5)、硒的两种含氧酸的酸性强弱为 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。 的立体构型为。
(6)、我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图a,沿x、y、z轴方向的投影均为图b。
①X的化学式为。
②设X的最简式的式量为 ,晶体密度为 ,则X中相邻K之间的最短距离为 (列出计算式, 为阿伏加德罗常数的值)。
36. [化学——选修3:物质结构与性质]卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)、氟原子激发态的电子排布式有 , 其中能量较高的是。(填标号)a. b. c. d.
(2)、①一氯乙烯分子中,C的一个杂化轨道与的轨道形成键,并且的轨道与C的轨道形成3中心4电子的大键。②一氯乙烷、一氯乙烯、一氯乙炔分子中,键长的顺序是 , 理由:(ⅰ)C的杂化轨道中s成分越多,形成的键越强;(ⅱ)。
(3)、卤化物受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为。解释X的熔点比Y高的原因。(4)、晶体中离子作体心立方堆积(如图所示),主要分布在由构成的四面体、八面体等空隙中。在电场作用下,不需要克服太大的阻力即可发生迁移。因此,晶体在电池中可作为。
已知阿伏加德罗常数为 , 则晶体的摩尔体积(列出算式)。
37. 铁单质及其化合物的应用非常广泛。(1)、基态Fe原子的价层电子排布式为。(2)、用X射线衍射测定,得到Fe的两种晶胞A、B,其结构如图所示。晶胞A中每个Fe原子紧邻的原子数为。每个晶胞B中含Fe原子数为。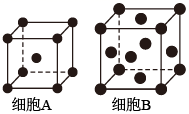 (3)、合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式。从能量角度分析,铁触媒的作用是。
(3)、合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式。从能量角度分析,铁触媒的作用是。 (4)、Fe3+可与H2O、SCN-、F-等配体形成配位数为6的配离子,如 、 、 。某同学按如下步骤完成实验:
(4)、Fe3+可与H2O、SCN-、F-等配体形成配位数为6的配离子,如 、 、 。某同学按如下步骤完成实验:
① 为浅紫色,但溶液Ⅰ却呈黄色,其原因是 , 为了能观察到溶液Ⅰ中 的浅紫色,可采取的方法是。
②已知Fe3+与SCN-、F-的反应在溶液中存在以下平衡: ; ,向溶液Ⅱ中加入NaF后,溶液颜色由红色转变为无色。若该反应是可逆反应,其离子方程式为 , 平衡常数为(用K1和K2表示)。
38. 金属羰基配位化合物在催化反应中有着重要应用。HMn(CO)5是锰的一种简单羰基配位化合物,其结构示意图如下。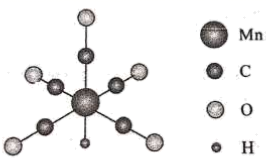
回答问题:
(1)、基态锰原子的价层电子排布式为。(2)、配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。HMn(CO)5中锰原子的配位数为。(3)、第一电离能的大小:CO(填“大于”或“小于”)。(4)、 中碳原子的杂化轨道类型是 , 写出一种与具有相同空间结构的-1价无机酸根离子的化学式。(5)、CH3Mn(CO)5可看作是HMn(CO)5中的氢原子被甲基取代的产物。CH3Mn(CO)5与I2反应可用于制备CH3I,反应前后锰的配位数不变,CH3Mn(CO)5与I2反应的化学方程式为。(6)、MnS晶胞与NaCl晶胞属于同种类型,如图所示。前者的熔点明显高于后者,其主要原因是。
以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在晶胞坐标系中,a点硫原子坐标为 ,b点锰原子坐标为 ,则c点锰原子坐标为。
39. 非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:(1)、基态F原子核外电子的运动状态有 种。(2)、O、F、Cl电负性由大到小的顺序为;OF2分子的空间构型为;OF2的熔、沸点 (填“高于”或“低于”)Cl2O,原因是。(3)、Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为 , 下列对XeF2中心原子杂化方式推断合理的是(填标号)。A.sp B.sp2 C.sp3 D.sp3d
(4)、XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( , , )。已知Xe—F键长为rpm,则B点原子的分数坐标为;晶胞中A、B间距离d=pm。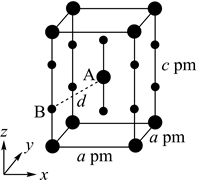 40. [选修3:物质结构与性质]
40. [选修3:物质结构与性质]很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。
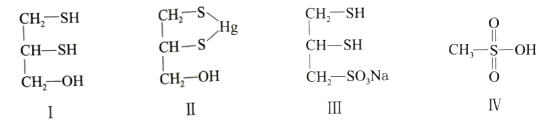 (1)、基态硫原子价电子排布式为。(2)、H2S、CH4、H2O的沸点由高到低顺序为。(3)、汞的原子序数为80,位于元素周期表第周期第ⅡB族。(4)、化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有________。A、在I中S原子采取sp3杂化 B、在Ⅱ中S元素的电负性最大 C、在Ⅲ中C-C-C键角是180° D、在Ⅲ中存在离子键与共价键 E、在Ⅳ中硫氧键的键能均相等(5)、汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是。(6)、理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图9a所示)中部分Ge原子被Hg和Sb取代后形成。
(1)、基态硫原子价电子排布式为。(2)、H2S、CH4、H2O的沸点由高到低顺序为。(3)、汞的原子序数为80,位于元素周期表第周期第ⅡB族。(4)、化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有________。A、在I中S原子采取sp3杂化 B、在Ⅱ中S元素的电负性最大 C、在Ⅲ中C-C-C键角是180° D、在Ⅲ中存在离子键与共价键 E、在Ⅳ中硫氧键的键能均相等(5)、汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是。(6)、理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图9a所示)中部分Ge原子被Hg和Sb取代后形成。
①图9b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是。
②图9c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为;该晶胞中粒子个数比Hg:Ge:Sb = 。
③设X的最简式的式量为Mr , 则X晶体的密度为g/cm3(列出算式)。
41. [化学-选修3:物质结构与性质]我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)、太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为;单晶硅的晶体类型为。SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为。SiCl4可发生水解反应,机理如下: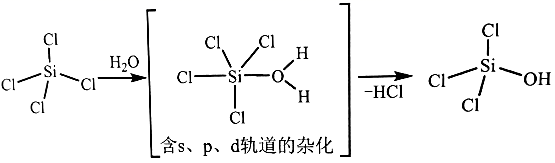 含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2 , 中间体SiCl4(H2O)中Si采取的杂化类型为(填标号)。(2)、CO2分子中存在个 键和个 键。(3)、甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是。(4)、我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是 , 晶胞参数为a pm、a pm、c pm,该晶体密度为g·cm-3(写出表达式)。在ZrO2中掺杂少量ZrO后形成的催化剂,化学式可表示为ZnxZr1-xOy , 则y=(用x表达)。
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2 , 中间体SiCl4(H2O)中Si采取的杂化类型为(填标号)。(2)、CO2分子中存在个 键和个 键。(3)、甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是。(4)、我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是 , 晶胞参数为a pm、a pm、c pm,该晶体密度为g·cm-3(写出表达式)。在ZrO2中掺杂少量ZrO后形成的催化剂,化学式可表示为ZnxZr1-xOy , 则y=(用x表达)。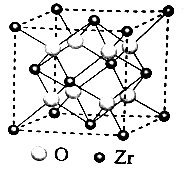 42. [选修3:物质结构与性质]
42. [选修3:物质结构与性质]硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
(1)、基态硅原子最外层的电子排布图为 , 晶体硅和碳化硅熔点较高的是(填化学式);(2)、硅和卤素单质反应可以得到 , 的熔沸点如下表:熔点/K
183.0
203.2
278.6
393.7
沸点/K
187.2
330.8
427.2
560.7
①0℃时, 、 、 、 呈液态的是(填化学式),沸点依次升高的原因是 , 气态 分子的空间构型是;
② 与N-甲基咪唑
 反应可以得到 ,其结构如图所示:
反应可以得到 ,其结构如图所示:
N-甲基咪唑分子中碳原子的杂化轨道类型为 , H、C、N的电负性由大到小的顺序为 , 1个 中含有个 键;
(3)、下图是 、 、 三种元素形成的某化合物的晶胞示意图。
①已知化合物中 和 的原子个数比为1:4,图中Z表示原子(填元素符号),该化合物的化学式为;
②已知该晶胞的晶胞参数分别为anm、bnm、cnm, ,则该晶体的密度 (设阿伏加德罗常数的值为 ,用含a、b、c、 的代数式表示)。
43. [选修3:物质结构与性质]KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:
(1)、在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是(填离子符号)。(2)、原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用- 表示,称为电子的自旋磁量子数.对于基态的磷原子,其价电子自旋磁量子数的代数和为。(3)、已知有关氨、磷的单键和三键的键能(kJ•mol-1)如表:N—N
N≡N
P—P
P≡P
193
946
197
489
从能量角度看,氮以N2、而白磷以P4(结构式可表示为
 )形式存在的原因是。(4)、已知KH2PO2是次磷酸的正盐,H3PO2的结构式为 , 其中P采取杂化方式。(5)、与PO 电子总数相同的等电子体的分子式为。(6)、磷酸通过分子间脱水缩合形成多磷酸,如:
)形式存在的原因是。(4)、已知KH2PO2是次磷酸的正盐,H3PO2的结构式为 , 其中P采取杂化方式。(5)、与PO 电子总数相同的等电子体的分子式为。(6)、磷酸通过分子间脱水缩合形成多磷酸,如: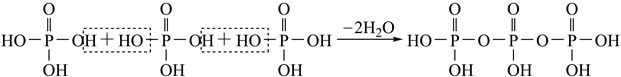 如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。(7)、分别用○、●表示H2PO 和K+ , KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO 、K+在晶胞xz面、yz面上的位置:
如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。(7)、分别用○、●表示H2PO 和K+ , KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO 、K+在晶胞xz面、yz面上的位置:
①若晶胞底边的边长均为apm、高为cpm,阿伏加德罗常数的值为NA , 晶体的密度__g•cm-3(写出表达式)。
②晶胞在x轴方向的投影图为__(填标号)。
 44. [化学——选修3:物质结构与性质]
44. [化学——选修3:物质结构与性质]过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用,回答下列问题:
(1)、对于基态Cr原子,下列叙述正确的是(填标号)。A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar] 3d54s1
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)、三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是 , 中心离子的配位数为。(3)、[Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如下图所示。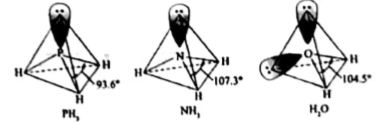
PH3中P的杂化类型是 , NH3的沸点比PH3的 , 原因是。H2O的键角小于NH3的,分析原因。
(4)、在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示。处于顶角位置的是原子。设Cr和Al原子半径分别为 和 ,则金属原子空间占有率为%(列出计算表达式)。