近三年高考化学真题分类汇编:电解质溶液(2021年)
试卷更新日期:2023-07-24 类型:二轮复习
一、选择题
-
1. 常温下,已知H3PO3溶液中含磷物种的浓度之和为0.1mol·L-1 , 溶液中各含磷物种的pc—pOH关系如图所示。图中pc表示各含磷物种的浓度负对数(pc=-lgc),pOH表示OH-的浓度负对数[pOH=-lgc(OH-)];x、y、z三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。下列说法正确的是( )
 A、曲线①表示pc(H3PO3)随pOH的变化 B、H3PO3的结构简式为
A、曲线①表示pc(H3PO3)随pOH的变化 B、H3PO3的结构简式为 C、pH=4的溶液中:c(H2PO )<0.1mol·L-1-2c(HPO )
D、H3PO3+HPO 2H2PO 的平衡常数K>1.0×105
2. 常温下,下列各组离子在给定溶液中能大量共存的是( )A、pH=1的溶液:Fe2+、Mg2+、 、 B、pH=12的溶液:K+、Na+、 、 C、pH=7的溶液:Na+、Cu2+、S2-、Cl- D、pH=7的溶液:Al3+、K+、Cl-、3. 常温下,下列有关电解质溶液的叙述正确的是( )A、在 溶液中 B、在 溶液中 C、在 溶液中 D、氨水和NH4Cl溶液混合,形成pH=9的溶液中4. 用 盐酸滴定 溶液,溶液中 、 、 的分布分数 随pH变化曲线及滴定曲线如图。下列说法正确的是(如 分布分数: )( )
C、pH=4的溶液中:c(H2PO )<0.1mol·L-1-2c(HPO )
D、H3PO3+HPO 2H2PO 的平衡常数K>1.0×105
2. 常温下,下列各组离子在给定溶液中能大量共存的是( )A、pH=1的溶液:Fe2+、Mg2+、 、 B、pH=12的溶液:K+、Na+、 、 C、pH=7的溶液:Na+、Cu2+、S2-、Cl- D、pH=7的溶液:Al3+、K+、Cl-、3. 常温下,下列有关电解质溶液的叙述正确的是( )A、在 溶液中 B、在 溶液中 C、在 溶液中 D、氨水和NH4Cl溶液混合,形成pH=9的溶液中4. 用 盐酸滴定 溶液,溶液中 、 、 的分布分数 随pH变化曲线及滴定曲线如图。下列说法正确的是(如 分布分数: )( ) A、 的 为 B、c点: C、第一次突变,可选酚酞作指示剂 D、5. 依据下列实验和现象,得出结论正确的是( )
A、 的 为 B、c点: C、第一次突变,可选酚酞作指示剂 D、5. 依据下列实验和现象,得出结论正确的是( )选项
实验
现象
结论
A
点燃无色气体 ,将生成的气体通入澄清石灰水
澄清石灰水先浑浊后澄清
为
B
25℃时,向无色的 溶液中滴加1~2滴酚酞试液
溶液仍为无色
溶液的
C
在淀粉和 的混合溶液中滴加 溶液。[已知: 、 分别与卤素单质、卤素离子性质相似]
溶液仍为蓝色
氧化性:
D
在稀 中加入少量
溶液由无色变为蓝色并有红色固体生成
反应中 既作氧化剂又作还原剂
A、A B、B C、C D、D6. 下列实验中,均产生白色沉淀。 下列分析错误的是( )A、Na2CO3与NaHCO3溶液中所含微粒种类相同 B、CaCl2能促进Na2CO3、NaHCO3水解 C、Al2(SO4)3能促进Na2CO3、NaHCO3水解 D、4个实验中,溶液滴入后,试管中溶液pH均降低7. 使用如图装置(搅拌装置略)探究溶液离子浓度变化,灯光变化不可能出现“亮→暗(或灭)→亮”现象的是( )
下列分析错误的是( )A、Na2CO3与NaHCO3溶液中所含微粒种类相同 B、CaCl2能促进Na2CO3、NaHCO3水解 C、Al2(SO4)3能促进Na2CO3、NaHCO3水解 D、4个实验中,溶液滴入后,试管中溶液pH均降低7. 使用如图装置(搅拌装置略)探究溶液离子浓度变化,灯光变化不可能出现“亮→暗(或灭)→亮”现象的是( )
选项
A
B
C
D
试剂a
CuSO4
NH4HCO3
H2SO4
CH3COOH
试剂b
Ba(OH)2
Ca(OH)2
Ba(OH)2
NH3·H2O
A、A B、B C、C D、D8. 某同学拟用 计测定溶液 以探究某酸HR是否为弱电解质。下列说法正确的是( )A、25℃时,若测得 溶液 ,则HR是弱酸 B、25℃时,若测得 溶液 且 ,则HR是弱酸 C、25℃时,若测得HR溶液 ,取该溶液 ,加蒸馏水稀释至 ,测得 ,则HR是弱酸 D、25℃时,若测得NaR溶液 ,取该溶液 ,升温至50℃,测得 , ,则HR是弱酸9. 下列物质属于弱电解质的是( )A、CO2 B、H2O C、HNO3 D、NaOH10. 取两份 的 溶液,一份滴加 的盐酸,另一份滴加 溶液,溶液的pH随加入酸(或碱)体积的变化如图。
下列说法不正确的是( )
A、由a点可知: 溶液中 的水解程度大于电离程度 B、 过程中: 逐渐减小 C、 过程中: D、令c点的 ,e点的 ,则11. 鸟嘌呤( )是一种有机弱碱,可与盐酸反应生成盐酸盐(用 表示)。已知 水溶液呈酸性,下列叙述正确的是( )A、 水溶液的 B、 水溶液加水稀释, 升高 C、 在水中的电离方程式为: D、 水溶液中:12. 已知相同温度下, 。某温度下,饱和溶液中 、 、与 的关系如图所示。
下列说法正确的是( )
A、曲线①代表 的沉淀溶解曲线 B、该温度下 的 值为 C、加适量 固体可使溶液由a点变到b点 D、 时两溶液中13. 下列实验设计不能达到实验目的的是( )实验目的
实验设计
A
检验溶液中 是否被氧化
取少量待测液,滴加 溶液,观察溶液颜色变化
B
净化实验室制备的
气体依次通过盛有饱和 溶液、浓 的洗气瓶
C
测定 溶液的pH
将待测液滴在湿润的pH试纸上,与标准比色卡对照
D
工业酒精制备无水乙醇
工业酒精中加生石灰,蒸馏
A、A B、B C、C D、D14. 对下列粒子组在溶液中能否大量共存的判断和分析均正确的是( )粒子组
判断和分析
A
、 、 、
不能大量共存,因发生反应:
B
、 、 、
不能大量共存,因发生反应:
C
、 、 、
能大量共存,粒子间不反应
D
、 、 、
能大量共存,粒子间不反应
A、A B、B C、C D、D15. 常温下,用 的盐酸分别滴定20.00mL浓度均为 三种一元弱酸的钠盐 溶液,滴定曲线如图所示。下列判断错误的是( ) A、该 溶液中: B、三种一元弱酸的电离常数: C、当 时,三种溶液中: D、分别滴加20.00mL盐酸后,再将三种溶液混合:16. 下列过程中的化学反应,相应的离子方程式正确的是( )A、用碳酸钠溶液处理水垢中的硫酸钙: CO32- +CaSO4 =CaCO3 + SO42- B、过量铁粉加入稀硝酸中:Fe + 4H+ + NO3- = Fe3+ +NO↑ +2H2O C、硫酸铝溶液中滴如少量氢氧化钾溶液: Al3+ +4 OH- =AlO2- + 2H2O D、氯化铜溶液中通入硫化氢: Cu2+ + S2- =CuS ↓17. HA是一元弱酸,难溶盐MA的饱和溶液中 而变化, 不发生水解。实验发现,298K时 ,如下图中实线所示。
A、该 溶液中: B、三种一元弱酸的电离常数: C、当 时,三种溶液中: D、分别滴加20.00mL盐酸后,再将三种溶液混合:16. 下列过程中的化学反应,相应的离子方程式正确的是( )A、用碳酸钠溶液处理水垢中的硫酸钙: CO32- +CaSO4 =CaCO3 + SO42- B、过量铁粉加入稀硝酸中:Fe + 4H+ + NO3- = Fe3+ +NO↑ +2H2O C、硫酸铝溶液中滴如少量氢氧化钾溶液: Al3+ +4 OH- =AlO2- + 2H2O D、氯化铜溶液中通入硫化氢: Cu2+ + S2- =CuS ↓17. HA是一元弱酸,难溶盐MA的饱和溶液中 而变化, 不发生水解。实验发现,298K时 ,如下图中实线所示。下列叙述错误的是( )
 A、溶液pH = 4 时. B、MA 的溶度积 C、溶液 pH = 7 时, D、HA 的电离常数18. 25℃时,下列说法正确的是( )A、NaHA溶液呈酸性,可以推测H2A为强酸 B、可溶性正盐BA溶液呈中性,可以推测BA为强酸强碱盐 C、0.010 mol·L-1、0.10mol·L-1的醋酸溶液的电离度分别为α1、α2 , 则α1<α2 D、100 mL pH=10.00的Na2CO3溶液中水电离出H+的物质的量为1.0×10-5mol19. 下列物质属于强电解质的是( )A、KOH B、H3PO4 C、SO3 D、CH3CHO20. 实验测得10 mL 0.50 mol·L-1NH4Cl溶液、10 mL 0.50mol·L-1CH3COONa溶液的pH分别随温度与稀释加水量的变化如图所示。已知25 ℃时CH3COOH和NH3·H2O的电离常数均为1.8×10-5.下列说法错误的是( )
A、溶液pH = 4 时. B、MA 的溶度积 C、溶液 pH = 7 时, D、HA 的电离常数18. 25℃时,下列说法正确的是( )A、NaHA溶液呈酸性,可以推测H2A为强酸 B、可溶性正盐BA溶液呈中性,可以推测BA为强酸强碱盐 C、0.010 mol·L-1、0.10mol·L-1的醋酸溶液的电离度分别为α1、α2 , 则α1<α2 D、100 mL pH=10.00的Na2CO3溶液中水电离出H+的物质的量为1.0×10-5mol19. 下列物质属于强电解质的是( )A、KOH B、H3PO4 C、SO3 D、CH3CHO20. 实验测得10 mL 0.50 mol·L-1NH4Cl溶液、10 mL 0.50mol·L-1CH3COONa溶液的pH分别随温度与稀释加水量的变化如图所示。已知25 ℃时CH3COOH和NH3·H2O的电离常数均为1.8×10-5.下列说法错误的是( )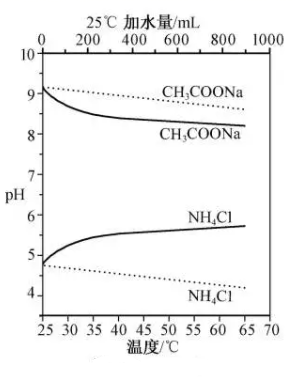 A、图中实线表示pH随加水量的变化,虚线表示pH随温度的变化' B、将NH4Cl溶液加水稀释至浓度 mol·L-1 , 溶液pH变化值小于lgx C、随温度升高,Kw增大,CH3COONa溶液中c(OH- )减小,c(H+)增大,pH减小 D、25 ℃时稀释相同倍数的NH4Cl溶液与CH3COONa溶液中:c(Na+ )-c(CH3COO- )=c(Cl-)-c(NH )
A、图中实线表示pH随加水量的变化,虚线表示pH随温度的变化' B、将NH4Cl溶液加水稀释至浓度 mol·L-1 , 溶液pH变化值小于lgx C、随温度升高,Kw增大,CH3COONa溶液中c(OH- )减小,c(H+)增大,pH减小 D、25 ℃时稀释相同倍数的NH4Cl溶液与CH3COONa溶液中:c(Na+ )-c(CH3COO- )=c(Cl-)-c(NH )二、多选题
-
21. 25℃时,向 的 溶液中滴加 的盐酸,溶液的 随加入的盐酸的体积 变化如图所示。下列有关说法正确的是( )
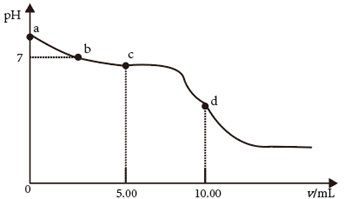 A、 点,溶液 是由于 水解程度大于电离程度 B、 点, C、 点,溶液中的 主要来自 的电离 D、 点,22. 赖氨酸[H3N+(CH2)4CH(NH2)COO- , 用HR表示]是人体必需氨基酸,其盐酸盐(H3RCl2)在水溶液中存在如下平衡:H3R2+ H2R+ HR R-。向一定浓度的H3RCl2溶液中滴加NaOH溶液,溶液中H3R2+、H2R+、HR和R-的分布系数δ(x)随pH变化如图所示。已知δ(x)= ,下列表述正确的是( )
A、 点,溶液 是由于 水解程度大于电离程度 B、 点, C、 点,溶液中的 主要来自 的电离 D、 点,22. 赖氨酸[H3N+(CH2)4CH(NH2)COO- , 用HR表示]是人体必需氨基酸,其盐酸盐(H3RCl2)在水溶液中存在如下平衡:H3R2+ H2R+ HR R-。向一定浓度的H3RCl2溶液中滴加NaOH溶液,溶液中H3R2+、H2R+、HR和R-的分布系数δ(x)随pH变化如图所示。已知δ(x)= ,下列表述正确的是( ) A、 > B、M点,c(Cl-) +c(OH-)+c(R-)=2c(H2R+)+c(Na+)+c(H+) C、O点,pH= D、P点,c(Na+)>c(Cl-)>c(OH-)>c(H+)
A、 > B、M点,c(Cl-) +c(OH-)+c(R-)=2c(H2R+)+c(Na+)+c(H+) C、O点,pH= D、P点,c(Na+)>c(Cl-)>c(OH-)>c(H+)三、非选择题
-
23. 从钒铬锰矿渣(主要成分为 、 、 )中提铬的一种工艺流程如下:

已知:pH较大时,二价锰[ ](在空气中易被氧化.回答下列问题:
(1)、Cr元素位于元素周期表第周期族。(2)、用 溶液制备 胶体的化学方程式为。(3)、常温下,各种形态五价钒粒子总浓度的对数[ ]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中 ,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为(填化学式)。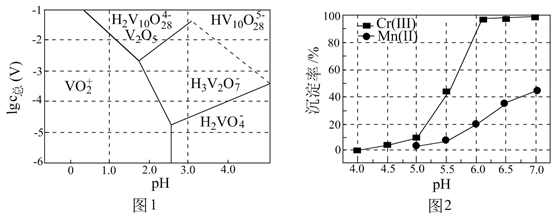 (4)、某温度下, 、 的沉淀率与pH关系如图2。“沉铬”过程最佳pH为;在该条件下滤液B中 ( 近似为 , 的 近似为 )。(5)、“转化”过程中生成 的离子方程式为。(6)、“提纯”过程中 的作用为。24. 某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。(1)、浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中存在盐酸和MnO2。
(4)、某温度下, 、 的沉淀率与pH关系如图2。“沉铬”过程最佳pH为;在该条件下滤液B中 ( 近似为 , 的 近似为 )。(5)、“转化”过程中生成 的离子方程式为。(6)、“提纯”过程中 的作用为。24. 某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。(1)、浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中存在盐酸和MnO2。①反应的离子方程式是。
②电极反应式:
i还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii氧化反应:。
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱.
ii随c(Cl-)降低,。
④补充实验证实了③中的分析。
实验操作
试剂
产物
I
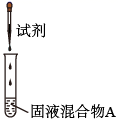
较浓H2SO4
有Cl2
II
a
有Cl2
III
a+b
无Cl2
a是 , b是。
(2)、利用c(H+)浓度对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是 , 从原子结构角度说明理由。(3)、根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是。(4)、Ag分别与1mol·L1的盐酸、氢溴酸、氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:。(5)、总结:物质氧化性和还原性变化的一般规律是。25. 胆矾( )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的 (杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:(1)、制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有(填标号)。A.烧杯 B.容量瓶 C.蒸发皿 D.移液管
(2)、将 加入到适量的稀硫酸中,加热,其主要反应的化学方程式为 , 与直接用废铜和浓硫酸反应相比,该方法的优点是。(3)、待 完全反应后停止加热,边搅拌边加入适量 ,冷却后用 调 为3.5~4,再煮沸 ,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、、乙醇洗涤、 , 得到胆矾。其中,控制溶液 为3.5~4的目的是 , 煮沸 的作用是。(4)、结晶水测定:称量干燥坩埚的质量为 ,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为 。根据实验数据,胆矾分子中结晶水的个数为(写表达式)。(5)、下列操作中,会导致结晶水数目测定值偏高的是(填标号)。①胆矾未充分干燥 ②坩埚未置于干燥器中冷却 ③加热时有少胆矾迸溅出来
26. 可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以 形式存在,还含有 、 、 、 等物质。以独居石为原料制备 的工艺流程如下: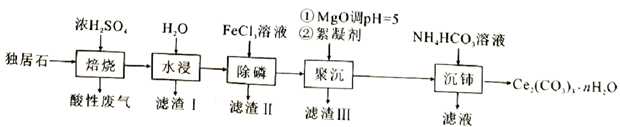
回答下列问题:
(1)、铈的某种核素含有58个质子和80个中子,该核素的符号为;(2)、为提高“水浸”效率,可采取的措施有(至少写两条);(3)、滤渣Ⅲ的主要成分是(填化学式);(4)、加入絮凝剂的目的是;(5)、“沉铈”过程中,生成 的离子方程式为 , 常温下加入的 溶液呈(填“酸性”“碱性”或“中性”)(已知: 的 , 的 , );(6)、滤渣Ⅱ的主要成分为 ,在高温条件下, 、葡萄糖( )和 可制备电极材料 ,同时生成 和 ,该反应的化学方程式为27. 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr—Fe—Al—Mg的深度利用和Na+内循环。工艺流程如图: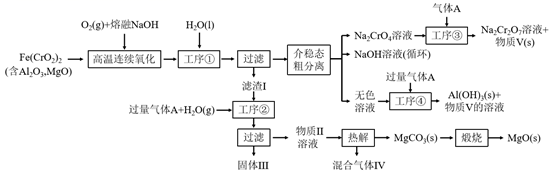
回答下列问题:
(1)、高温连续氧化工序中被氧化的元素是(填元素符号)。(2)、工序①的名称为 。(3)、滤渣的主要成分是 (填化学式)。(4)、工序③中发生反应的离子方程式为。(5)、物质V可代替高温连续氧化工序中的NaOH,此时发生的主要反应的化学方程式为 , 可代替NaOH的化学试剂还有(填化学式)。(6)、热解工序产生的混合气体最适宜返回工序(填“①”或“②”或“③”或“④”)参与内循环。(7)、工序④溶液中的铝元素恰好完全转化为沉淀的pH为。(通常认为溶液中离子浓度小于10-5mol•L-1为沉淀完全;Al(OH)3+OH- Al(OH) :K=100.63 , Kw=10-14 , Ksp[Al(OH)3]=10-33)28. 磁选后的炼铁高钛炉渣,主要成分有 、 、 、MgO、CaO以及少量的 ,为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺下,有关金属离子开始沉淀和沉淀完全的pH见下表:
金属离子
开始沉淀的pH
2.2
3.5
9.5
12.4
沉淀完全(c=1.0×10*mol-L')的pH
3.2
4.7
11.1
13.8
回答下列问题:
(1)、“焙烧”中, 、 几乎不发生反应, 、MgO、CaO、 转化为相应的硫酸盐,写出 转化为 的化学方程式。(2)、“水浸”后“滤液”的pH约为2.0,在“分步沉淀”氨水逐步调节pH至11.6,依次析出的金属离子是。(3)、“母液①”中 浓度为mol·(4)、”水浸渣”在160℃“酸溶”,最适合的酸是。“酸溶渣”的成分是、。(5)、“酸溶”后,将溶液适当稀释并加热, 水解析出 沉淀,该反应的离子方程式是。(6)、将“母液①”和“母液②”混合,吸收尾气,经处理得 , 循环利用。