近三年高考化学真题分类汇编:电解质溶液(2022年)
试卷更新日期:2023-07-24 类型:二轮复习
一、选择题
-
1. 一种捕集烟气中CO2的过程如图所示。室温下以0.1mol∙L-1KOH溶液吸收CO2 , 若通入CO2所引起的溶液体积变化和H2O挥发可忽略,溶液中含碳物种的浓度c总=c(H2CO3)+c()+c()。H2CO3电离常数分别为Ka1=4.4×10-7、Ka2=4.4×10-11。下列说法正确的是 ( )
 A、KOH吸收CO2所得到的溶液中:c(H2CO3)>c() B、KOH完全转化为K2CO3时,溶液中:c(OH-)= c(H+)+c()+c(H2CO3) C、KOH溶液吸收CO2 , c总=0.1mol∙L-1溶液中:c(H2CO3)>c() D、如图所示的“吸收”“转化”过程中,溶液的温度下降2. 甘氨酸是人体必需氨基酸之一、在时,、和的分布分数【如】与溶液关系如图。下列说法错误的是( )
A、KOH吸收CO2所得到的溶液中:c(H2CO3)>c() B、KOH完全转化为K2CO3时,溶液中:c(OH-)= c(H+)+c()+c(H2CO3) C、KOH溶液吸收CO2 , c总=0.1mol∙L-1溶液中:c(H2CO3)>c() D、如图所示的“吸收”“转化”过程中,溶液的温度下降2. 甘氨酸是人体必需氨基酸之一、在时,、和的分布分数【如】与溶液关系如图。下列说法错误的是( )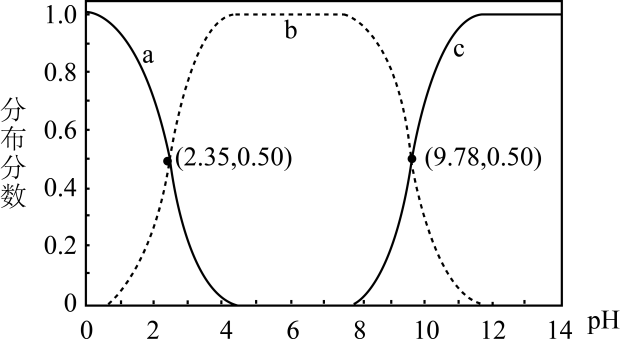 A、甘氨酸具有两性 B、曲线c代表 C、的平衡常数 D、3. 某小组模拟成垢-除垢过程如图。
A、甘氨酸具有两性 B、曲线c代表 C、的平衡常数 D、3. 某小组模拟成垢-除垢过程如图。100mL0.1mol•L-1CaCl2水溶液……
忽略体积变化,且步骤②中反应完全。下列说法正确的是( )
A、经过步骤①,溶液中c(Ca2+)+c(Na+)=c(Cl-) B、经过步骤②,溶液中c(Na+)=4c(SO) C、经过步骤②,溶液中c(Cl-)=c(CO)+c(HCO)+c(H2CO3) D、经过步骤③,溶液中c(CH3COOH)+c(CH3COO-)=c(Cl-)4. 氨是水体污染物的主要成分之一,工业上可用次氯酸盐作处理剂,有关反应可表示为:①
②
在一定条件下模拟处理氨氮废水:将的氨水分别和不同量的混合,测得溶液中氨去除率、总氮(氨氮和硝氮的总和)残余率与投入量(用x表示)的关系如下图所示。下列说法正确的是( )
 A、的数值为0.009 B、时, C、时,x越大,生成的量越少 D、时,5. 25℃时,下列各组离子中可以在水溶液中大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、6. 下列操作中,不会影响溶液中K+、Al3+、Fe3+、Ba2+、Cl-、NO等离子大量共存的是( )A、加入ZnSO4 B、加入Fe粉 C、通入NH3 D、通入CO27. 锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有和杂质离子,可在0~14范围内调节对其净化(即相关离子浓度)。时,与关系见下图(碱性过强时和会部分溶解)。下列说法正确的是( )
A、的数值为0.009 B、时, C、时,x越大,生成的量越少 D、时,5. 25℃时,下列各组离子中可以在水溶液中大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、6. 下列操作中,不会影响溶液中K+、Al3+、Fe3+、Ba2+、Cl-、NO等离子大量共存的是( )A、加入ZnSO4 B、加入Fe粉 C、通入NH3 D、通入CO27. 锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有和杂质离子,可在0~14范围内调节对其净化(即相关离子浓度)。时,与关系见下图(碱性过强时和会部分溶解)。下列说法正确的是( )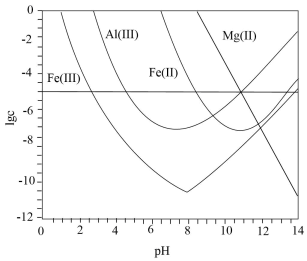 A、可被净化的区间最大 B、加入适量 , 可进一步提升净化程度 C、净化的先后顺序: D、8. 某水样中含一定浓度的CO、HCO和其他不与酸碱反应的离子。取10.00mL水样,用0.01000mol•L-1的HCl溶液进行滴定,溶液pH随滴加HCl溶液体积V(HCl)的变化关系如图(混合后溶液体积变化忽略不计)。
A、可被净化的区间最大 B、加入适量 , 可进一步提升净化程度 C、净化的先后顺序: D、8. 某水样中含一定浓度的CO、HCO和其他不与酸碱反应的离子。取10.00mL水样,用0.01000mol•L-1的HCl溶液进行滴定,溶液pH随滴加HCl溶液体积V(HCl)的变化关系如图(混合后溶液体积变化忽略不计)。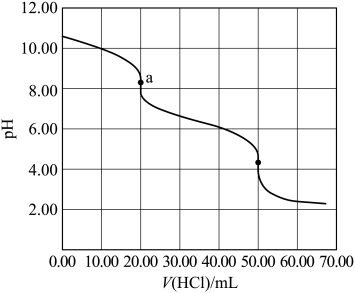
下列说法正确的是( )
A、该水样中c(CO)=0.01mol•L-1 B、a点处c(H2CO3)+c(H+)=c(OH-) C、当V(HCl)≤20.00mL时,溶液中c(HCO)基本保持不变 D、曲线上任意一点存在c(CO)+c(HCO)+c(H2CO3)=0.03mol•L-19. 硫代碳酸钠能用于处理废水中的重金属离子,可通过如下反应制备: , 下列说法正确的是( )A、不能被氧化 B、溶液显碱性 C、该制备反应是熵减过程 D、的热稳定性比的高10. 根据酸碱质子理论,给出质子的物质是酸,给出质子的能力越强,酸性越强。已知: , , 下列酸性强弱顺序正确的是( )A、 B、 C、 D、11. 下列各组离子在给定溶液中能大量共存的是( )A、在氨水中: B、在氯化钠溶液中: C、在醋酸溶液中: D、在硝酸银溶液中:12. 下图是亚砷酸As(OH)3和酒石酸混合体系中部分物种的c-pH图(浓度:总As为 , 总T为)。下列说法错误的是( ) A、的为 B、的酸性比的强 C、时,的浓度比的高 D、时,溶液中浓度最高的物种为13. 2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法错误的是( )A、醋酸钠是强电解质 B、醋酸钠晶体与冰都是离子晶体 C、常温下,醋酸钠溶液的 D、该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出14. 某同学按图示装置进行实验,欲使瓶中少量固体粉末最终消失并得到澄清溶液。下列物质组合不符合要求的是( )
A、的为 B、的酸性比的强 C、时,的浓度比的高 D、时,溶液中浓度最高的物种为13. 2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法错误的是( )A、醋酸钠是强电解质 B、醋酸钠晶体与冰都是离子晶体 C、常温下,醋酸钠溶液的 D、该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出14. 某同学按图示装置进行实验,欲使瓶中少量固体粉末最终消失并得到澄清溶液。下列物质组合不符合要求的是( )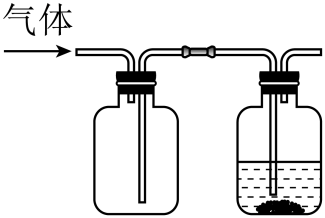
气体
液体
固体粉末
A
饱和溶液
B
溶液
Fe
C
溶液
D
A、A B、B C、C D、D15. 工业上以为原料生产 , 对其工艺条件进行研究。现有含的、溶液,含的、溶液。在一定pH范围内,四种溶液中随pH的变化关系如图所示。下列说法错误的是( )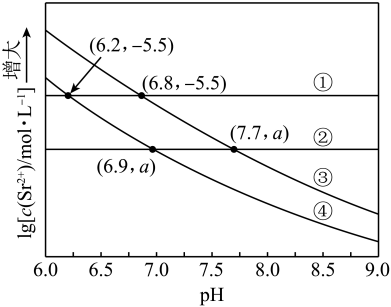 A、反应的平衡常数 B、 C、曲线④代表含的溶液的变化曲线 D、对含且和初始浓度均为的混合溶液,时才发生沉淀转化16. 时,苯酚的 , 下列说法正确的是( )A、相同温度下,等的和溶液中, B、将浓度均为的和溶液加热,两种溶液的均变大 C、时,溶液与溶液混合,测得 , 则此时溶液中 D、时,的溶液中加少量固体,水的电离程度变小17. 下列物质属于强电解质的是( )A、 B、 C、 D、18. 时,向浓度均为的盐酸和醋酸的混合溶液中逐滴加入的溶液(醋酸的;用的溶液滴定等浓度的盐酸,滴定终点的突跃范围4.3~9.7)。下列说法不正确的是( )A、恰好中和时,溶液呈碱性 B、滴加溶液至的过程中,发生反应的离子方程式为: C、滴定过程中, D、时,19. 室温时,用 的标准 溶液滴定 浓度相等的 、 和 混合溶液,通过电位滴定法获得 与 的关系曲线如图所示(忽略沉淀对离子的吸附作用)。
A、反应的平衡常数 B、 C、曲线④代表含的溶液的变化曲线 D、对含且和初始浓度均为的混合溶液,时才发生沉淀转化16. 时,苯酚的 , 下列说法正确的是( )A、相同温度下,等的和溶液中, B、将浓度均为的和溶液加热,两种溶液的均变大 C、时,溶液与溶液混合,测得 , 则此时溶液中 D、时,的溶液中加少量固体,水的电离程度变小17. 下列物质属于强电解质的是( )A、 B、 C、 D、18. 时,向浓度均为的盐酸和醋酸的混合溶液中逐滴加入的溶液(醋酸的;用的溶液滴定等浓度的盐酸,滴定终点的突跃范围4.3~9.7)。下列说法不正确的是( )A、恰好中和时,溶液呈碱性 B、滴加溶液至的过程中,发生反应的离子方程式为: C、滴定过程中, D、时,19. 室温时,用 的标准 溶液滴定 浓度相等的 、 和 混合溶液,通过电位滴定法获得 与 的关系曲线如图所示(忽略沉淀对离子的吸附作用)。

若溶液中离子浓度小于 时,认为该离子沉淀完全。 , , )。下列说法正确的是( )
A、a点:有白色沉淀生成 B、原溶液中 的浓度为 C、当 沉淀完全时,已经有部分 沉淀 D、b点:20. 常温下,一元酸的。在某体系中,与离子不能穿过隔膜,未电离的可自由穿过该膜(如图所示)。
设溶液中 , 当达到平衡时,下列叙述正确的是( )
A、溶液Ⅰ中 B、溶液Ⅱ中的的电离度为 C、溶液Ⅰ和Ⅱ中的不相等 D、溶液Ⅰ和Ⅱ中的之比为21. 下列物质属于非电解质的是( )A、CH4 B、KI C、NaOH D、CH3COOH22. 水溶液呈酸性的盐是( )A、NH4Cl B、BaCl2 C、H2SO4 D、Ca(OH)223. 已知25℃时二元酸H2A的Ka1=1.3×10-7 , Ka2=7.1×10-15。下列说法正确的是( )A、在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者 B、向0.1mol·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013% C、向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-) D、取pH=a的H2A溶液10mL,加蒸馏水稀释至100mL,则该溶液pH=a+124. 某同学在两个相同的特制容器中分别加入20mL0.4mol·L-1Na2CO3溶液和40mL0.2mol·L-1NaHCO3溶液,再分别用0.4mol·L-1盐酸滴定,利用pH计和压力传感器检测,得到如图曲线:
下列说法正确的的是( )
A、图中甲、丁线表示向NaHCO3溶液中滴加盐酸,乙、丙线表示向Na2CO3溶液中滴加盐酸 B、当滴加盐酸的体积为V1mL时(a点、b点),所发生的反应用离子方程式表示为:HCO+H+=CO2↑+H2O C、根据pH—V(HCl)图,滴定分析时,c点可用酚酞、d点可用甲基橙作指示剂指示滴定终点 D、Na2CO3和NaHCO3溶液中均满足:c(H2CO3)-c(CO)=c(OH-)-c(H+)二、多选题
-
25. 某元素M的氢氧化物在水中的溶解反应为:、 , 25℃,-lgc与pH的关系如图所示,c为或浓度的值,下列说法错误的是( )
 A、曲线①代表与pH的关系 B、的约为 C、向的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以存在pH=9.0,体系中元素M主要以存在 D、向的溶液中加入等体积0.4mol/L的HCl后,体系中元素M主要以存在26. NaClO溶液具有添白能力,已知25℃时,。下列关于NaClO溶液说法正确的是( )A、0.01mol/L溶液中, B、长期露置在空气中,释放 , 漂白能力减弱 C、通入过量 , 反应的离子方程式为 D、25℃,的NaClO和HClO的混合溶液中,
A、曲线①代表与pH的关系 B、的约为 C、向的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以存在pH=9.0,体系中元素M主要以存在 D、向的溶液中加入等体积0.4mol/L的HCl后,体系中元素M主要以存在26. NaClO溶液具有添白能力,已知25℃时,。下列关于NaClO溶液说法正确的是( )A、0.01mol/L溶液中, B、长期露置在空气中,释放 , 漂白能力减弱 C、通入过量 , 反应的离子方程式为 D、25℃,的NaClO和HClO的混合溶液中,三、非选择题
-
27. 天津地处环渤海湾,海水资源丰富。科研人员把铁的配合物(L为配体)溶于弱碱性的海水中,制成吸收液,将气体转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①的吸收氧化;②的再生。反应原理如下:
①
②
回答下列问题:
(1)、该工艺的总反应方程式为。1mol 发生该反应的热量变化为 , 在总反应中的作用是。(2)、研究不同配体与所形成的配合物(A、B、C)对吸收转化率的影响。将配合物A、B、C分别溶于海水中,配成相同物质的量浓度的吸收液,在相同反应条件下,分别向三份吸收液持续通入 , 测得单位体积吸收液中吸收转化率随时间变化的曲线如图1所示。以由100%降至80%所持续的时间来评价铁配合物的脱硫效率,结果最好的是(填“A”、“B”或“C”)。 (3)、的电离方程式为。25℃时,溶液中、、在含硫粒子总浓度中所占分数随溶液pH的变化关系如图2,由图2计算,的 , 。再生反应在常温下进行,解离出的易与溶液中的形成沉淀。若溶液中的 , , 为避免有FeS沉淀生成,应控制溶液pH不大于(已知25℃时,FeS的为)。
(3)、的电离方程式为。25℃时,溶液中、、在含硫粒子总浓度中所占分数随溶液pH的变化关系如图2,由图2计算,的 , 。再生反应在常温下进行,解离出的易与溶液中的形成沉淀。若溶液中的 , , 为避免有FeS沉淀生成,应控制溶液pH不大于(已知25℃时,FeS的为)。 28. 自发热材料在生活中的应用日益广泛。某实验小组为探究“”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值()随时间(t)的变化曲线,如图所示。
28. 自发热材料在生活中的应用日益广泛。某实验小组为探究“”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值()随时间(t)的变化曲线,如图所示。实验编号
反应物组成
a
粉末
b
粉
c
粉
饱和石灰水
d
粉
石灰乳
e
粉
粉末
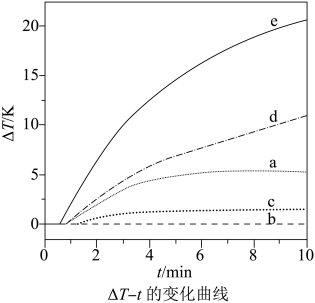
回答下列问题:
(1)、已知:①
②
③
则的。
(2)、温度为T时, , 则饱和溶液中(用含x的代数式表示)。(3)、实验a中,后基本不变,原因是。(4)、实验b中,的变化说明粉与在该条件下(填“反应”或“不反应”)。实验c中,前的有变化,其原因是;后基本不变,其原因是微粒的量有限。(5)、下列说法不能解释实验d在内温度持续升高的是____(填标号)。A、反应②的发生促使反应①平衡右移 B、反应③的发生促使反应②平衡右移 C、气体的逸出促使反应③向右进行 D、温度升高导致反应速率加快(6)、归纳以上实验结果,根据实验e的特征,用文字简述其发热原理。29. 白云石的主要化学成分为 , 还含有质量分数约为2.1%的Fe2O3和1.0%的SiO2。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。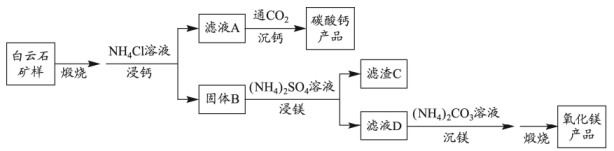
已知:
物质
(1)、白云石矿样煅烧完全分解的化学方程式为。(2)、用量对碳酸钙产品的影响如下表所示。氧化物()浸出率/%
产品中纯度/%
产品中Mg杂质含量/%
(以计)
计算值
实测值
2.1∶1
98.4
1.1
99.1
99.7
——
2.2∶1
98.8
1.5
98.7
99.5
0.06
2.4∶1
99.1
6.0
95.2
97.6
2.20
备注:ⅰ、浸出率=(浸出的质量/煅烧得到的质量)(M代表Ca或Mg)
ⅱ、纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中纯度。
①解释“浸钙”过程中主要浸出的原因是。
②沉钙反应的离子方程式为。
③“浸钙”过程不适宜选用的比例为。
④产品中纯度的实测值高于计算值的原因是。
(3)、“浸镁”过程中,取固体B与一定浓度的溶液混合,充分反应后的浸出率低于60%。加热蒸馏,的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是。(4)、滤渣C中含有的物质是。(5)、该流程中可循环利用的物质是。30. 工业上以氟磷灰石[ , 含等杂质]为原料生产磷酸和石膏,工艺流程如下:
回答下列问题:
(1)、酸解时有产生。氢氟酸与反应生成二元强酸 , 离子方程式为。(2)、部分盐的溶度积常数见下表。精制Ⅰ中,按物质的量之比加入脱氟,充分反应后,;再分批加入一定量的 , 首先转化为沉淀的离子是。(3)、浓度(以计)在一定范围时,石膏存在形式与温度、浓度(以计)的关系如图甲所示。酸解后,在所得、为45的混合体系中,石膏存在形式为(填化学式);洗涤时使用一定浓度的硫酸溶液而不使用水,原因是 , 回收利用洗涤液X的操作单元是;一定温度下,石膏存在形式与溶液中和的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是(填标号)。
A.、、 B.、、
C.、、 D.、、
31. 食醋是烹饪美食的调味品,有效成分主要为醋酸(用 表示)。 的应用与其电离平衡密切相关。25℃时, 的 。(1)、配制 的 溶液,需 溶液的体积为mL。(2)、下列关于250mL容量瓶的操作,正确的是。 (3)、某小组研究25℃下 电离平衡的影响因素。
(3)、某小组研究25℃下 电离平衡的影响因素。提出假设 稀释 溶液或改变 浓度, 电离平衡会发生移动。
设计方案并完成实验 用浓度均为 的 和 溶液,按下表配制总体积相同的系列溶液;测定 ,记录数据。
序号
Ⅰ
40.00
/
/
0
2.86
Ⅱ
4.00
/
36.00
0
3.36
…
Ⅶ
4.00
a
b
3∶4
4.53
Ⅷ
4.00
4.00
32.00
1∶1
4.65
①根据表中信息,补充数据: , 。
②由实验Ⅰ和Ⅱ可知,稀释 溶液,电离平衡(填”正”或”逆”)向移动;结合表中数据,给出判断理由:。
③由实验Ⅱ~VIII可知,增大 浓度, 电离平衡逆向移动。
实验结论 假设成立。
(4)、小组分析上表数据发现:随着 的增加, 的值逐渐接近 的 。查阅资料获悉:一定条件下,按 配制的溶液中, 的值等于 的 。
对比数据发现,实验VIII中 与资料数据 存在一定差异;推测可能由物质浓度准确程度不够引起,故先准确测定 溶液的浓度再验证。
(ⅰ)移取 溶液,加入2滴酚酞溶液,用 溶液滴定至终点,消耗体积为 ,则该 溶液的浓度为 。在答题卡虚线框中,画出上述过程的滴定曲线示意图并标注滴定终点。
(ⅱ)用上述 溶液和 溶液,配制等物质的量的 与
 混合溶液,测定pH,结果与资料数据相符。(5)、小组进一步提出:如果只有浓度均约为 的 和 溶液,如何准确测定 的 ?小组同学设计方案并进行实验。请完成下表中Ⅱ的内容。
混合溶液,测定pH,结果与资料数据相符。(5)、小组进一步提出:如果只有浓度均约为 的 和 溶液,如何准确测定 的 ?小组同学设计方案并进行实验。请完成下表中Ⅱ的内容。Ⅰ
移取 溶液,用 溶液滴定至终点,消耗 溶液
Ⅱ
, 测得溶液的pH为4.76
实验总结 得到的结果与资料数据相符,方案可行。
(6)、根据 可以判断弱酸的酸性强弱。写出一种无机弱酸及其用途。32. 稀土( )包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下: 
已知:月桂酸 熔点为 ;月桂酸和 均难溶于水。该工艺条件下,稀土离子保持 价不变; 的 ; 开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子
开始沉淀时的pH
8.8
1.5
3.6
6.2~7.4
沉淀完全时的pH
/
3.2
4.7
/
(1)、“氧化调pH”中,化合价有变化的金属离子是。(2)、“过滤1”前,用 溶液调pH至的范围内,该过程中 发生反应的离子方程式为。(3)、“过滤2”后,滤饼中检测不到 元素,滤液2中 浓度为 。为尽可能多地提取 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中 低于 (保留两位有效数字)。(4)、①“加热搅拌”有利于加快 溶出、提高产率,其原因是。②“操作X”的过程为:先 , 再固液分离。
(5)、该工艺中,可再生循环利用的物质有(写化学式)。(6)、稀土元素钇(Y)可用于制备高活性的合金类催化剂 。①还原 和 熔融盐制备 时,生成
 转移 电子。
转移 电子。② 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化 的还原,发生的电极反应为。
33. 铬及其化合物在催化、金属防腐等方面具有重要应用。(1)、催化剂 可由 加热分解制备,反应同时生成无污染气体。①完成化学方程式: 。
② 催化丙烷脱氢过程中,部分反应历程如图1, 过程的焓变为(列式表示)。

③ 可用于 的催化氧化。设计从 出发经过3步反应制备 的路线(用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为。
(2)、 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:(ⅰ)
(ⅱ)
①下列有关 溶液的说法正确的有。
A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量 溶液,反应(ⅰ)的平衡逆向移动
D.加入少量 固体,平衡时 与 的比值保持不变
② 时, 溶液中 随pH的变化关系如图2。当 时,设 、 与 的平衡浓度分别为x、y、z ,则x、y、z之间的关系式为 ;计算溶液中 的平衡浓度(写出计算过程,结果保留两位有效数字)。

③在稀溶液中,一种物质对光的吸收程度(A)与其所吸收光的波长( )有关;在一定波长范围内,最大A对应的波长( )取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究pH对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、 不同的 稀溶液,测得其A随 的变化曲线如图3。波长 、 和 中,与 的 最接近的是;溶液 从a变到b的过程中, 的值(填“增大”“减小”或“不变”)。
34. 废旧铅蓄电池的铅膏中主要含有、、和 , 还有少量、、的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。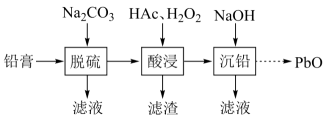
一些难溶电解质的溶度积常数如下表:
难溶电解质
一定条件下,一些金属氢氧化物沉淀时的如下表:
金属氢氧化物
开始沉淀的
2.3
6.8
3.5
7.2
完全沉淀的
3.2
8.3
4.6
9.1
回答下列问题:
(1)、在“脱硫”中转化反应的离子方程式为 , 用沉淀溶解平衡原理解释选择的原因。(2)、在“脱硫”中,加入不能使铅膏中完全转化,原因是。(3)、在“酸浸”中,除加入醋酸(),还要加入。(ⅰ)能被氧化的离子是;
(ⅱ)促进了金属在醋酸中转化为 , 其化学方程式为;
(ⅲ)也能使转化为 , 的作用是。
(4)、“酸浸”后溶液的约为4.9,滤渣的主要成分是。(5)、“沉铅”的滤液中,金属离子有。