近三年高考化学真题分类汇编:电解质溶液(2023年)
试卷更新日期:2023-07-24 类型:二轮复习
一、选择题
-
1. 处理某铜冶金污水(含)的部分流程如下:
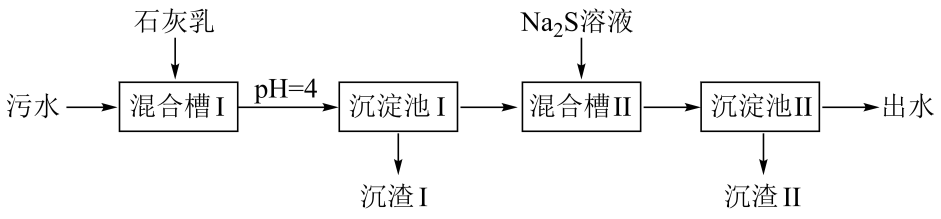
已知:①溶液中金属离子开始沉淀和完全沉淀的如下表所示:
物质
开始沉淀
1.9
4.2
6.2
3.5
完全沉淀
3.2
6.7
8.2
4.6
②。
下列说法错误的是
A、“沉渣Ⅰ”中含有和 B、溶液呈碱性,其主要原因是 C、“沉淀池Ⅱ”中,当和完全沉淀时,溶液中 D、“出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水2. 常温下,用浓度为的标准溶液滴定浓度均为的和的混合溶液,滴定过程中溶液的随()的变化曲线如图所示。下列说法错误的是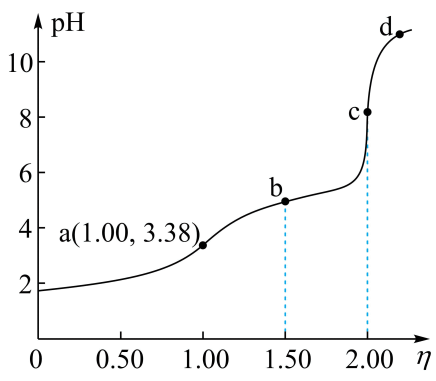 A、约为 B、点a: C、点b: D、水的电离程度:3. 某废水处理过程中始终保持H2S饱和,即 , 通过调节pH使和形成硫化物而分离,体系中与关系如下图所示,c为和的浓度,单位为。已知 , 下列说法正确的是
A、约为 B、点a: C、点b: D、水的电离程度:3. 某废水处理过程中始终保持H2S饱和,即 , 通过调节pH使和形成硫化物而分离,体系中与关系如下图所示,c为和的浓度,单位为。已知 , 下列说法正确的是 A、 B、③为与的关系曲线 C、 D、4. 物质结构决定物质性质。下列性质差异与结构因素匹配错误的是
A、 B、③为与的关系曲线 C、 D、4. 物质结构决定物质性质。下列性质差异与结构因素匹配错误的是选项
性质差异
结构因素
A
沸点:正戊烷(36.1℃)高于新戊烷(9.5℃)
分子间作用力
B
熔点:(1040℃)远高于(178℃升华)
晶体类型
C
酸性:()远强于()
羟基极性
D
溶解度(20℃):(29g)大于(8g)
阴离子电荷
A、A B、B C、C D、D5. 下列化学事实不符合“事物的双方既相互对立又相互统一”的哲学观点的是A、石灰乳中存在沉淀溶解平衡 B、氯气与强碱反应时既是氧化剂又是还原剂 C、铜锌原电池工作时,正极和负极同时发生反应 D、Li、Na、K的金属性随其核外电子层数增多而增强6. 为某邻苯二酚类配体,其 , 。常温下构建溶液体系,其中 , 。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数 , 已知 , 。下列说法正确的是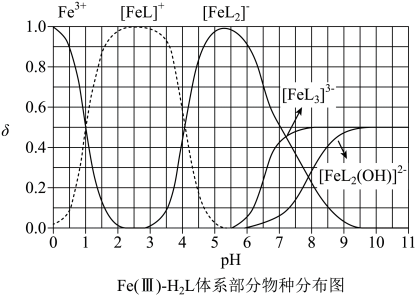 A、当时,体系中 B、pH在9.5~10.5之间,含L的物种主要为 C、的平衡常数的lgK约为14 D、当时,参与配位的7. 一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
A、当时,体系中 B、pH在9.5~10.5之间,含L的物种主要为 C、的平衡常数的lgK约为14 D、当时,参与配位的7. 一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。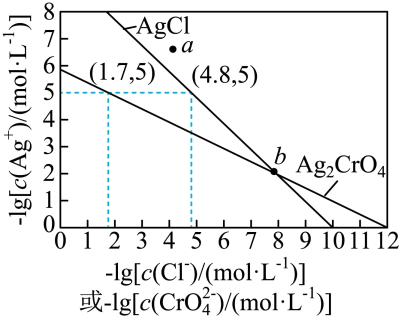
下列说法正确的是
A、a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀 B、b点时,c(Cl-)=c(CrO),Ksp(AgCl)=Ksp(Ag2CrO4) C、Ag2CrO4+2Cl-2AgCl+CrO的平衡常数K=107.9 D、向NaCl、Na2CrO4均为0.1mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀8. 向饱和溶液(有足量固体)中滴加氨水,发生反应和 , 与的关系如下图所示(其中M代表、、或)。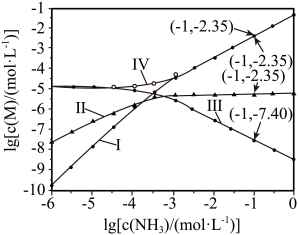
下列说法错误的是
A、曲线I可视为溶解度随浓度变化曲线 B、的溶度积常数 C、反应的平衡常数K的值为 D、时,溶液中9. 下图为和在水中达沉淀溶解平衡时的关系图(;可认为离子沉淀完全)。下列叙述正确的是 A、由点可求得 B、时的溶解度为 C、浓度均为的和可通过分步沉淀进行分离 D、混合溶液中时二者不会同时沉淀10. 硫酸铜应用广泛,下列说法错误的是A、元素位于周期表p区 B、硫酸铜属于强电解质 C、硫酸铜溶液呈酸性 D、硫酸铜能使蛋白质变性11. 甲酸是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分 , R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始关系如图(已知甲酸),下列说法错误的是
A、由点可求得 B、时的溶解度为 C、浓度均为的和可通过分步沉淀进行分离 D、混合溶液中时二者不会同时沉淀10. 硫酸铜应用广泛,下列说法错误的是A、元素位于周期表p区 B、硫酸铜属于强电解质 C、硫酸铜溶液呈酸性 D、硫酸铜能使蛋白质变性11. 甲酸是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分 , R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始关系如图(已知甲酸),下列说法错误的是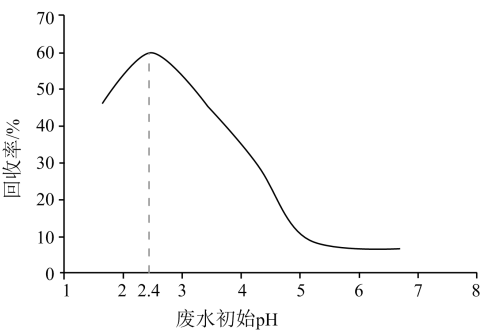 A、活性成分在水中存在平衡: B、的废水中 C、废水初始 , 随下降,甲酸的电离被抑制,与作用的数目减少 D、废水初始 , 离子交换树脂活性成分主要以形态存在12. 碳酸钙是常见难溶物,将过量碳酸钙粉末置于水中达到溶解平衡:
A、活性成分在水中存在平衡: B、的废水中 C、废水初始 , 随下降,甲酸的电离被抑制,与作用的数目减少 D、废水初始 , 离子交换树脂活性成分主要以形态存在12. 碳酸钙是常见难溶物,将过量碳酸钙粉末置于水中达到溶解平衡:[已知 , , 的电离常数],下列有关说法正确的是
A、上层清液中存在 B、上层清液中含碳微粒最主要以形式存在 C、向体系中通入气体,溶液中保持不变 D、通过加溶液可实现向的有效转化二、非选择题
-
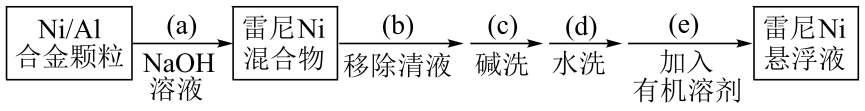
13. 金属对有强吸附作用,被广泛用于硝基或羰基等不饱和基团的催化氢化反应,将块状转化成多孔型雷尼后,其催化活性显著提高。
已知:①雷尼暴露在空气中可以自燃,在制备和使用时,需用水或有机溶剂保持其表面“湿润”;
②邻硝基苯胺在极性有机溶剂中更有利于反应的进行。
某实验小组制备雷尼并探究其催化氢化性能的实验如下:
步骤1:雷尼的制备
步骤2:邻硝基苯胺的催化氢化反应
反应的原理和实验装置图如下(夹持装置和搅拌装置略)。装置Ⅰ用于储存和监测反应过程。
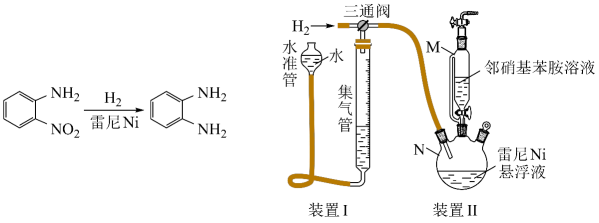
回答下列问题:
(1)、操作(a)中,反应的离子方程式是;(2)、操作(d)中,判断雷尼被水洗净的方法是;(3)、操作(e)中,下列溶剂中最有利于步骤2中氢化反应的是____;A、丙酮 B、四氯化碳 C、乙醇 D、正己烷(4)、向集气管中充入时,三通阀的孔路位置如下图所示:发生氢化反应时,集气管向装置Ⅱ供气,此时孔路位置需调节为; (5)、仪器M的名称是;(6)、反应前应向装置Ⅱ中通入一段时间,目的是;(7)、如果将三颈瓶N中的导气管口插入液面以下,可能导致的后果是;(8)、判断氢化反应完全的现象是。14. 某工厂采用如下工艺处理镍钴矿硫酸浸取液含(和)。实现镍、钴、镁元素的回收。
(5)、仪器M的名称是;(6)、反应前应向装置Ⅱ中通入一段时间,目的是;(7)、如果将三颈瓶N中的导气管口插入液面以下,可能导致的后果是;(8)、判断氢化反应完全的现象是。14. 某工厂采用如下工艺处理镍钴矿硫酸浸取液含(和)。实现镍、钴、镁元素的回收。
已知:
物质
回答下列问题:
(1)、用硫酸浸取镍钴矿时,提高浸取速率的方法为(答出一条即可)。(2)、“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸 , 中过氧键的数目为。(3)、“氧化”中,用石灰乳调节 , 被氧化为 , 该反应的离子方程式为(的电离第一步完全,第二步微弱);滤渣的成分为、(填化学式)。(4)、“氧化”中保持空气通入速率不变,(Ⅱ)氧化率与时间的关系如下。体积分数为时,(Ⅱ)氧化速率最大;继续增大体积分数时,(Ⅱ)氧化速率减小的原因是。 (5)、“沉钴镍”中得到的(Ⅱ)在空气中可被氧化成 , 该反应的化学方程式为。(6)、“沉镁”中为使沉淀完全 , 需控制不低于(精确至0.1)。15. 是生产多晶硅的副产物。利用对废弃的锂电池正极材料进行氯化处理以回收Li、Co等金属,工艺路线如下:
(5)、“沉钴镍”中得到的(Ⅱ)在空气中可被氧化成 , 该反应的化学方程式为。(6)、“沉镁”中为使沉淀完全 , 需控制不低于(精确至0.1)。15. 是生产多晶硅的副产物。利用对废弃的锂电池正极材料进行氯化处理以回收Li、Co等金属,工艺路线如下: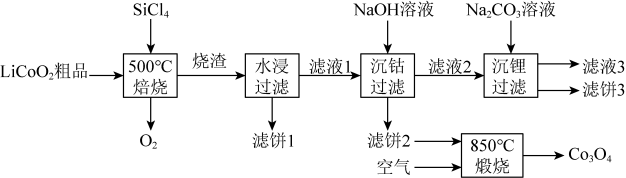
回答下列问题:
(1)、Co位于元素周期表第周期,第族。(2)、烧渣是LiCl、和的混合物,“500℃焙烧”后剩余的应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因。(3)、鉴别洗净的“滤饼3”和固体常用方法的名称是。(4)、已知 , 若“沉钴过滤”的pH控制为10.0,则溶液中浓度为。“850℃煅烧”时的化学方程式为。(5)、导致比易水解的因素有(填标号)。a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
16. LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3 , 含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如下: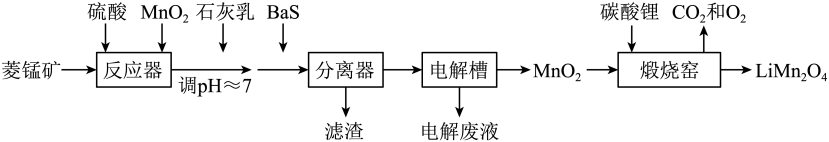
已知:Ksp[Fe(OH)3]=2.8×10-39 , Ksp[Al(OH)3]=1.3×10-33 , Ksp[Ni(OH)2]=5.5×10-16。
回答下列问题:
(1)、硫酸溶矿主要反应的化学方程式为。为提高溶矿速率,可采取的措施(举1例)。(2)、加入少量MnO2的作用是。不宜使用H2O2替代MnO2 , 原因是。(3)、溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)=mol·L-1;用石灰乳调节至pH≈7,除去的金属离子是。(4)、加入少量BaS溶液除去Ni2+ , 生成的沉淀有。(5)、在电解槽中,发生电解反应的离子方程式为。随着电解反应进行,为保持电解液成分稳定,应不断。电解废液可在反应器中循环利用。(6)、缎烧窑中,生成LiMn2O4反应的化学方程式是。17. 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:
已知:最高价铬酸根在酸性介质中以存在,在碱性介质中以存在。
回答下列问题:
(1)、煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为(填化学式)。(2)、水浸渣中主要有和。(3)、“沉淀”步骤调到弱碱性,主要除去的杂质是。(4)、“除硅磷”步骤中,使硅、磷分别以和的形式沉淀,该步需要控制溶液的以达到最好的除杂效果,若时,会导致;时,会导致。(5)、“分离钒”步骤中,将溶液调到1.8左右得到沉淀,在时,溶解为或在碱性条件下,溶解为或 , 上述性质说明具有_______(填标号)。A、酸性 B、碱性 C、两性(6)、“还原”步骤中加入焦亚硫酸钠()溶液,反应的离子方程式为。18. 是一种压电材料。以为原料,采用下列路线可制备粉状。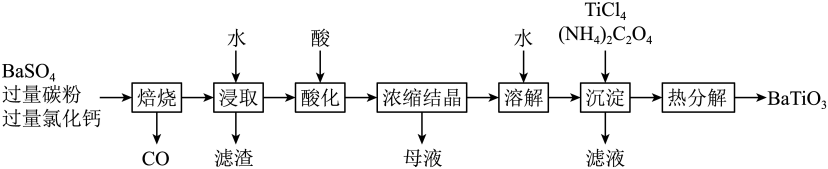
回答下列问题:
(1)、“焙烧”步骤中碳粉的主要作用是。(2)、“焙烧”后固体产物有、易溶于水的和微溶于水的。“浸取”时主要反应的离子方程式为。(3)、“酸化”步骤应选用的酸是(填标号)。a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸
(4)、如果焙烧后的产物直接用酸浸取,是否可行? , 其原因是。(5)、“沉淀”步骤中生成的化学方程式为。(6)、“热分解”生成粉状钛酸钡,产生的。19. 钴配合物溶于热水,在冷水中微溶,可通过如下反应制备:。具体步骤如下:
Ⅰ.称取 , 用水溶解。
Ⅱ.分批加入后,将溶液温度降至以下,加入活性炭、浓氨水,搅拌下逐滴加入的双氧水。
Ⅲ.加热至反应。冷却,过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的沸水中,趁热过滤。
Ⅴ.滤液转入烧杯,加入浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
(1)、步骤Ⅰ中使用的部分仪器如下。
仪器a的名称是。加快NH4Cl溶解的操作有。
(2)、步骤Ⅱ中,将温度降至10℃以下以避免、;可选用降低溶液温度。(3)、指出下列过滤操作中不规范之处:。 (4)、步骤Ⅳ中,趁热过滤,除掉的不溶物主要为。(5)、步骤Ⅴ中加入浓盐酸的目的是。
(4)、步骤Ⅳ中,趁热过滤,除掉的不溶物主要为。(5)、步骤Ⅴ中加入浓盐酸的目的是。