近三年高考化学真题分类汇编:化学反应与能量(2021年)1
试卷更新日期:2023-07-24 类型:二轮复习
一、选择题
-
1. 甲烷单加氧酶(s—mmo)含有双核铁活性中心,是O2氧化CH4生成CH3OH的催化剂,反应过程如图所示。下列叙述错误的是( )
 A、基态Fe原子的核外电子排布式为[Ar]3d64s2 B、步骤③有非极性键的断裂和极性键的形成 C、每一步骤都存在铁和氧元素之间的电子转移 D、图中的总过程可表示为:CH4+O2+2H++2e- CH3OH+H2O2. Na2Cr2O7的酸性水溶液随着H+浓度的增大会转化为CrO3。电解法制备CrO3的原理如图所示。下列说法错误的是( )
A、基态Fe原子的核外电子排布式为[Ar]3d64s2 B、步骤③有非极性键的断裂和极性键的形成 C、每一步骤都存在铁和氧元素之间的电子转移 D、图中的总过程可表示为:CH4+O2+2H++2e- CH3OH+H2O2. Na2Cr2O7的酸性水溶液随着H+浓度的增大会转化为CrO3。电解法制备CrO3的原理如图所示。下列说法错误的是( )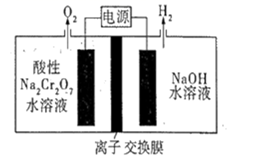 A、电解时只允许H+通过离子交换膜 B、生成O2和H2的质量比为8∶1 C、电解一段时间后阴极区溶液OH-的浓度增大 D、CrO3的生成反应为:Cr2O +2H+=2CrO3+H2O3. 近年我国在科学技术领域取得了举世瞩目的成就。对下列成就所涉及的化学知识的判断错误的是( )A、北斗三号卫星搭载了精密计时的铷原子钟,铷(Rb)是金属元素 B、奋斗者号潜水器载人舱外壳使用了钛合金,钛合金属于无机非金属材料 C、长征五号B遥二火箭把天和核心舱送入太空,火箭动力源于氧化还原反应 D、天问一号探测器着陆火星过程中使用了芳纶制作的降落伞,芳纶是高分子材料4. 如下所示电解装置中,通电后石墨电极Ⅱ上有O2生成,Fe2O3逐渐溶解,下列判断错误的是( )
A、电解时只允许H+通过离子交换膜 B、生成O2和H2的质量比为8∶1 C、电解一段时间后阴极区溶液OH-的浓度增大 D、CrO3的生成反应为:Cr2O +2H+=2CrO3+H2O3. 近年我国在科学技术领域取得了举世瞩目的成就。对下列成就所涉及的化学知识的判断错误的是( )A、北斗三号卫星搭载了精密计时的铷原子钟,铷(Rb)是金属元素 B、奋斗者号潜水器载人舱外壳使用了钛合金,钛合金属于无机非金属材料 C、长征五号B遥二火箭把天和核心舱送入太空,火箭动力源于氧化还原反应 D、天问一号探测器着陆火星过程中使用了芳纶制作的降落伞,芳纶是高分子材料4. 如下所示电解装置中,通电后石墨电极Ⅱ上有O2生成,Fe2O3逐渐溶解,下列判断错误的是( ) A、a是电源的负极 B、通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色 C、随着电解的进行,CuCl2溶液浓度变大 D、当 完全溶解时,至少产生气体336mL (折合成标准状况下)5. 关于反应 所涉及的物质,下列说法错误的是( )A、H2SO4在该反应中为氧化剂 B、Na2SO3容易被空气中的O2氧化变质 C、Na2SO4是含有共价键的离子化合物 D、SO2是导致酸雨的主要有害污染物6. 如图,某液态金属储能电池放电时产生金属化合物 。下列说法正确的是( )
A、a是电源的负极 B、通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色 C、随着电解的进行,CuCl2溶液浓度变大 D、当 完全溶解时,至少产生气体336mL (折合成标准状况下)5. 关于反应 所涉及的物质,下列说法错误的是( )A、H2SO4在该反应中为氧化剂 B、Na2SO3容易被空气中的O2氧化变质 C、Na2SO4是含有共价键的离子化合物 D、SO2是导致酸雨的主要有害污染物6. 如图,某液态金属储能电池放电时产生金属化合物 。下列说法正确的是( )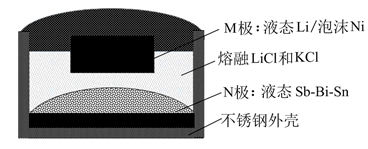 A、放电时,M电极反应为 B、放电时, 由M电极向N电极移动 C、充电时,M电极的质量减小 D、充电时,N电极反应为7. 利用
A、放电时,M电极反应为 B、放电时, 由M电极向N电极移动 C、充电时,M电极的质量减小 D、充电时,N电极反应为7. 利用 (Q)与
(Q)与  电解转化法从烟气中分离 的原理如图。已知气体可选择性通过膜电极,溶液不能通过。下列说法错误的是( )
电解转化法从烟气中分离 的原理如图。已知气体可选择性通过膜电极,溶液不能通过。下列说法错误的是( )  A、a为电源负极 B、溶液中Q的物质的量保持不变 C、 在M极被还原 D、分离出的 从出口2排出8. 由下列实验操作及现象能得出相应结论的是( )
A、a为电源负极 B、溶液中Q的物质的量保持不变 C、 在M极被还原 D、分离出的 从出口2排出8. 由下列实验操作及现象能得出相应结论的是( )实验操作
现象
结论
A
向KBr、KI混合溶液中依次加入少量氯水和CCl4 , 振荡,静置
溶液分层,下层呈紫红色
氧化性:
B
在火焰上灼烧搅拌过某无色溶液的玻璃棒
火焰出现黄色
溶液中含Na元素
C
用pH计测定pH:①NaHCO3溶液②CH3COONa溶液
pH:①>②
H2CO3酸性弱于CH3COOH
D
把水滴入盛有少量Na2O2的试管中,立即把带火星木条放在试管口
木条复燃
反应生成了O2
A、A B、B C、C D、D9. 元末陶宗仪《辍耕录》中记载:“杭人削松木为小片,其薄为纸,熔硫磺涂木片顶端分许,名日发烛……,盖以发火及代灯烛用也。”下列有关说法错误的是( )A、将松木削薄为纸片状有助于发火和燃烧 B、“发烛”发火和燃烧利用了物质的可燃性 C、“发烛”发火和燃烧伴随不同形式的能量转化 D、硫磺是“发烛”发火和燃烧反应的催化剂10. 依据下列实验和现象,得出结论正确的是( )选项
实验
现象
结论
A
点燃无色气体 ,将生成的气体通入澄清石灰水
澄清石灰水先浑浊后澄清
为
B
25℃时,向无色的 溶液中滴加1~2滴酚酞试液
溶液仍为无色
溶液的
C
在淀粉和 的混合溶液中滴加 溶液。[已知: 、 分别与卤素单质、卤素离子性质相似]
溶液仍为蓝色
氧化性:
D
在稀 中加入少量
溶液由无色变为蓝色并有红色固体生成
反应中 既作氧化剂又作还原剂
A、A B、B C、C D、D11. 液氨中存在平衡: 。如图所示为电解池装置,以 的液氨溶液为电解液,电解过程中a、b两个惰性电极上都有气泡产生。下列有关说法正确的是( ) A、b电极连接的是电源的负极 B、a电极的反应为 C、电解过程中,阴极附近K+浓度减小 D、理论上两极产生的气体物质的量之比为1:112. Li电池使用过程中会产生LiH,对电池的性能和安全性带来影响。可用D2O与LiH进行反应测定LiH含量,由产物中的n(D2)/n(HD)比例可推算n(Li)/n(LiH)。
A、b电极连接的是电源的负极 B、a电极的反应为 C、电解过程中,阴极附近K+浓度减小 D、理论上两极产生的气体物质的量之比为1:112. Li电池使用过程中会产生LiH,对电池的性能和安全性带来影响。可用D2O与LiH进行反应测定LiH含量,由产物中的n(D2)/n(HD)比例可推算n(Li)/n(LiH)。已知:①2LiH⇌2Li+H2 △H>0
②LiH+H2O=LiOH+H2↑
下列说法错误的是( )
A、H2O、D2O的化学性质基本相同 B、Li与D2O反应的方程式是2Li+2D2O=2LiOD+D2↑ C、n(D2)/n(HD)比例小说明n(Li)/n(LiH)比例大 D、80℃下的n(D2)/n(HD)大于25℃下的n(D2)/n(HD)13. 已知C3H8脱H2制烯烃的反应为C3H8 = C3H6+H2。固定C3H8浓度不变,提高CO2浓度,测定出口处C3H6、H2、CO浓度。实验结果如下图。
已知:
C3H8(g)+5O2(g)=3CO2(g)+4H2O(g) △H=-2043.9kJ/mol
C3H6(g)+9/2O2(g)=3CO2(g)+3H2O(g) △H=-1926.1kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ/mol
下列说法错误的是( )
A、C3H8(g)=C3H6(g)+H2(g) △H=+124kJ/mol B、C3H6、H2的浓度随CO2浓度变化趋势的差异是因为发生了CO2+H2 CO+H2O C、相同条件下,提高C3H8对CO2的比例,可以提高C3H8的转化率 D、如果生成物只有C3H6、CO、H2O、H2 , 那么入口各气体的浓度c0和出口各气体的浓度符合3c0(C3H8)+c0(CO2)=3c(C3H6)+c(CO)+3c(C3H8)+c(CO2)14. 用电石(主要成分为CaC2 , 含CaS和Ca3P2等)制取乙炔时,常用CuSO4溶液除去乙炔中的杂质。反应为:①CuSO4+H2S=CuS↓+H2SO4
②11PH3+24CuSO4+12H2O=3H3PO4+24H2SO4+8Cu3P↓
下列分析错误的是( )
A、CaS、Ca3P2发生水解反应的化学方程式:CaS+2H2O=Ca(OH)2+H2S↑、Ca3P2+6H2O=3Ca(OH)2+2PH3↑ B、不能依据反应①比较硫酸与氢硫酸的酸性强弱 C、反应②中每24 mol CuSO4氧化11 mol PH3 D、用酸性KMnO4溶液验证乙炔还原性时,H2S、PH3有干扰15. 有利于实现“碳达峰、碳中和”的是( )A、风能发电 B、粮食酿酒 C、燃煤脱硫 D、石油裂化16. 以KOH溶液为离子导体,分别组成CH3OH-O2、N2H4-O2、(CH3)2NNH2-O2清洁燃料电池,下列说法正确的是( )A、放电过程中,K+均向负极移动 B、放电过程中,KOH物质的量均减小 C、消耗等质量燃料,(CH3)2NNH2—O2燃料电池的理论放电量最大 D、消耗1molO2时,理论上N2H4—O2燃料电池气体产物的体积在标准状况下为11.2L17. 18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为: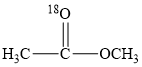 +OH-
+OH- 
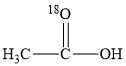 +CH3O-能量变化如图所示。已知
+CH3O-能量变化如图所示。已知 
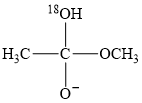 为快速平衡,下列说法正确的是( )
为快速平衡,下列说法正确的是( )  A、反应Ⅱ、Ⅲ为决速步 B、反应结束后,溶液中存在18OH- C、反应结束后,溶液中存在CH318OH D、反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变
A、反应Ⅱ、Ⅲ为决速步 B、反应结束后,溶液中存在18OH- C、反应结束后,溶液中存在CH318OH D、反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变二、多选题
-
18. 实验室中利用固体KMnO4进行如图实验,下列说法错误的是( )
 A、G与H均为氧化产物 B、实验中KMnO4只作氧化剂 C、Mn元素至少参与了3个氧化还原反应 D、G与H的物质的量之和可能为0.25mol
A、G与H均为氧化产物 B、实验中KMnO4只作氧化剂 C、Mn元素至少参与了3个氧化还原反应 D、G与H的物质的量之和可能为0.25mol三、非选择题
-
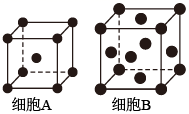
19. 铁单质及其化合物的应用非常广泛。(1)、基态Fe原子的价层电子排布式为。(2)、用X射线衍射测定,得到Fe的两种晶胞A、B,其结构如图所示。晶胞A中每个Fe原子紧邻的原子数为。每个晶胞B中含Fe原子数为。
 (3)、合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式。从能量角度分析,铁触媒的作用是。
(3)、合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式。从能量角度分析,铁触媒的作用是。 (4)、Fe3+可与H2O、SCN-、F-等配体形成配位数为6的配离子,如 、 、 。某同学按如下步骤完成实验:
(4)、Fe3+可与H2O、SCN-、F-等配体形成配位数为6的配离子,如 、 、 。某同学按如下步骤完成实验:
① 为浅紫色,但溶液Ⅰ却呈黄色,其原因是 , 为了能观察到溶液Ⅰ中 的浅紫色,可采取的方法是。
②已知Fe3+与SCN-、F-的反应在溶液中存在以下平衡: ; ,向溶液Ⅱ中加入NaF后,溶液颜色由红色转变为无色。若该反应是可逆反应,其离子方程式为 , 平衡常数为(用K1和K2表示)。
20. 苯催化加氢制备环己烷是化工生产中的重要工艺,一定条件下,发生如下反应:Ⅰ.主反应:
 (g)+3H2(g)⇌
(g)+3H2(g)⇌  (g) ∆H1<0
(g) ∆H1<0Ⅱ.副反应:
 (g) ⇌
(g) ⇌ 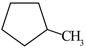 (g) ∆H2>0
(g) ∆H2>0回答下列问题:
(1)、已知:Ⅲ.Ⅳ.2
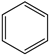 (g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
(g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4Ⅴ.
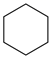 (g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
(g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5则 (用 、 和 表示)。
(2)、有利于提高平衡体系中环己烷体积分数的措施有_______。A、适当升温 B、适当降温 C、适当加压 D、适当减压(3)、反应Ⅰ在管式反应器中进行,实际投料往往在 的基础上适当增大 用量,其目的是。(4)、氢原子和苯分子吸附在催化剂表面活性中心时,才能发生反应,机理如图。当 中混有微量 或 等杂质时,会导致反应Ⅰ的产率降低,推测其可能原因为。 (5)、催化剂载体中的酸性中心能催化苯及环己烷的裂解。已知酸性中心可结合弧电子对,下图中可作为酸性中心的原子的标号是(填“①”“②”或“③”)。
(5)、催化剂载体中的酸性中心能催化苯及环己烷的裂解。已知酸性中心可结合弧电子对,下图中可作为酸性中心的原子的标号是(填“①”“②”或“③”)。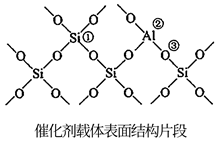 (6)、恒压反应器中,按照 投料,发生Ⅰ、Ⅱ反应,总压为 ,平衡时苯的转化率为α,环己烷的分压为p,则反应1的 (列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。21. 碳及其化合物间的转化广泛存在于自然界及人类的生产和生活中。已知25℃, 时:
(6)、恒压反应器中,按照 投料,发生Ⅰ、Ⅱ反应,总压为 ,平衡时苯的转化率为α,环己烷的分压为p,则反应1的 (列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。21. 碳及其化合物间的转化广泛存在于自然界及人类的生产和生活中。已知25℃, 时:① 葡萄糖 完全燃烧生成 和 ,放出 热量。
② 。
回答问题:
(1)、25℃时, 与 经光合作用生成葡萄糖 和 的热化学方程式为。(2)、25℃, 时,气态分子断开 化学键的焓变称为键焓。已知 、 键的键焓分别为 、 , 分子中碳氧键的键焓为 。(3)、溶于水的 只有部分转化为 ,大部分以水合 的形式存在,水合 可用 表示。已知25℃时, 的平衡常数 ,正反应的速率可表示为 ,逆反应的速率可表示为 ,则 (用含 的代数式表示)。(4)、25℃时,潮湿的石膏雕像表面会发生反应: ,其平衡常数 。[已知 , ](5)、溶洞景区限制参观的游客数量,主要原因之一是游客呼吸产生的气体对钟乳石有破坏作用,从化学平衡的角度说明其原因。22. 环氧乙烷( ,简称EO)是一种重要的工业原料和消毒剂。由乙烯经电解制备EO的原理示意图如下。
,简称EO)是一种重要的工业原料和消毒剂。由乙烯经电解制备EO的原理示意图如下。  (1)、①阳极室产生Cl2后发生的反应有:、CH2=CH2+HClO→HOCH2CH2Cl。
(1)、①阳极室产生Cl2后发生的反应有:、CH2=CH2+HClO→HOCH2CH2Cl。②结合电极反应式说明生成溶液a的原理。
(2)、一定条件下,反应物按一定流速通过该装置。电解效率η和选择性S的定义:
η(B)= ×100%
S(B)= ×100%
①若η(EO)=100%,则溶液b的溶质为。
②当乙烯完全消耗时,测得η(EO)≈70%,S(EO)≈97%,推测η(EO)≈70%的原因:
I.阳极有H2O放电
II.阳极有乙烯放电
III.阳极室流出液中含有Cl2和HClO
……
i.检验电解产物,推测I不成立。需要检验的物质是。
ii.假设没有生成EO的乙烯全部在阳极放电生成CO2 , η(CO2)≈%。经检验阳极放电产物没有CO2。
iii.实验证实推测III成立,所用试剂及现象是。
可选试剂:AgNO3溶液、KI溶液、淀粉溶液、品红溶液。
23. 某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。(1)、浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中存在盐酸和MnO2。①反应的离子方程式是。
②电极反应式:
i还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii氧化反应:。
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱.
ii随c(Cl-)降低,。
④补充实验证实了③中的分析。
实验操作
试剂
产物
I
较浓H2SO4
有Cl2
II
a
有Cl2
III
a+b
无Cl2
a是 , b是。
(2)、利用c(H+)浓度对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是 , 从原子结构角度说明理由。(3)、根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是。(4)、Ag分别与1mol·L1的盐酸、氢溴酸、氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:。(5)、总结:物质氧化性和还原性变化的一般规律是。24. 某小组实验验证“Ag++Fe2+ Fe3++Ag”为可逆反应并测定其平衡常数。(1)、实验验证实验I:将0.0100 mol/L Ag2SO4溶液与0.0400 mo/L FeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验II:向少量Ag粉中加入0.0100 mol/L Fe2(SO4)3溶液(pH=1),固体完全溶解。
①取I中沉淀,加入浓硝酸,证实沉淀为Ag。现象是。
②II中溶液选用Fe2(SO4)3 , 不选用Fe(NO3)3的原因是。
综合上述实验,证实“Ag++Fe2+ Fe3++Ag”为可逆反应。
③小组同学采用电化学装置从平衡移动角度进行验证。补全电化学装置示意图,写出操作及现象。
 (2)、测定平衡常数
(2)、测定平衡常数实验Ⅲ:一定温度下,待实验Ⅰ中反应达到平衡状态时,取v mL上层清液,用c1 mol/L KSCN标准溶液滴定Ag+ , 至出现稳定的浅红色时消耗KSCN标准溶液v1 mL。
资料:Ag++SCN- AgSCN↓(白色) K=1012
Fe3++SCN- FeSCN2+(红色) K=102.3
①滴定过程中Fe3+的作用是。
②测得平衡常数K=。
(3)、思考问题①取实验I的浊液测定c(Ag+),会使所测K值(填“偏高”“偏低”或“不受影响”)。
②不用实验II中清液测定K的原因是。
25. 铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。 资料:
资料:i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O⇌TiO2·xH2O↓+H2SO4
iii.0.1 mol/L Fe2+生成Fe(OH)2 , 开始沉淀时pH=6.3,完全沉淀时pH=8.3;
0.1 mol/L Fe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(1)、纯化①加入过量铁粉的目的是。
②充分反应后,分离混合物的方法是。
(2)、制备晶种为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如图)。

①产生白色沉淀的离子方程式是。
②产生白色沉淀后的pH低于资料iii中的6.3。原因是:沉淀生成后c(Fe2+)0.1mol/L(填“>”“=”或“<”)。
③0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:。
④pH≈4时制得铁黄晶种。若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:。
(3)、产品纯度测定铁黄纯度可以通过产品的耗酸量确定。
wg铁黄 溶液b 溶液c 滴定
资料:Fe3++3 =Fe(C2O4) ,Fe(C2O4) 不与稀碱液反应
Na2C2O4过量,会使测定结果(填“偏大”“偏小”或“不受影响”)
26. 工业上以铬铁矿(FeCr2O4 , 含Al、Si氧化物等杂质)为主要原料制备红矾钠(Na2Cr2O7•2H2O)的工艺流程如图。回答下列问题: (1)、焙烧的目的是将FeCr2O4转化为Na2Cr2O4并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是。(2)、矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶组分浓度c≤1.0×10-5mol•L-1时,可认为已除尽。
(1)、焙烧的目的是将FeCr2O4转化为Na2Cr2O4并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是。(2)、矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶组分浓度c≤1.0×10-5mol•L-1时,可认为已除尽。
中和时pH的理论范围为;酸化的目的是;Fe元素在(填操作单元的名称)过程中除去。
(3)、蒸发结晶时,过度蒸发将导致;冷却结晶所得母液中,除Na2Cr2O7外,可在上述流程中循环利用的物质还有。(4)、利用膜电解技术(装置如图所示),以Na2Cr2O4为主要原料制备Na2Cr2O7的总反应方程式为:4Na2Cr2O4+4H2O 2Na2Cr2O7+4NaOH+2H2↑+O2↑。则Na2Cr2O7在(填“阴”或“阳”)极室制得,电解时通过膜的离子主要为。 27. 2-甲氧基-2-甲基丁烷(TAME)常用作汽油原添加剂。在催化剂作用下,可通过甲醇与烯烃的液相反应制得,体系中同时存在如图反应:
27. 2-甲氧基-2-甲基丁烷(TAME)常用作汽油原添加剂。在催化剂作用下,可通过甲醇与烯烃的液相反应制得,体系中同时存在如图反应:反应Ⅰ:
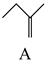 +CH3OH
+CH3OH 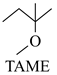 △H1
△H1反应Ⅱ:
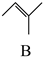 +CH3OH
+CH3OH 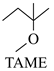 △H2
△H2反应Ⅲ:

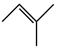 △H3
△H3回答下列问题:
(1)、反应Ⅰ、Ⅱ、Ⅲ以物质的量分数表示的平衡常数Kx与温度T变化关系如图所示。据图判断,A和B中相对稳定的是 (用系统命名法命名); 的数值范围是(填标号)。A.<-1 B.-1~0 C.0~1 D.>1
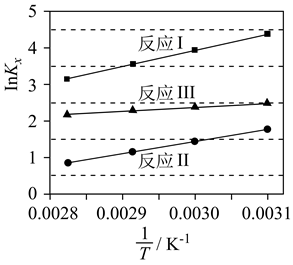 (2)、为研究上述反应体系的平衡关系,向某反应容器中加入1.0molTAME,控制温度为353K,测得TAME的平衡转化率为α。已知反应Ⅲ的平衡常数Kx3=9.0,则平衡体系中B的物质的量为mol,反应Ⅰ的平衡常数Kx1=。同温同压下,再向该容器中注入惰性溶剂四氢呋喃稀释,反应Ⅰ的化学平衡将 (填“正向移动”“逆向移动”或“不移动”)平衡时,A与CH3OH物质的量浓度之比c(A):c(CH3OH)=。(3)、为研究反应体系的动力学行为,向盛有四氢呋喃的另一容器中加入一定量A、B和CH3OH。控制温度为353K,A、B物质的量浓度c随反应时间t的变化如图所示。代表B的变化曲线为 (填“X”或“Y”);t=100s时,反应Ⅲ的正反应速率v正逆反应速率v逆(填“>”“<”或“=)。
(2)、为研究上述反应体系的平衡关系,向某反应容器中加入1.0molTAME,控制温度为353K,测得TAME的平衡转化率为α。已知反应Ⅲ的平衡常数Kx3=9.0,则平衡体系中B的物质的量为mol,反应Ⅰ的平衡常数Kx1=。同温同压下,再向该容器中注入惰性溶剂四氢呋喃稀释,反应Ⅰ的化学平衡将 (填“正向移动”“逆向移动”或“不移动”)平衡时,A与CH3OH物质的量浓度之比c(A):c(CH3OH)=。(3)、为研究反应体系的动力学行为,向盛有四氢呋喃的另一容器中加入一定量A、B和CH3OH。控制温度为353K,A、B物质的量浓度c随反应时间t的变化如图所示。代表B的变化曲线为 (填“X”或“Y”);t=100s时,反应Ⅲ的正反应速率v正逆反应速率v逆(填“>”“<”或“=)。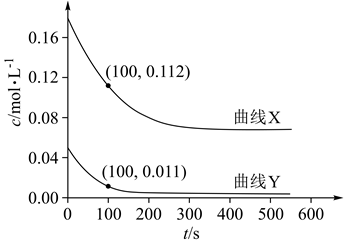
-