近三年高考化学真题分类汇编:化学反应与能量(2022年)2
试卷更新日期:2023-07-24 类型:二轮复习
一、选择题
-
1. 实验装置如图所示。接通电源后,用碳棒(、)作笔,在浸有饱和NaCl溶液和石蕊溶液的湿润试纸上同时写字,端的字迹呈白色。下列结论正确的是( )
 A、a为负极 B、端的字迹呈蓝色 C、电子流向为: D、如果将、换成铜棒,与碳棒作电极时的现象相同2. 古医典富载化学知识,下述之物见其氧化性者为( )A、金(Au):“虽被火亦未熟" B、石灰(CaO):“以水沃之,即热蒸而解” C、石硫黄(S):“能化……银、铜、铁,奇物” D、石钟乳():“色黄,以苦酒(醋)洗刷则白”3. 在NO催化下,丙烷与氧气反应制备丙烯的部分反应机理如图所示。下列说法错误的是( )
A、a为负极 B、端的字迹呈蓝色 C、电子流向为: D、如果将、换成铜棒,与碳棒作电极时的现象相同2. 古医典富载化学知识,下述之物见其氧化性者为( )A、金(Au):“虽被火亦未熟" B、石灰(CaO):“以水沃之,即热蒸而解” C、石硫黄(S):“能化……银、铜、铁,奇物” D、石钟乳():“色黄,以苦酒(醋)洗刷则白”3. 在NO催化下,丙烷与氧气反应制备丙烯的部分反应机理如图所示。下列说法错误的是( )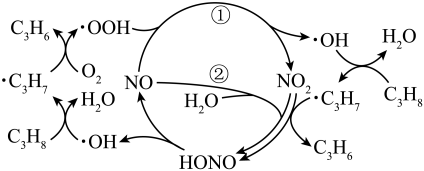 A、含N分子参与的反应一定有电子转移 B、由NO生成的反应历程有2种 C、增大NO的量,的平衡转化率不变 D、当主要发生包含②的历程时,最终生成的水减少4. 高压氢还原法可直接从溶液中提取金属粉。以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如下,可能用到的数据见下表。
A、含N分子参与的反应一定有电子转移 B、由NO生成的反应历程有2种 C、增大NO的量,的平衡转化率不变 D、当主要发生包含②的历程时,最终生成的水减少4. 高压氢还原法可直接从溶液中提取金属粉。以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如下,可能用到的数据见下表。
开始沉淀pH
1.9
4.2
6.2
沉淀完全pH
3.2
6.7
8.2
下列说法错误的是( )
A、固体X主要成分是和S;金属M为Zn B、浸取时,增大压强可促进金属离子浸出 C、中和调pH的范围为3.2~4.2 D、还原时,增大溶液酸度有利于Cu的生成5. 标准状态下,下列物质气态时的相对能量如下表:物质(g)
O
H
能量/
249
218
39
10
0
0
可根据计算出中氧氧单键的键能为。下列说法不正确的是( )
A、的键能为 B、的键能大于中氧氧单键的键能的两倍 C、解离氧氧单键所需能量: D、6. 关于反应 , 下列说法正确的是( )A、发生还原反应 B、既是氧化剂又是还原剂 C、氧化产物与还原产物的物质的量之比为2∶1 D、发生反应,转移电子7. 通过电解废旧锂电池中的可获得难溶性的和 , 电解示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法不正确的是( )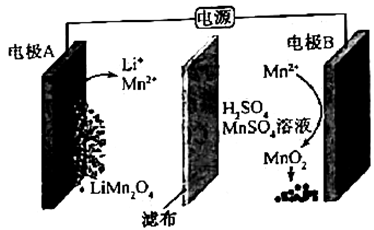 A、电极A为阴极,发生还原反应 B、电极B的电极发应: C、电解一段时间后溶液中浓度保持不变 D、电解结束,可通过调节除去 , 再加入溶液以获得8. 向体积均为 的两恒容容器中分别充入 和 发生反应: ,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是( )
A、电极A为阴极,发生还原反应 B、电极B的电极发应: C、电解一段时间后溶液中浓度保持不变 D、电解结束,可通过调节除去 , 再加入溶液以获得8. 向体积均为 的两恒容容器中分别充入 和 发生反应: ,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是( )
 A、 B、气体的总物质的量: C、a点平衡常数: D、反应速率:9. 海水电池在海洋能源领域备受关注,一种锂-海水电池构造示意图如下。下列说法错误的是( )
A、 B、气体的总物质的量: C、a点平衡常数: D、反应速率:9. 海水电池在海洋能源领域备受关注,一种锂-海水电池构造示意图如下。下列说法错误的是( ) A、海水起电解质溶液作用 B、N极仅发生的电极反应: C、玻璃陶瓷具有传导离子和防水的功能 D、该锂-海水电池属于一次电池10. 科学家发现某些生物酶体系可以促进 和 的转移(如a、b和c),能将海洋中的 转化为 进入大气层,反应过程如图所示。
A、海水起电解质溶液作用 B、N极仅发生的电极反应: C、玻璃陶瓷具有传导离子和防水的功能 D、该锂-海水电池属于一次电池10. 科学家发现某些生物酶体系可以促进 和 的转移(如a、b和c),能将海洋中的 转化为 进入大气层,反应过程如图所示。

下列说法正确的是( )
A、过程Ⅰ中 发生氧化反应 B、a和b中转移的 数目相等 C、过程Ⅱ中参与反应的 D、过程Ⅰ→Ⅲ的总反应为11. 以熔融盐为电解液,以含 和 等的铝合金废料为阳极进行电解,实现 的再生。该过程中( )A、阴极发生的反应为 B、阴极上 被氧化 C、在电解槽底部产生含 的阳极泥 D、阳极和阴极的质量变化相等12. 为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的 溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是( )A、加入 溶液产生沉淀 B、加入淀粉碘化钾溶液无蓝色出现 C、加入 溶液无红色出现 D、加入 溶液无蓝色沉淀生成13. 恒容密闭容器中, 在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法正确的是( )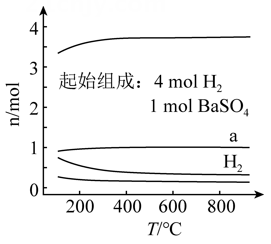 A、该反应的 B、a为 随温度的变化曲线 C、向平衡体系中充入惰性气体,平衡不移动 D、向平衡体系中加入 的平衡转化率增大14. 科学家基于 易溶于 的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为:
A、该反应的 B、a为 随温度的变化曲线 C、向平衡体系中充入惰性气体,平衡不移动 D、向平衡体系中加入 的平衡转化率增大14. 科学家基于 易溶于 的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为:下列说法正确的是( )
 A、充电时电极b是阴极 B、放电时 溶液的 减小 C、放电时 溶液的浓度增大 D、每生成 ,电极a质量理论上增加15. 电池比能量高,在汽车、航天等领域具有良好的应用前景.近年来科学家研究了一种光照充电电池(如图所示).光照时,光催化电极产生电子和空穴 , 驱动阴极反应和阳极反应对电池进行充电.下列叙述错误的是( )
A、充电时电极b是阴极 B、放电时 溶液的 减小 C、放电时 溶液的浓度增大 D、每生成 ,电极a质量理论上增加15. 电池比能量高,在汽车、航天等领域具有良好的应用前景.近年来科学家研究了一种光照充电电池(如图所示).光照时,光催化电极产生电子和空穴 , 驱动阴极反应和阳极反应对电池进行充电.下列叙述错误的是( ) A、充电时,电池的总反应 B、充电效率与光照产生的电子和空穴量有关 C、放电时,从正极穿过离子交换膜向负极迁移 D、放电时,正极发生反应16. 关于反应4CO2+SiH44CO+2H2O+SiO2 , 下列说法正确的是( )A、CO是氧化产物 B、SiH4发生还原反应 C、氧化剂与还原剂的物质的量之比为1∶4 D、生成1molSiO2时,转移8mol电子17. 相关有机物分别与氢气发生加成反应生成1mol环己烷(
A、充电时,电池的总反应 B、充电效率与光照产生的电子和空穴量有关 C、放电时,从正极穿过离子交换膜向负极迁移 D、放电时,正极发生反应16. 关于反应4CO2+SiH44CO+2H2O+SiO2 , 下列说法正确的是( )A、CO是氧化产物 B、SiH4发生还原反应 C、氧化剂与还原剂的物质的量之比为1∶4 D、生成1molSiO2时,转移8mol电子17. 相关有机物分别与氢气发生加成反应生成1mol环己烷( )的能量变化如图所示:
)的能量变化如图所示:
下列推理不正确的是( )
A、2ΔH1≈ΔH2 , 说明碳碳双键加氢放出的热量与分子内碳碳双键数目成正比 B、ΔH2<ΔH3 , 说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定 C、3ΔH1<ΔH4 , 说明苯分子中不存在三个完全独立的碳碳双键 D、ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性18. pH计是一种采用原电池原理测量溶液pH的仪器。如图所示,以玻璃电极(在特制玻璃薄膜球内放置已知浓度的HCl溶液,并插入Ag—AgCl电极)和另一Ag—AgCl电极插入待测溶液中组成电池,pH与电池的电动势E存在关系:pH=(E-常数)/0.059。下列说法正确的是( )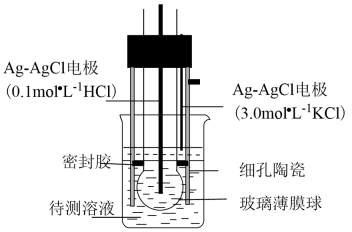 A、如果玻璃薄膜球内电极的电势低,则该电极反应式为:AgCl(s)+e-=Ag(s)+Cl(0.1mol·L-1) B、玻璃膜内外氢离子浓度的差异不会引起电动势的变化 C、分别测定含已知pH的标准溶液和未知溶液的电池的电动势,可得出未知溶液的pH D、pH计工作时,电能转化为化学能19. 下列说法正确的是( )A、铁与碘反应易生成碘化铁 B、电解ZnSO4溶液可以得到Zn C、用石灰沉淀富镁海水中的Mg2+ , 生成碳酸镁 D、SO2通入BaCl2溶液中生成BaSO3沉淀20. 实验室制备过程为:①高温下在熔融强碱性介质中用氧化制备;②水溶后冷却,调溶液至弱碱性,歧化生成和;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得。下列说法正确的是( )A、①中用瓷坩埚作反应器 B、①中用作强碱性介质 C、②中只体现氧化性 D、转化为的理论转化率约为66.7%21. 下列说法正确的是( )A、工业上通过电解六水合氯化镁制取金属镁 B、接触法制硫酸时,煅烧黄铁矿以得到三氧化硫 C、浓硝酸与铁在常温下不反应,所以可用铁质容器贮运浓硝酸 D、“洁厕灵”(主要成分为盐酸)和“84消毒液”(主要成分为次氯酸钠)不能混用
A、如果玻璃薄膜球内电极的电势低,则该电极反应式为:AgCl(s)+e-=Ag(s)+Cl(0.1mol·L-1) B、玻璃膜内外氢离子浓度的差异不会引起电动势的变化 C、分别测定含已知pH的标准溶液和未知溶液的电池的电动势,可得出未知溶液的pH D、pH计工作时,电能转化为化学能19. 下列说法正确的是( )A、铁与碘反应易生成碘化铁 B、电解ZnSO4溶液可以得到Zn C、用石灰沉淀富镁海水中的Mg2+ , 生成碳酸镁 D、SO2通入BaCl2溶液中生成BaSO3沉淀20. 实验室制备过程为:①高温下在熔融强碱性介质中用氧化制备;②水溶后冷却,调溶液至弱碱性,歧化生成和;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得。下列说法正确的是( )A、①中用瓷坩埚作反应器 B、①中用作强碱性介质 C、②中只体现氧化性 D、转化为的理论转化率约为66.7%21. 下列说法正确的是( )A、工业上通过电解六水合氯化镁制取金属镁 B、接触法制硫酸时,煅烧黄铁矿以得到三氧化硫 C、浓硝酸与铁在常温下不反应,所以可用铁质容器贮运浓硝酸 D、“洁厕灵”(主要成分为盐酸)和“84消毒液”(主要成分为次氯酸钠)不能混用二、非选择题
-
22. 某空间站的生命保障系统功能之一是实现氧循环,其中涉及反应:
回答问题:
(1)、已知:电解液态水制备 , 电解反应的。由此计算的燃烧热(焓)。(2)、已知:的平衡常数(K)与反应温度(t)之间的关系如图1所示。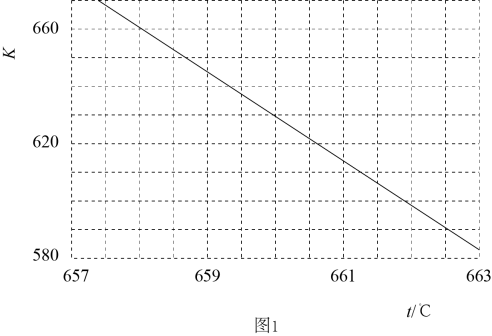
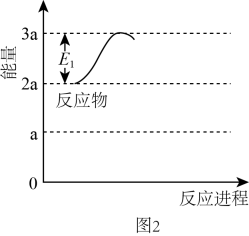
①若反应为基元反应,且反应的与活化能(Ea)的关系为。补充完成该反应过程的能量变化示意图(图2)。
②某研究小组模拟该反应,温度t下,向容积为10L的抽空的密闭容器中通入和 , 反应平衡后测得容器中。则的转化率为 , 反应温度t约为℃。
(3)、在相同条件下,与还会发生不利于氧循环的副反应: , 在反应器中按通入反应物,在不同温度、不同催化剂条件下,反应进行到2min时,测得反应器中、浓度()如下表所示。催化剂
t=350℃
t=400℃
催化剂Ⅰ
10.8
12722
345.2
42780
催化剂Ⅱ
9.2
10775
34
38932
在选择使用催化剂Ⅰ和350℃条件下反应,生成的平均反应速率为;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400℃的反应条件,原因是。
23. 利用丁内酯(BL)制备1,4-丁二醇(BD),反应过程中伴有生成四氢呋喃(THF)和丁醇(BuOH)的副反应,涉及反应如下: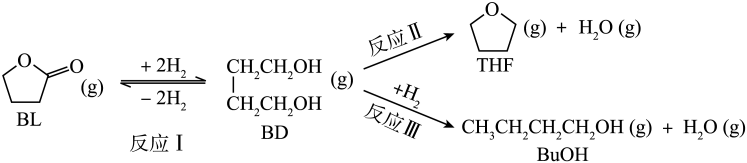
已知:①反应Ⅰ为快速平衡,可认为不受慢反应Ⅱ、Ⅲ的影响;②因反应Ⅰ在高压氛围下进行,故压强近似等于总压。回答下列问题:
(1)、以或BD为初始原料,在、的高压氛围下,分别在恒压容器中进行反应。达平衡时,以BL为原料,体系向环境放热;以BD为原料,体系从环境吸热。忽略副反应热效应,反应Ⅰ焓变。(2)、初始条件同上。表示某物种i的物质的量与除外其它各物种总物质的量之比,和随时间t变化关系如图甲所示。实验测得 , 则图中表示变化的曲线是;反应Ⅰ平衡常数(保留两位有效数字)。以BL为原料时,时刻 , BD产率=(保留两位有效数字)。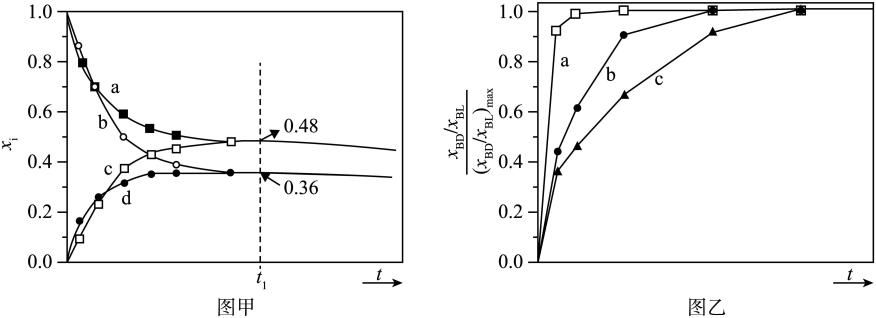 (3)、为达平衡时与的比值。、、三种条件下,以为初始原料,在相同体积的刚性容器中发生反应,随时间t变化关系如图乙所示。因反应在高压氛围下进行,可忽略压强对反应速率的影响。曲线a、b、c中,最大的是(填代号);与曲线b相比,曲线c达到所需时间更长,原因是。24. 主要成分为的工业废气的回收利用有重要意义。(1)、回收单质硫。将三分之一的燃烧,产生的与其余混合后反应:
(3)、为达平衡时与的比值。、、三种条件下,以为初始原料,在相同体积的刚性容器中发生反应,随时间t变化关系如图乙所示。因反应在高压氛围下进行,可忽略压强对反应速率的影响。曲线a、b、c中,最大的是(填代号);与曲线b相比,曲线c达到所需时间更长,原因是。24. 主要成分为的工业废气的回收利用有重要意义。(1)、回收单质硫。将三分之一的燃烧,产生的与其余混合后反应:在某温度下达到平衡,测得密闭系统中各组分浓度分别为、、 , 计算该温度下的平衡常数K=。
(2)、热解制。根据文献,将和的混合气体导入石英管反应器热解(一边进料,另一边出料),发生如下反应:Ⅰ
Ⅱ
总反应:
Ⅲ
投料按体积之比 , 并用稀释;常压、不同温度下反应相同时间后,测得和的体积分数如下表:
温度/
950
1000
1050
1100
1150
0.5
1.5
3.6
5.5
8.5
0.0
0.0
0.1
0.4
1.8
请回答:
①反应Ⅲ能自发进行的条件是。
②下列说法正确的是。
A.其他条件不变时,用替代作稀释气体,对实验结果几乎无影响
B.其他条件不变时,温度越高,的转化率越高
C.由实验数据推出中的键强于中的键
D.恒温恒压下,增加的体积分数,的浓度升高
③若将反应Ⅲ看成由反应Ⅰ和反应Ⅱ两步进行,画出由反应原料经两步生成产物的反应过程能量示意图。

④在、常压下,保持通入的体积分数不变,提高投料比 , 的转化率不变,原因是。
⑤在范围内(其他条件不变),的体积分数随温度升高发生变化,写出该变化规律并分析原因。
25. 2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。回答下列问题:(1)、在一定温度下,向体积固定的密闭容器中加入足量的 和 ,起始压强为 时,发生下列反应生成水煤气:Ⅰ.
Ⅱ.
①下列说法正确的是;
A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时 的体积分数可能大于
D.将炭块粉碎,可加快反应速率
②反应平衡时, 的转化率为 , 的物质的量为 。此时,整个体系(填“吸收”或“放出”)热量 ,反应Ⅰ的平衡常数 (以分压表示,分压=总压×物质的量分数)。
(2)、一种脱除和利用水煤气中 方法的示意图如下:
①某温度下,吸收塔中 溶液吸收一定量的 后, ,则该溶液的 (该温度下 的 );
②再生塔中产生 的离子方程式为;
③利用电化学原理,将 电催化还原为 ,阴极反应式为。
26. 钛( )及其合金是理想的高强度、低密度结构材料。以钛渣(主要成分为 ,含少量V、 和 的氧化物杂质)为原料,制备金属钛的工艺流程如下:
已知“降温收尘”后,粗 中含有的几种物质的沸点:
物质
沸点/
136
127
57
180
回答下列问题:
(1)、已知 , 的值只决定于反应体系的始态和终态,忽略 、 随温度的变化。若 ,则该反应可以自发进行。根据下图判断: 时,下列反应不能自发进行的是______________。 A、 B、 C、 D、(2)、 与C、 在 的沸腾炉中充分反应后,混合气体中各组分的分压如下表:
A、 B、 C、 D、(2)、 与C、 在 的沸腾炉中充分反应后,混合气体中各组分的分压如下表:物质
分压/
①该温度下, 与C、 反应的总化学方程式为;
②随着温度升高,尾气中 的含量升高,原因是。
(3)、“除钒”过程中的化学方程式为;“除硅、铝”过程中,分离 中含 、 杂质的方法是。(4)、“除钒”和“除硅、铝”的顺序(填“能”或“不能”)交换,理由是。(5)、下列金属冶炼方法与本工艺流程中加入 冶炼 的方法相似的是______________。A、高炉炼铁 B、电解熔融氯化钠制钠 C、铝热反应制锰 D、氧化汞分解制汞27. 稀土( )包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下: 
已知:月桂酸 熔点为 ;月桂酸和 均难溶于水。该工艺条件下,稀土离子保持 价不变; 的 ; 开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子
开始沉淀时的pH
8.8
1.5
3.6
6.2~7.4
沉淀完全时的pH
/
3.2
4.7
/
(1)、“氧化调pH”中,化合价有变化的金属离子是。(2)、“过滤1”前,用 溶液调pH至的范围内,该过程中 发生反应的离子方程式为。(3)、“过滤2”后,滤饼中检测不到 元素,滤液2中 浓度为 。为尽可能多地提取 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中 低于 (保留两位有效数字)。(4)、①“加热搅拌”有利于加快 溶出、提高产率,其原因是。②“操作X”的过程为:先 , 再固液分离。
(5)、该工艺中,可再生循环利用的物质有(写化学式)。(6)、稀土元素钇(Y)可用于制备高活性的合金类催化剂 。①还原 和 熔融盐制备 时,生成
 转移 电子。
转移 电子。② 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化 的还原,发生的电极反应为。
28. 铬及其化合物在催化、金属防腐等方面具有重要应用。(1)、催化剂 可由 加热分解制备,反应同时生成无污染气体。①完成化学方程式: 。
② 催化丙烷脱氢过程中,部分反应历程如图1, 过程的焓变为(列式表示)。

③ 可用于 的催化氧化。设计从 出发经过3步反应制备 的路线(用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为。
(2)、 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:(ⅰ)
(ⅱ)
①下列有关 溶液的说法正确的有。
A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量 溶液,反应(ⅰ)的平衡逆向移动
D.加入少量 固体,平衡时 与 的比值保持不变
② 时, 溶液中 随pH的变化关系如图2。当 时,设 、 与 的平衡浓度分别为x、y、z ,则x、y、z之间的关系式为 ;计算溶液中 的平衡浓度(写出计算过程,结果保留两位有效数字)。

③在稀溶液中,一种物质对光的吸收程度(A)与其所吸收光的波长( )有关;在一定波长范围内,最大A对应的波长( )取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究pH对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、 不同的 稀溶液,测得其A随 的变化曲线如图3。波长 、 和 中,与 的 最接近的是;溶液 从a变到b的过程中, 的值(填“增大”“减小”或“不变”)。
29. 油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:(1)、已知下列反应的热化学方程式:①
②
③
计算热分解反应④的。
(2)、较普遍采用的处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解。相比克劳斯工艺,高温热分解方法的优点是 , 缺点是。(3)、在、反应条件下,将的混合气进行热分解反应。平衡时混合气中与的分压相等,平衡转化率为 , 平衡常数。(4)、在、反应条件下,对于分别为、、、、的混合气,热分解反应过程中转化率随时间的变化如下图所示。
①越小,平衡转化率 , 理由是。
②对应图中曲线 , 计算其在之间,分压的平均变化率为。
30. 工业上,以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足不同需求的原料气。请回答:(1)、在C和O2的反应体系中:反应1:C(s)+O2(g)=CO2(g) ΔH1=-394kJ·mol-1
反应2:2CO(g)+O2(g)=2CO2(g) ΔH2=-566kJ·mol-1
反应3:2C(s)+O2(g)=2CO(g) ΔH3。
① 设y=ΔH-TΔS,反应1、2和3的y随温度的变化关系如图1所示。图中对应于反应3的线条是。
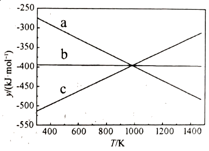
②一定压强下,随着温度的升高,气体中CO与CO2的物质的量之比。
A.不变 B.增大 C.减小 D.无法判断
(2)、水煤气反应:C(s)+H2O(g)=CO(g)+H2(g) ΔH=131kJ·mol-1。工业生产水煤气时,通常交替通入合适量的空气和水蒸气与煤炭反应,其理由是。(3)、一氧化碳变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41kJ·mol-1。①一定温度下,反应后测得各组分的平衡压强(即组分的物质的量分数×总压):p(CO)=0.25MPa、p(H2O)=0.25MPa、p(CO2)=0.75MPa和p(H2)=0.75MPa,则反应的平衡常数K的数值为。
②维持与题①相同的温度和总压,提高水蒸气的比例,使CO的平衡转化率提高到90%,则原料气中水蒸气和CO的物质的量之比为。
③生产过程中,为了提高变换反应的速率,下列措施中合适的是。
A.反应温度愈高愈好 B.适当提高反应物压强
C.选择合适的催化剂 D.通入一定量的氮气
④以固体催化剂M催化变换反应,若水蒸气分子首先被催化剂的活性表面吸附而解离,能量-反应过程如图2所示。
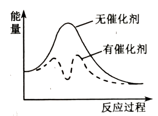
用两个化学方程式表示该催化反应历程(反应机理):步骤Ⅰ:;步骤Ⅱ:。