近三年高考化学真题分类汇编:化学反应与能量(2023年)
试卷更新日期:2023-07-24 类型:二轮复习
一、选择题
-
1. 下列有关电极方程式或离子方程式错误的是A、碱性锌锰电池的正极反应:MnO2+H2O+e-=MnO(OH)+OH- B、铅酸蓄电池充电时的阳极反应:Pb2++2H2O-2e-=PbO2+4H+ C、K3[Fe(CN)6]溶液滴入FeCl2溶液中:K++Fe2++[Fe(CN)6]3-=KFe[Fe(CN)6]↓ D、TiCl4加入水中:TiCl4+(x+2)H2O=TiO2·xH2O↓+4H++4Cl-2. 油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄褪色的主要原因是发生了以下两种化学反应:

下列说法正确的是
A、和的空间结构都是正四面体形 B、反应Ⅰ和Ⅱ中,元素和S都被氧化 C、反应Ⅰ和Ⅱ中,参加反应的:Ⅰ<Ⅱ D、反应Ⅰ和Ⅱ中,氧化转移的电子数之比为3∶73. 葡萄糖酸钙是一种重要的补钙剂,工业上以葡萄糖、碳酸钙为原料,在溴化钠溶液中采用间接电氧化反应制备葡萄糖酸钙,其阳极区反应过程如下:
下列说法错误的是
A、溴化钠起催化和导电作用 B、每生成葡萄糖酸钙,理论上电路中转移了电子 C、葡萄糖酸能通过分子内反应生成含有六元环状结构的产物 D、葡萄糖能发生氧化、还原、取代、加成和消去反应4. 某无隔膜流动海水电解法制的装置如下图所示,其中高选择性催化剂可抑制产生。下列说法正确的是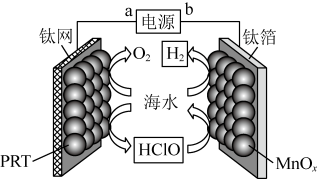 A、b端电势高于a端电势 B、理论上转移生成 C、电解后海水下降 D、阳极发生:5. 某工厂采用如下工艺制备 , 已知焙烧后元素以价形式存在,下列说法错误的是
A、b端电势高于a端电势 B、理论上转移生成 C、电解后海水下降 D、阳极发生:5. 某工厂采用如下工艺制备 , 已知焙烧后元素以价形式存在,下列说法错误的是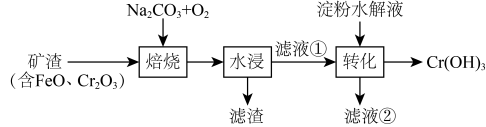 A、“焙烧”中产生 B、滤渣的主要成分为 C、滤液①中元素的主要存在形式为 D、淀粉水解液中的葡萄糖起还原作用6. 某低成本储能电池原理如下图所示。下列说法正确的是
A、“焙烧”中产生 B、滤渣的主要成分为 C、滤液①中元素的主要存在形式为 D、淀粉水解液中的葡萄糖起还原作用6. 某低成本储能电池原理如下图所示。下列说法正确的是 A、放电时负极质量减小 B、储能过程中电能转变为化学能 C、放电时右侧通过质子交换膜移向左侧 D、充电总反应:7. 一定条件下,酸性溶液与发生反应,(Ⅱ)起催化作用,过程中不同价态含粒子的浓度随时间变化如下图所示。下列说法正确的是
A、放电时负极质量减小 B、储能过程中电能转变为化学能 C、放电时右侧通过质子交换膜移向左侧 D、充电总反应:7. 一定条件下,酸性溶液与发生反应,(Ⅱ)起催化作用,过程中不同价态含粒子的浓度随时间变化如下图所示。下列说法正确的是 A、(Ⅲ)不能氧化 B、随着反应物浓度的减小,反应速率逐渐减小 C、该条件下,(Ⅱ)和(Ⅶ)不能大量共存 D、总反应为:8. 科技是第一生产力,我国科学家在诸多领域取得新突破,下列说法错误的是A、利用CO2合成了脂肪酸:实现了无机小分子向有机高分子的转变 B、发现了月壤中的“嫦娥石[(Ca8Y)Fe(PO4)7]”:其成分属于无机盐 C、研制了高效率钙钛矿太阳能电池,其能量转化形式:太阳能→电能 D、革新了海水原位电解制氢工艺:其关键材料多孔聚四氟乙烯耐腐蚀9. 2023年5月10日,天舟六号货运飞船成功发射,标志着我国航天事业进入到高质量发展新阶段。下列不能作为火箭推进剂的是A、液氮-液氢 B、液氧-液氢 C、液态-肼 D、液氧-煤油10. 下列化学事实不符合“事物的双方既相互对立又相互统一”的哲学观点的是A、石灰乳中存在沉淀溶解平衡 B、氯气与强碱反应时既是氧化剂又是还原剂 C、铜锌原电池工作时,正极和负极同时发生反应 D、Li、Na、K的金属性随其核外电子层数增多而增强11. 工业制备高纯硅的主要过程如下:
A、(Ⅲ)不能氧化 B、随着反应物浓度的减小,反应速率逐渐减小 C、该条件下,(Ⅱ)和(Ⅶ)不能大量共存 D、总反应为:8. 科技是第一生产力,我国科学家在诸多领域取得新突破,下列说法错误的是A、利用CO2合成了脂肪酸:实现了无机小分子向有机高分子的转变 B、发现了月壤中的“嫦娥石[(Ca8Y)Fe(PO4)7]”:其成分属于无机盐 C、研制了高效率钙钛矿太阳能电池,其能量转化形式:太阳能→电能 D、革新了海水原位电解制氢工艺:其关键材料多孔聚四氟乙烯耐腐蚀9. 2023年5月10日,天舟六号货运飞船成功发射,标志着我国航天事业进入到高质量发展新阶段。下列不能作为火箭推进剂的是A、液氮-液氢 B、液氧-液氢 C、液态-肼 D、液氧-煤油10. 下列化学事实不符合“事物的双方既相互对立又相互统一”的哲学观点的是A、石灰乳中存在沉淀溶解平衡 B、氯气与强碱反应时既是氧化剂又是还原剂 C、铜锌原电池工作时,正极和负极同时发生反应 D、Li、Na、K的金属性随其核外电子层数增多而增强11. 工业制备高纯硅的主要过程如下:石英砂粗硅高纯硅
下列说法错误的是
A、制备粗硅的反应方程式为 B、1molSi含Si-Si键的数目约为 C、原料气HCl和应充分去除水和氧气 D、生成的反应为熵减过程12. 我国科学家设计如图所示的电解池,实现了海水直接制备氢气技术的绿色化。该装置工作时阳极无生成且KOH溶液的浓度不变,电解生成氢气的速率为。下列说法错误的是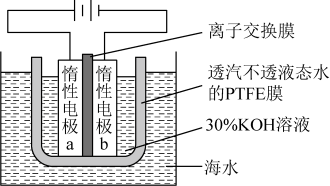 A、b电极反应式为 B、离子交换膜为阴离子交换膜 C、电解时海水中动能高的水分子可穿过PTFE膜 D、海水为电解池补水的速率为13. 室温钠-硫电池被认为是一种成本低、比能量高的能源存储系统。一种室温钠-硫电池的结构如图所示。将钠箔置于聚苯并咪唑膜上作为一个电极,表面喷涂有硫黄粉末的炭化纤维素纸作为另一电极。工作时,在硫电极发生反应:S8+e-→S , S+e-→S , 2Na++S+2(1-)e-→Na2Sx
A、b电极反应式为 B、离子交换膜为阴离子交换膜 C、电解时海水中动能高的水分子可穿过PTFE膜 D、海水为电解池补水的速率为13. 室温钠-硫电池被认为是一种成本低、比能量高的能源存储系统。一种室温钠-硫电池的结构如图所示。将钠箔置于聚苯并咪唑膜上作为一个电极,表面喷涂有硫黄粉末的炭化纤维素纸作为另一电极。工作时,在硫电极发生反应:S8+e-→S , S+e-→S , 2Na++S+2(1-)e-→Na2Sx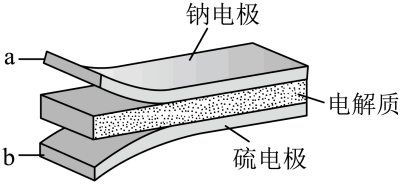
下列叙述错误的是
A、充电时Na+从钠电极向硫电极迁移 B、放电时外电路电子流动的方向是a→b C、放电时正极反应为:2Na++S8+2e-→Na2Sx D、炭化纤维素纸的作用是增强硫电极导电性能14. 下列应用中涉及到氧化还原反应的是A、使用明矾对水进行净化 B、雪天道路上撒盐融雪 C、暖贴中的铁粉遇空气放热 D、荧光指示牌被照发光15. 一些化学试剂久置后易发生化学变化。下列化学方程式可正确解释相应变化的是A
硫酸亚铁溶液出现棕黄色沉淀
B
硫化钠溶液出现浑浊颜色变深
C
溴水颜色逐渐褪去
D
胆矾表面出现白色粉末
A、A B、B C、C D、D16. “肼合成酶”以其中的配合物为催化中心,可将与转化为肼(),其反应历程如下所示。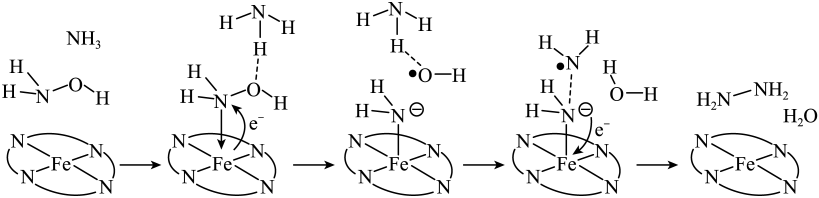
下列说法错误的是
A、、和均为极性分子 B、反应涉及、键断裂和键生成 C、催化中心的被氧化为 , 后又被还原为 D、将替换为 , 反应可得17. 一种以和为电极、水溶液为电解质的电池,其示意图如下所示。放电时,可插入层间形成。下列说法错误的是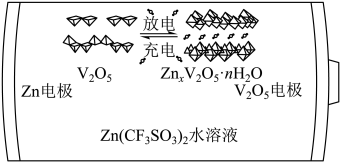 A、放电时为正极 B、放电时由负极向正极迁移 C、充电总反应: D、充电阳极反应:18. 根据实验操作及现象,下列结论中正确的是
A、放电时为正极 B、放电时由负极向正极迁移 C、充电总反应: D、充电阳极反应:18. 根据实验操作及现象,下列结论中正确的是选项
实验操作及现象
结论
常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象
稀硝酸的氧化性比浓硝酸强
取一定量样品,溶解后加入溶液,产生白色沉淀。加入浓 , 仍有沉淀
此样品中含有
将银和溶液与铜和溶液组成原电池。连通后银表面有银白色金属沉积,铜电极附近溶液逐渐变蓝
的金属性比强
向溴水中加入苯,振荡后静置,水层颜色变浅
溴与苯发生了加成反应
A、A B、B C、C D、D19. 用可再生能源电还原时,采用高浓度的抑制酸性电解液中的析氢反应来提高多碳产物(乙烯、乙醇等)的生成率,装置如下图所示。下列说法正确的是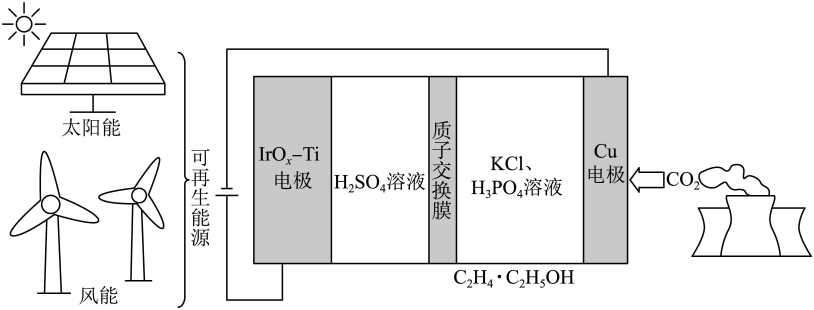 A、析氢反应发生在电极上 B、从电极迁移到电极 C、阴极发生的反应有: D、每转移电子,阳极生成气体(标准状况)20. 在熔融盐体系中,通过电解和获得电池材料 , 电解装置如图,下列说法正确的是
A、析氢反应发生在电极上 B、从电极迁移到电极 C、阴极发生的反应有: D、每转移电子,阳极生成气体(标准状况)20. 在熔融盐体系中,通过电解和获得电池材料 , 电解装置如图,下列说法正确的是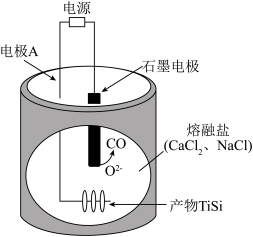 A、石墨电极为阴极,发生氧化反应 B、电极A的电极反应: C、该体系中,石墨优先于参与反应 D、电解时,阳离子向石墨电极移动21. 关于反应 , 下列说法正确的是A、生成 , 转移电子 B、是还原产物 C、既是氧化剂又是还原剂 D、若设计成原电池,为负极产物
A、石墨电极为阴极,发生氧化反应 B、电极A的电极反应: C、该体系中,石墨优先于参与反应 D、电解时,阳离子向石墨电极移动21. 关于反应 , 下列说法正确的是A、生成 , 转移电子 B、是还原产物 C、既是氧化剂又是还原剂 D、若设计成原电池,为负极产物二、非选择题
-
22. 聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。(1)、Ⅰ.苯乙烯的制备
已知下列反应的热化学方程式:①
②
③
计算反应④的;
(2)、在某温度、下,向反应器中充入气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入水蒸气作为稀释气(计算时忽略副反应);(3)、在、下,以水蒸气作稀释气。作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:⑤
⑥
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S()随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是 , 理由是;
 (4)、关于本反应体系中催化剂的描述错误的是____;A、X射线衍射技术可测定晶体结构 B、可改变乙苯平衡转化率 C、降低了乙苯脱氢反应的活化能 D、改变颗粒大小不影响反应速率(5)、Ⅱ.苯乙烯的聚合
(4)、关于本反应体系中催化剂的描述错误的是____;A、X射线衍射技术可测定晶体结构 B、可改变乙苯平衡转化率 C、降低了乙苯脱氢反应的活化能 D、改变颗粒大小不影响反应速率(5)、Ⅱ.苯乙烯的聚合苯乙烯聚合有多种方法,其中一种方法的关键步骤是某(Ⅰ)的配合物促进(引发剂,X表示卤素)生成自由基 , 实现苯乙烯可控聚合。
引发剂中活性最高的是;(6)、室温下,①在配体L的水溶液中形成 , 其反应平衡常数为K;②在水中的溶度积常数为。由此可知,在配体L的水溶液中溶解反应的平衡常数为(所有方程式中计量系数关系均为最简整数比)。23. 超纯是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯方面取得了显著成果,工业上以粗镓为原料,制备超纯的工艺流程如下:
已知:①金属的化学性质和相似,的熔点为;
②(乙醚)和(三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
物质
沸点/
55.7
34.6
42.4
365.8
回答下列问题:
(1)、晶体的晶体类型是;(2)、“电解精炼”装置如图所示,电解池温度控制在的原因是 , 阴极的电极反应式为; (3)、“合成”工序中的产物还包括和 , 写出该反应的化学方程式:;(4)、“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是;(5)、下列说法错误的是____;A、流程中得到了循环利用 B、流程中,“合成”至“工序X”需在无水无氧的条件下进行 C、“工序X”的作用是解配 , 并蒸出 D、用核磁共振氢谱不能区分和(6)、直接分解不能制备超纯 , 而本流程采用“配体交换”工艺制备超纯的理由是;(7)、比较分子中的键角大小:(填“>”“<”或“=”),其原因是。24. 硫酸工业在国民经济中占有重要地位。(1)、我国古籍记载了硫酸的制备方法——“炼石胆(CuSO4·5H2O)取精华法”。借助现代仪器分析,该制备过程中CuSO4·5H2O分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如下图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有SO2、和(填化学式)。
(3)、“合成”工序中的产物还包括和 , 写出该反应的化学方程式:;(4)、“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是;(5)、下列说法错误的是____;A、流程中得到了循环利用 B、流程中,“合成”至“工序X”需在无水无氧的条件下进行 C、“工序X”的作用是解配 , 并蒸出 D、用核磁共振氢谱不能区分和(6)、直接分解不能制备超纯 , 而本流程采用“配体交换”工艺制备超纯的理由是;(7)、比较分子中的键角大小:(填“>”“<”或“=”),其原因是。24. 硫酸工业在国民经济中占有重要地位。(1)、我国古籍记载了硫酸的制备方法——“炼石胆(CuSO4·5H2O)取精华法”。借助现代仪器分析,该制备过程中CuSO4·5H2O分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如下图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有SO2、和(填化学式)。 (2)、铅室法使用了大容积铅室制备硫酸(76%以下),副产物为亚硝基硫酸,主要反应如下:
(2)、铅室法使用了大容积铅室制备硫酸(76%以下),副产物为亚硝基硫酸,主要反应如下:NO2+SO2+H2O=NO+H2SO4
2NO+O2=2NO2
(ⅰ)上述过程中NO2的作用为。
(ⅱ)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是(答出两点即可)。
(3)、接触法制硫酸的关键反应为SO2的催化氧化:SO2(g)+O2(g)SO3(g) ΔH=-98.9kJ·mol-1
(ⅰ)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如下图所示,下列说法正确的是。

a.温度越高,反应速率越大
b.α=0.88的曲线代表平衡转化率
c.α越大,反应速率最大值对应温度越低
d.可根据不同下的最大速率,选择最佳生产温度
(ⅱ)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如下图所示,催化性能最佳的是(填标号)。

(ⅲ)设O2的平衡分压为p,SO2的平衡转化率为αe , 用含p和αe的代数式表示上述催化氧化反应的Kp=(用平衡分压代替平衡浓度计算)。
25. 某工厂采用如下工艺处理镍钴矿硫酸浸取液含(和)。实现镍、钴、镁元素的回收。
已知:
物质
回答下列问题:
(1)、用硫酸浸取镍钴矿时,提高浸取速率的方法为(答出一条即可)。(2)、“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸 , 中过氧键的数目为。(3)、“氧化”中,用石灰乳调节 , 被氧化为 , 该反应的离子方程式为(的电离第一步完全,第二步微弱);滤渣的成分为、(填化学式)。(4)、“氧化”中保持空气通入速率不变,(Ⅱ)氧化率与时间的关系如下。体积分数为时,(Ⅱ)氧化速率最大;继续增大体积分数时,(Ⅱ)氧化速率减小的原因是。 (5)、“沉钴镍”中得到的(Ⅱ)在空气中可被氧化成 , 该反应的化学方程式为。(6)、“沉镁”中为使沉淀完全 , 需控制不低于(精确至0.1)。26. 是生产多晶硅的副产物。利用对废弃的锂电池正极材料进行氯化处理以回收Li、Co等金属,工艺路线如下:
(5)、“沉钴镍”中得到的(Ⅱ)在空气中可被氧化成 , 该反应的化学方程式为。(6)、“沉镁”中为使沉淀完全 , 需控制不低于(精确至0.1)。26. 是生产多晶硅的副产物。利用对废弃的锂电池正极材料进行氯化处理以回收Li、Co等金属,工艺路线如下: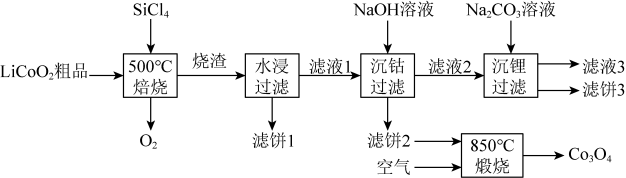
回答下列问题:
(1)、Co位于元素周期表第周期,第族。(2)、烧渣是LiCl、和的混合物,“500℃焙烧”后剩余的应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因。(3)、鉴别洗净的“滤饼3”和固体常用方法的名称是。(4)、已知 , 若“沉钴过滤”的pH控制为10.0,则溶液中浓度为。“850℃煅烧”时的化学方程式为。(5)、导致比易水解的因素有(填标号)。a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
27. 学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:(1)、铜与浓硝酸反应的装置如下图,仪器A的名称为 , 装置B的作用为。 (2)、铜与过量反应的探究如下:
(2)、铜与过量反应的探究如下:
实验②中Cu溶解的离子方程式为;产生的气体为。比较实验①和②,从氧化还原角度说明的作用是。
(3)、用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,提纯干燥后的X在惰性氛围下加热,mgX完全分解为ng黑色氧化物Y,。X的化学式为。(4)、取含X粗品0.0500g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用标准溶液滴定,滴定终点时消耗标准溶液15.00mL。(已知: , )标志滴定终点的现象是 , 粗品中X的相对含量为。28. 纳米碗是一种奇特的碗状共轭体系。高温条件下,可以由分子经过连续5步氢抽提和闭环脱氢反应生成。的反应机理和能量变化如下: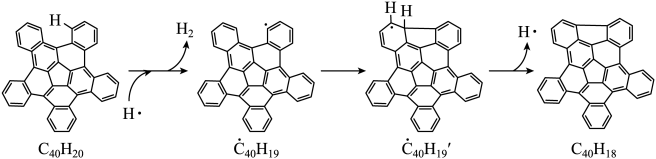
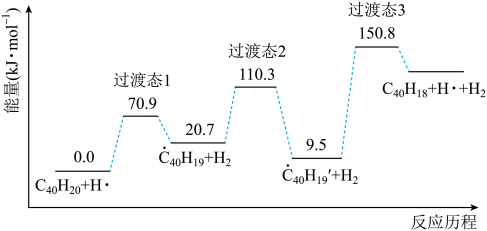
回答下列问题:
(1)、已知中的碳氢键和碳碳键的键能分别为和 , H-H键能为。估算的。(2)、图示历程包含个基元反应,其中速率最慢的是第个。(3)、 纳米碗中五元环和六元环结构的数目分别为、。(4)、1200K时,假定体系内只有反应发生,反应过程中压强恒定为(即的初始压强),平衡转化率为α,该反应的平衡常数为(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(5)、 及反应的(为平衡常数)随温度倒数的关系如图所示。已知本实验条件下,(R为理想气体常数,c为截距)。图中两条线几乎平行,从结构的角度分析其原因是。 (6)、下列措施既能提高反应物的平衡转化率,又能增大生成的反应速率的是(填标号)。
(6)、下列措施既能提高反应物的平衡转化率,又能增大生成的反应速率的是(填标号)。a.升高温度 b.增大压强 c.加入催化剂
29. LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3 , 含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如下: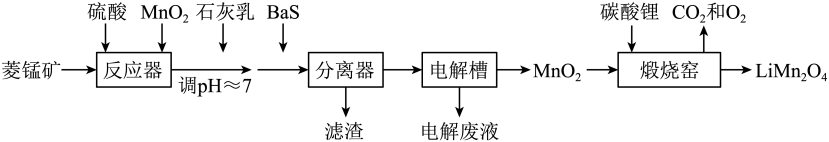
已知:Ksp[Fe(OH)3]=2.8×10-39 , Ksp[Al(OH)3]=1.3×10-33 , Ksp[Ni(OH)2]=5.5×10-16。
回答下列问题:
(1)、硫酸溶矿主要反应的化学方程式为。为提高溶矿速率,可采取的措施(举1例)。(2)、加入少量MnO2的作用是。不宜使用H2O2替代MnO2 , 原因是。(3)、溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)=mol·L-1;用石灰乳调节至pH≈7,除去的金属离子是。(4)、加入少量BaS溶液除去Ni2+ , 生成的沉淀有。(5)、在电解槽中,发生电解反应的离子方程式为。随着电解反应进行,为保持电解液成分稳定,应不断。电解废液可在反应器中循环利用。(6)、缎烧窑中,生成LiMn2O4反应的化学方程式是。30. 硫酸亚铁在工农业生产中有许多用途,如可用作农药防治小麦黑穗病,制造磁性氧化铁、铁催化剂等。回答下列问题:(1)、在气氛中,的脱水热分解过程如图所示:
根据上述实验结果,可知 , 。
(2)、已知下列热化学方程式:则的。
(3)、将置入抽空的刚性容器中,升高温度发生分解反应:(Ⅰ)。平衡时的关系如下图所示。时,该反应的平衡总压、平衡常数。随反应温度升高而(填“增大”“减小”或“不变”)。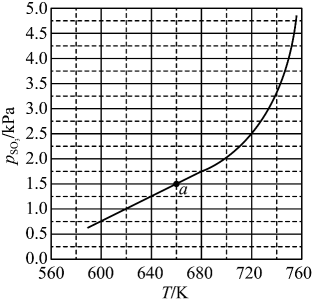 (4)、提高温度,上述容器中进一步发生反应(Ⅱ),平衡时(用表示)。在时, , 则 , (列出计算式)。31. 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:
(4)、提高温度,上述容器中进一步发生反应(Ⅱ),平衡时(用表示)。在时, , 则 , (列出计算式)。31. 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:
已知:最高价铬酸根在酸性介质中以存在,在碱性介质中以存在。
回答下列问题:
(1)、煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为(填化学式)。(2)、水浸渣中主要有和。(3)、“沉淀”步骤调到弱碱性,主要除去的杂质是。(4)、“除硅磷”步骤中,使硅、磷分别以和的形式沉淀,该步需要控制溶液的以达到最好的除杂效果,若时,会导致;时,会导致。(5)、“分离钒”步骤中,将溶液调到1.8左右得到沉淀,在时,溶解为或在碱性条件下,溶解为或 , 上述性质说明具有_______(填标号)。A、酸性 B、碱性 C、两性(6)、“还原”步骤中加入焦亚硫酸钠()溶液,反应的离子方程式为。32. 是一种压电材料。以为原料,采用下列路线可制备粉状。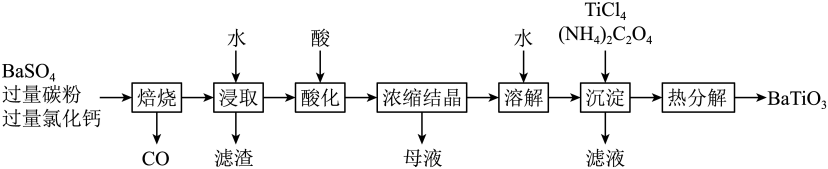
回答下列问题:
(1)、“焙烧”步骤中碳粉的主要作用是。(2)、“焙烧”后固体产物有、易溶于水的和微溶于水的。“浸取”时主要反应的离子方程式为。(3)、“酸化”步骤应选用的酸是(填标号)。a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸
(4)、如果焙烧后的产物直接用酸浸取,是否可行? , 其原因是。(5)、“沉淀”步骤中生成的化学方程式为。(6)、“热分解”生成粉状钛酸钡,产生的。33. 甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:(1)、已知下列反应的热化学方程式:①
②
反应③的 , 平衡常数(用表示)。
(2)、电喷雾电离等方法得到的(等)与反应可得。与反应能高选择性地生成甲醇。分别在和下(其他反应条件相同)进行反应 , 结果如下图所示。图中的曲线是(填“a”或“b”。、时的转化率为(列出算式)。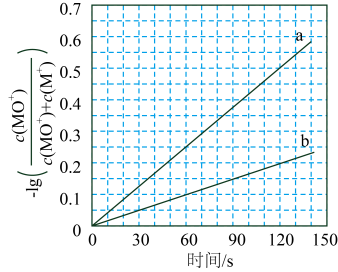 (3)、 分别与反应,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以示例)。
(3)、 分别与反应,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以示例)。
(ⅰ)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是(填“Ⅰ”或“Ⅱ”)。
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则与反应的能量变化应为图中曲线(填“c”或“d”)。
(ⅲ)与反应,氘代甲醇的产量(填“>”“<”或“=”)。若与反应,生成的氘代甲醇有种。
34. “碳达峰·碳中和”是我国社会发展重大战略之一,还原是实现“双碳”经济的有效途径之一,相关的主要反应有:Ⅰ:
Ⅱ:
请回答:
(1)、有利于提高平衡转化率的条件是。A.低温低压B.低温高压C.高温低压D.高温高压
(2)、反应的 , (用表示)。(3)、恒压、时,和按物质的量之比投料,反应经如下流程(主要产物已标出)可实现高效转化。
①下列说法正确的是。
A.可循环利用,不可循环利用
B.过程ⅱ,吸收可促使氧化的平衡正移
C.过程ⅱ产生的最终未被吸收,在过程ⅲ被排出
D.相比于反应Ⅰ,该流程的总反应还原需吸收的能量更多
②过程ⅱ平衡后通入 , 测得一段时间内物质的量上升,根据过程ⅲ,结合平衡移动原理,解释物质的量上升的原因。
(4)、还原能力可衡量转化效率,(同一时段内与的物质的量变化量之比)。①常压下和按物质的量之比投料,某一时段内和的转化率随温度变化如图1,请在图2中画出间R的变化趋势,并标明时R值。

②催化剂X可提高R值,另一时段内转化率、R值随温度变化如下表:
温度/℃
480
500
520
550
转化率/%
7.9
11.5
20.2
34.8
R
2.6
2.4
2.1
1.8
下列说法错误的是
A.R值提高是由于催化剂X选择性地提高反应Ⅱ的速率
B.温度越低,含氢产物中占比越高
C.温度升高,转化率增加,转化率降低,R值减小
D.改变催化剂提高转化率,R值不一定增大