近三年高考化学真题分类汇编:元素周期律
试卷更新日期:2023-07-24 类型:二轮复习
一、选择题
-
1. 日光灯中用到的某种荧光粉的主要成分为3W3(ZX4)2·WY2。已知:X、Y、Z和W为原子序数依次增大的前20号元素,W为金属元素。基态X原子s轨道上的电子数和p轨道上的电子数相等,基态X、Y、Z原子的未成对电子数之比为2:1:3。下列说法正确的是A、电负性:X>Y>Z>W B、原子半径:X<Y<Z<W C、Y和W的单质都能与水反应生成气体 D、Z元素最高价氧化物对应的水化物具有强氧化性2. W、X、Y、Z为原子序数依次增加的同一短周期元素,其中X、Y、Z相邻,W的核外电子数与X的价层电子数相等,是氧化性最强的单质,4种元素可形成离子化合物。下列说法正确的是A、分子的极性: B、第一电离能:X<Y<Z C、氧化性: D、键能:3. 一种矿物由短周期元素W、X、Y组成,溶于稀盐酸有无色无味气体生成。W、X、Y原子序数依次增大。简单离子与具有相同的电子结构。下列叙述正确的是A、X的常见化合价有、 B、原子半径大小为 C、YX的水合物具有两性 D、W单质只有4种同素异形体4. W、X、Y、Z为短周期主族元素,原子序数依次增大,最外层电子数之和为19。Y的最外层电子数与其K层电子数相等,WX2是形成酸雨的物质之一。下列说法正确的是A、原子半径: B、简单氢化物的沸点: C、与可形成离子化合物 D、的最高价含氧酸是弱酸5. 硫酸铜应用广泛,下列说法错误的是A、元素位于周期表p区 B、硫酸铜属于强电解质 C、硫酸铜溶液呈酸性 D、硫酸铜能使蛋白质变性6. X、Y、Z、M、Q五种短周期元素,原子序数依次增大。X的轨道全充满,Y的s能级电子数量是p能级的两倍,M是地壳中含量最多的元素,Q是纯碱中的一种元素。下列说法错误的是A、电负性: B、最高正价: C、Q与M的化合物中可能含有非极性共价键 D、最高价氧化物对应水化物的酸性:7. 短周期元素X、Y、Z、W、Q原子序数依次增大。基态X、Z、Q原子均有两个单电子,W简单离子在同周期离子中半径最小,Q与Z同主族。下列说法错误的是( )A、X能与多种元素形成共价键 B、简单氢化物沸点: C、第一电离能: D、电负性:8. 工业上电解熔融和冰晶石的混合物可制得铝。下列说法正确的是( )A、半径大小: B、电负性大小: C、电离能大小: D、碱性强弱:9. 下列符号表征或说法正确的是( )A、电离: B、位于元素周期表p区 C、空间结构:平面三角形 D、电子式:
 10. 下列类比或推理合理的是( )
10. 下列类比或推理合理的是( )已知
方法
结论
A
沸点:
类比
沸点:
B
酸性:
类比
酸性:
C
金属性:
推理
氧化性:
D
:
推理
溶解度:
A、A B、B C、C D、D11. 两种化合物的结构如图,其中X、Y、Z、R、Q是原子序数依次增大的五种短周期主族元素,下列说法错误的是( )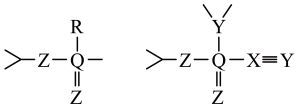 A、在两种化合物中,X、Y、Z、R、Q均满足最外层8电子稳定结构 B、X、Y、Z、R、Q中,R的非金属性及简单氢化物的稳定性均最强 C、将装有YZ2气体的透明密闭容器浸入冰水中,气体颜色变浅 D、Z的某种同素异形体在大气中的含量与环境污染密切相关12. 福建多个科研机构经过长期联合研究发现,使用和改性的基催化剂,可打通从合成气经草酸二甲酯常压催化加氢制备乙二醇的技术难关。下列说法正确的是( )A、草酸属于无机物 B、与石墨互为同分异构体 C、属于过渡元素 D、催化剂通过降低焓变加快反应速率13. 某非线性光学晶体由钾元素(K)和原子序数依次增大的X、Y、Z、W四种短周期元素组成。X与Y、Z与W均为同周期相邻元素,X的核外电子总数为最外层电子数的2倍,Z为地壳中含量最多的元素。下列说法正确的是( )A、简单氢化物沸点: B、分子的空间构型为三角锥形 C、原子半径: D、最高价氧化物对应水化物的碱性:14. R、X、Y、Z均为短周期主族元素,Y与Z同主族且Z的原子序数大于Y。R和X的原子获得1个电子均可形成稀有气体原子的电子层结构,R的最高化合价为+1。1mol化合物RZY3X含58mol电子。下列说法正确的是( )A、R与X形成的化合物水溶液呈碱性 B、X是四种元素中原子半径最大的 C、Y单质的氧化性比Z单质的弱 D、Z的原子最外层电子数为615. 中子轰击X原子的核反应为X+n→Y+H,其中Y可用于测定文物年代。下列说法错误的是( )A、原子半径:Y>X B、YH的电子式为:
A、在两种化合物中,X、Y、Z、R、Q均满足最外层8电子稳定结构 B、X、Y、Z、R、Q中,R的非金属性及简单氢化物的稳定性均最强 C、将装有YZ2气体的透明密闭容器浸入冰水中,气体颜色变浅 D、Z的某种同素异形体在大气中的含量与环境污染密切相关12. 福建多个科研机构经过长期联合研究发现,使用和改性的基催化剂,可打通从合成气经草酸二甲酯常压催化加氢制备乙二醇的技术难关。下列说法正确的是( )A、草酸属于无机物 B、与石墨互为同分异构体 C、属于过渡元素 D、催化剂通过降低焓变加快反应速率13. 某非线性光学晶体由钾元素(K)和原子序数依次增大的X、Y、Z、W四种短周期元素组成。X与Y、Z与W均为同周期相邻元素,X的核外电子总数为最外层电子数的2倍,Z为地壳中含量最多的元素。下列说法正确的是( )A、简单氢化物沸点: B、分子的空间构型为三角锥形 C、原子半径: D、最高价氧化物对应水化物的碱性:14. R、X、Y、Z均为短周期主族元素,Y与Z同主族且Z的原子序数大于Y。R和X的原子获得1个电子均可形成稀有气体原子的电子层结构,R的最高化合价为+1。1mol化合物RZY3X含58mol电子。下列说法正确的是( )A、R与X形成的化合物水溶液呈碱性 B、X是四种元素中原子半径最大的 C、Y单质的氧化性比Z单质的弱 D、Z的原子最外层电子数为615. 中子轰击X原子的核反应为X+n→Y+H,其中Y可用于测定文物年代。下列说法错误的是( )A、原子半径:Y>X B、YH的电子式为: C、最高价含氧酸的酸性:Y>X
D、X与Y均能形成多种氢化物
16. 嫦娥5号月球探测器带回的月壤样品的元素分析结果如图,下列有关含量前六位元素的说法正确的是( )
C、最高价含氧酸的酸性:Y>X
D、X与Y均能形成多种氢化物
16. 嫦娥5号月球探测器带回的月壤样品的元素分析结果如图,下列有关含量前六位元素的说法正确的是( ) A、原子半径:Al<Si B、第一电离能:Mg<Ca C、Fe位于元素周期表的p区 D、这六种元素中,电负性最大的是O17. 金属Na溶解于液氨中形成氨合钠离子和氨合电子,向该溶液中加入穴醚类配体L,得到首个含碱金属阴离子的金黄色化合物[NaL]+Na-。下列说法错误的是( )A、Na-的半径比F-的大 B、Na-的还原性比Na的强 C、Na-的第一电离能比H-的大 D、该事实说明Na也可表现出非金属性18. 近年我国在科学技术领域取得了举世瞩目的成就。对下列成就所涉及的化学知识的判断错误的是( )A、北斗三号卫星搭载了精密计时的铷原子钟,铷(Rb)是金属元素 B、奋斗者号潜水器载人舱外壳使用了钛合金,钛合金属于无机非金属材料 C、长征五号B遥二火箭把天和核心舱送入太空,火箭动力源于氧化还原反应 D、天问一号探测器着陆火星过程中使用了芳纶制作的降落伞,芳纶是高分子材料19. 元素X、Y、Z、Q、R的原子序数依次增大且小于20,其原子半径和最外层电子数之间的关系如图所示。下列判断正确的是( )
A、原子半径:Al<Si B、第一电离能:Mg<Ca C、Fe位于元素周期表的p区 D、这六种元素中,电负性最大的是O17. 金属Na溶解于液氨中形成氨合钠离子和氨合电子,向该溶液中加入穴醚类配体L,得到首个含碱金属阴离子的金黄色化合物[NaL]+Na-。下列说法错误的是( )A、Na-的半径比F-的大 B、Na-的还原性比Na的强 C、Na-的第一电离能比H-的大 D、该事实说明Na也可表现出非金属性18. 近年我国在科学技术领域取得了举世瞩目的成就。对下列成就所涉及的化学知识的判断错误的是( )A、北斗三号卫星搭载了精密计时的铷原子钟,铷(Rb)是金属元素 B、奋斗者号潜水器载人舱外壳使用了钛合金,钛合金属于无机非金属材料 C、长征五号B遥二火箭把天和核心舱送入太空,火箭动力源于氧化还原反应 D、天问一号探测器着陆火星过程中使用了芳纶制作的降落伞,芳纶是高分子材料19. 元素X、Y、Z、Q、R的原子序数依次增大且小于20,其原子半径和最外层电子数之间的关系如图所示。下列判断正确的是( )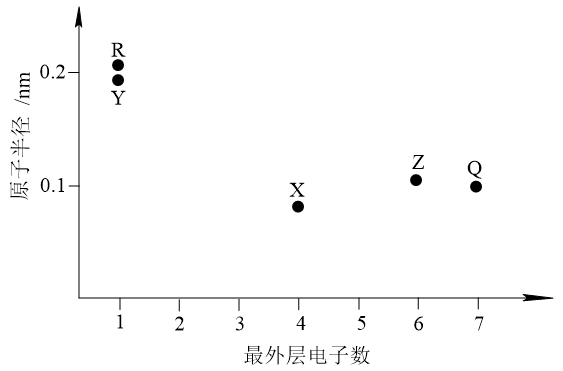 A、X的电负性比Q的大 B、Q的简单离子半径比R的大 C、Z的简单气态氢化物的热稳定性比Q的强 D、Y的最高价氧化物对应的水化物的碱性比R的强20. 某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法正确的是( )
A、X的电负性比Q的大 B、Q的简单离子半径比R的大 C、Z的简单气态氢化物的热稳定性比Q的强 D、Y的最高价氧化物对应的水化物的碱性比R的强20. 某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法正确的是( ) A、氢化物沸点: B、原子半径: C、第一电离能: D、阴、阳离子中均有配位键21. 下列性质的比较,不能用元素周期律解释的是( )A、酸性:HClO4>H2SO3>H2SiO3 B、碱性:KOH>NaOH>LiOH C、热稳定性:H2O>H2S>PH3 D、非金属性:F>O>N22. X、Y均为短周期金属元素,同温同压下,0.1molX的单质与足量稀盐酸反应,生成H2体积为V1L;0.1molY的单质与足量稀硫酸反应,生成H2体积为V2L。下列说法错误的是( )A、X、Y生成H2的物质的量之比一定为 B、X、Y消耗酸的物质的量之比一定为 C、产物中X、Y化合价之比一定为 D、由 一定能确定产物中X、Y的化合价23. X、Y为第三周期元素、Y最高正价与最低负价的代数和为6,二者形成的一种化合物能以[XY4]+[XY6]-的形式存在。下列说法错误的是( )A、原子半径:X>Y B、简单氢化物的还原性:X>Y C、同周期元素形成的单质中Y氧化性最强 D、同周期中第一电离能小于X的元素有4种24. 已知短周期元素X、Y、Z、M、Q和R在周期表中的相对位置如下所示,其中Y的最高化合价为+3。下列说法不正确的是( )
A、氢化物沸点: B、原子半径: C、第一电离能: D、阴、阳离子中均有配位键21. 下列性质的比较,不能用元素周期律解释的是( )A、酸性:HClO4>H2SO3>H2SiO3 B、碱性:KOH>NaOH>LiOH C、热稳定性:H2O>H2S>PH3 D、非金属性:F>O>N22. X、Y均为短周期金属元素,同温同压下,0.1molX的单质与足量稀盐酸反应,生成H2体积为V1L;0.1molY的单质与足量稀硫酸反应,生成H2体积为V2L。下列说法错误的是( )A、X、Y生成H2的物质的量之比一定为 B、X、Y消耗酸的物质的量之比一定为 C、产物中X、Y化合价之比一定为 D、由 一定能确定产物中X、Y的化合价23. X、Y为第三周期元素、Y最高正价与最低负价的代数和为6,二者形成的一种化合物能以[XY4]+[XY6]-的形式存在。下列说法错误的是( )A、原子半径:X>Y B、简单氢化物的还原性:X>Y C、同周期元素形成的单质中Y氧化性最强 D、同周期中第一电离能小于X的元素有4种24. 已知短周期元素X、Y、Z、M、Q和R在周期表中的相对位置如下所示,其中Y的最高化合价为+3。下列说法不正确的是( ) A、还原性: B、X能从 中置换出Z C、Y能与 反应得到Fe D、M最高价氧化物的水化物能与其最低价氢化物反应
A、还原性: B、X能从 中置换出Z C、Y能与 反应得到Fe D、M最高价氧化物的水化物能与其最低价氢化物反应二、多选题
-
25. 某种镁盐具有良好的电化学性能,其阴离子结构如下图所示。W、X、Y、Z、Q是核电荷数依次增大的短周期元素,W、Y原子序数之和等于Z,Y原子价电子数是Q原子价电子数的2倍。下列说法错误的是
 A、W与X的化合物为极性分子 B、第一电离能 C、Q的氧化物是两性氧化物 D、该阴离子中含有配位键26. 短周期主族元素 、 、 、 的原子序数依次增大, 离子与 分子均含有14个电子;习惯上把电解饱和 水溶液的工业生产称为氯碱工业。下列判断正确的是( )A、原子半径: B、最高价氧化物对应的水化物的酸性: C、化合物 的水溶液呈中性 D、 分子中既有 键又有 键27. 下图所示的两种化合物可应用于阻燃材料和生物材料的合成。其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,Y原子序数为W原子价电子数的3倍。下列说法正确的是( )
A、W与X的化合物为极性分子 B、第一电离能 C、Q的氧化物是两性氧化物 D、该阴离子中含有配位键26. 短周期主族元素 、 、 、 的原子序数依次增大, 离子与 分子均含有14个电子;习惯上把电解饱和 水溶液的工业生产称为氯碱工业。下列判断正确的是( )A、原子半径: B、最高价氧化物对应的水化物的酸性: C、化合物 的水溶液呈中性 D、 分子中既有 键又有 键27. 下图所示的两种化合物可应用于阻燃材料和生物材料的合成。其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,Y原子序数为W原子价电子数的3倍。下列说法正确的是( )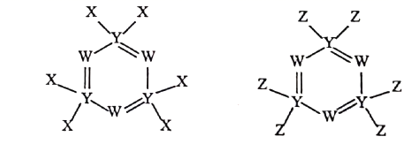 A、X和Z的最高化合价均为+7价 B、HX和HZ在水中均为强酸,电子式可表示为
A、X和Z的最高化合价均为+7价 B、HX和HZ在水中均为强酸,电子式可表示为 与
与 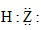 C、四种元素中,Y原子半径最大,X原子半径最小
D、Z、W和氢三种元素可形成同时含有离子键和共价键的化合物
C、四种元素中,Y原子半径最大,X原子半径最小
D、Z、W和氢三种元素可形成同时含有离子键和共价键的化合物
三、非选择题
-
28. 是生产多晶硅的副产物。利用对废弃的锂电池正极材料进行氯化处理以回收Li、Co等金属,工艺路线如下:
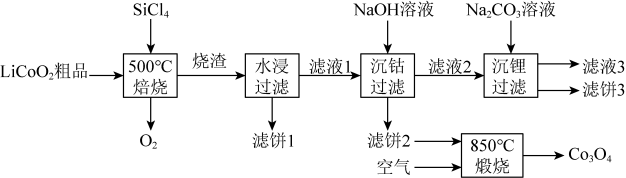
回答下列问题:
(1)、Co位于元素周期表第周期,第族。(2)、烧渣是LiCl、和的混合物,“500℃焙烧”后剩余的应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因。(3)、鉴别洗净的“滤饼3”和固体常用方法的名称是。(4)、已知 , 若“沉钴过滤”的pH控制为10.0,则溶液中浓度为。“850℃煅烧”时的化学方程式为。(5)、导致比易水解的因素有(填标号)。a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
29. 某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。(1)、浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中存在盐酸和MnO2。①反应的离子方程式是。
②电极反应式:
i还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii氧化反应:。
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱.
ii随c(Cl-)降低,。
④补充实验证实了③中的分析。
实验操作
试剂
产物
I
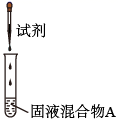
较浓H2SO4
有Cl2
II
a
有Cl2
III
a+b
无Cl2
a是 , b是。
(2)、利用c(H+)浓度对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是 , 从原子结构角度说明理由。(3)、根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是。(4)、Ag分别与1mol·L1的盐酸、氢溴酸、氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:。(5)、总结:物质氧化性和还原性变化的一般规律是。30. 可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以 形式存在,还含有 、 、 、 等物质。以独居石为原料制备 的工艺流程如下: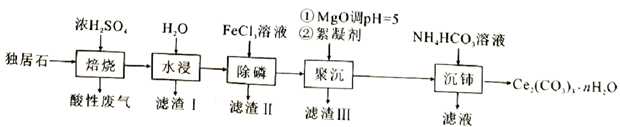
回答下列问题:
(1)、铈的某种核素含有58个质子和80个中子,该核素的符号为;(2)、为提高“水浸”效率,可采取的措施有(至少写两条);(3)、滤渣Ⅲ的主要成分是(填化学式);(4)、加入絮凝剂的目的是;(5)、“沉铈”过程中,生成 的离子方程式为 , 常温下加入的 溶液呈(填“酸性”“碱性”或“中性”)(已知: 的 , 的 , );(6)、滤渣Ⅱ的主要成分为 ,在高温条件下, 、葡萄糖( )和 可制备电极材料 ,同时生成 和 ,该反应的化学方程式为