近三年高考化学真题分类汇编:金属及其化合物
试卷更新日期:2023-07-24 类型:二轮复习
一、选择题
-
1. 取一定体积的两种试剂进行反应,改变两种试剂的滴加顺序(试剂浓度均为),反应现象没有明显差别的是
选项
试剂①
试剂②
A
氨水
溶液
B
溶液
溶液
C
溶液
酸性溶液
D
溶液
溶液
A、A B、B C、C D、D2. 中华文化源远流长,化学与文化传承密不可分。下列说法错误的是A、青铜器“四羊方尊”的主要材质为合金 B、长沙走马楼出土的竹木简牍主要成分是纤维素 C、蔡伦采用碱液蒸煮制浆法造纸,该过程不涉及化学变化 D、铜官窑彩瓷是以黏土为主要原料,经高温烧结而成3. 下列鉴别或检验不能达到实验目的的是A、用石灰水鉴别Na2CO3与NaHCO3 B、用KSCN溶液检验FeSO4是否变质 C、用盐酸酸化的BaCl2溶液检验Na2SO3是否被氧化 D、加热条件下用银氨溶液检验乙醇中是否混有乙醛4. 下列有关物质的工业制备反应错误的是A、合成氨:N2+3H22NH3 B、制HCl:H2+Cl22HCl C、制粗硅:SiO2+2CSi+2CO D、冶炼镁:2MgO(熔融)2Mg+O2↑5. 化学用语可以表达化学过程,下列化学用语的表达错误的是A、用电子式表示的形成: B、用离子方程式表示溶于烧碱溶液:
C、用电子云轮廓图表示H-H的s-sσ键形成的示意图:
B、用离子方程式表示溶于烧碱溶液:
C、用电子云轮廓图表示H-H的s-sσ键形成的示意图: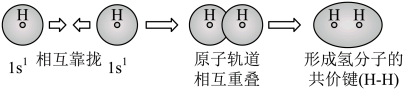 D、用化学方程式表示尿素与甲醛制备线型脲醛树脂:
D、用化学方程式表示尿素与甲醛制备线型脲醛树脂: 6. 化学在文物的研究和修复中有重要作用。下列说法错误的是A、竹简的成分之一纤维素属于天然高分子 B、龟甲的成分之一羟基磷灰石属于无机物 C、古陶瓷修复所用的熟石膏,其成分为Ca(OH)2 D、古壁画颜料中所用的铁红,其成分为Fe2O37. 物质的性质决定用途,下列两者对应关系错误的是A、能使某些色素褪色,可用作漂白剂 B、金属钠导热性好,可用作传热介质 C、溶液呈碱性,可用作消毒剂 D、呈红色,可用作颜料8. 下列关于元素及其化合物的性质说法错误的是A、和乙醇反应可生成 B、工业上煅烧黄铁矿生产 C、工业上用氨的催化氧化制备 D、常温下铁与浓硝酸反应可制备9. 探究铁及其化合物的性质,下列方案设计、现象和结论都正确的是
6. 化学在文物的研究和修复中有重要作用。下列说法错误的是A、竹简的成分之一纤维素属于天然高分子 B、龟甲的成分之一羟基磷灰石属于无机物 C、古陶瓷修复所用的熟石膏,其成分为Ca(OH)2 D、古壁画颜料中所用的铁红,其成分为Fe2O37. 物质的性质决定用途,下列两者对应关系错误的是A、能使某些色素褪色,可用作漂白剂 B、金属钠导热性好,可用作传热介质 C、溶液呈碱性,可用作消毒剂 D、呈红色,可用作颜料8. 下列关于元素及其化合物的性质说法错误的是A、和乙醇反应可生成 B、工业上煅烧黄铁矿生产 C、工业上用氨的催化氧化制备 D、常温下铁与浓硝酸反应可制备9. 探究铁及其化合物的性质,下列方案设计、现象和结论都正确的是实验方案
现象
结论
A
往溶液中加入片
短时间内无明显现象
的氧化能力比弱
B
往溶液中滴加溶液,再加入少量固体
溶液先变成血红色后无明显变化
与的反应不可逆
C
将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加溶液
溶液呈浅绿色
食品脱氧剂样品中没有价铁
D
向沸水中逐滴加5~6滴饱和溶液,持续煮沸
溶液先变成红褐色再析出沉淀
先水解得再聚集成沉淀
A、A B、B C、C D、D10. 下列叙述正确的是( )A、Cl2和Br2分别与Fe2+反应得到Cl-和Br- B、Na和Li分别在O2中燃烧得到Na2O和Li2O C、1molSO3与1molNO2分别通入1L水中可产生相同浓度的H2SO4和HNO3 D、0.1mol•L-1醋酸和0.1mol•L-1硼酸分别加入适量Na2CO3中均可得到CO2和H2O11. 武当山金殿是铜铸鎏金大殿。传统鎏金工艺是将金溶于汞中制成“金汞漆”,涂在器物表面,然后加火除汞,使金附着在器物表面。下列说法错误的是( )A、鎏金工艺利用了汞的挥发性 B、鎏金工艺中金发生了化学反应 C、鎏金工艺的原理可用于金的富集 D、用电化学方法也可实现铜上覆金12. 化学与日常生活息息相关。下列说法错误的是( )A、使用含氟牙膏能预防龋齿 B、小苏打的主要成分是 C、可用食醋除去水垢中的碳酸钙 D、使用食品添加剂不应降低食品本身营养价值13. “乌铜走银”是我国非物质文化遗产之一。该工艺将部分氧化的银丝镶嵌于铜器表面,艺人用手边捂边揉搓铜器,铜表面逐渐变黑,银丝变得银光闪闪。下列叙述错误的是( )A、铜的金属活动性大于银 B、通过揉搓可提供电解质溶液 C、银丝可长时间保持光亮 D、用铝丝代替银丝铜也会变黑14. 某离子液体的阴离子的结构如图所示,其中W、X、Y、Z、M为原子序数依次增大的短周期非金属元素,W是有机分子的骨架元素。下列说法正确的是( )

A、Z元素的最高价态为+7 B、基态原子未成对电子数:W>Y C、该阴离子中X不满足8电子稳定结构 D、最简单氢化物水溶液的pH:X>M15. 下列说法错误的是( )A、纯铁比生铁易生锈 B、臭氧可用于自来水消毒 C、酚醛树脂可用作绝缘、隔热材料 D、高纯硅可用于制芯片16. 《天工开物》中记载:“凡乌金纸由苏、杭造成,其纸用东海巨竹膜为质。用豆油点灯,闭塞周围,只留针孔通气,熏染烟光而成此纸,每纸一张打金箔五十度……”下列说法错误的是( )A、“乌金纸”的“乌”与豆油不完全燃烧有关 B、“巨竹膜”为造纸的原料,主要成分是纤维素 C、豆油的主要成分油脂属于天然高分子化合物 D、打金成箔,说明金具有良好的延展性17. 含S元素的某钠盐a能发生如图转化。下列说法错误的是( )
A、Z元素的最高价态为+7 B、基态原子未成对电子数:W>Y C、该阴离子中X不满足8电子稳定结构 D、最简单氢化物水溶液的pH:X>M15. 下列说法错误的是( )A、纯铁比生铁易生锈 B、臭氧可用于自来水消毒 C、酚醛树脂可用作绝缘、隔热材料 D、高纯硅可用于制芯片16. 《天工开物》中记载:“凡乌金纸由苏、杭造成,其纸用东海巨竹膜为质。用豆油点灯,闭塞周围,只留针孔通气,熏染烟光而成此纸,每纸一张打金箔五十度……”下列说法错误的是( )A、“乌金纸”的“乌”与豆油不完全燃烧有关 B、“巨竹膜”为造纸的原料,主要成分是纤维素 C、豆油的主要成分油脂属于天然高分子化合物 D、打金成箔,说明金具有良好的延展性17. 含S元素的某钠盐a能发生如图转化。下列说法错误的是( )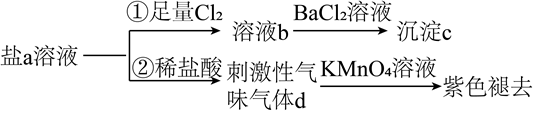 A、a可能为正盐,也可能为酸式盐 B、c为不溶于盐酸的白色沉淀 C、d为含极性键的非极性分子 D、反应②中还可能生成淡黄色沉淀18. 由下列实验操作及现象能得出相应结论的是( )
A、a可能为正盐,也可能为酸式盐 B、c为不溶于盐酸的白色沉淀 C、d为含极性键的非极性分子 D、反应②中还可能生成淡黄色沉淀18. 由下列实验操作及现象能得出相应结论的是( )实验操作
现象
结论
A
向KBr、KI混合溶液中依次加入少量氯水和CCl4 , 振荡,静置
溶液分层,下层呈紫红色
氧化性:
B
在火焰上灼烧搅拌过某无色溶液的玻璃棒
火焰出现黄色
溶液中含Na元素
C
用pH计测定pH:①NaHCO3溶液②CH3COONa溶液
pH:①>②
H2CO3酸性弱于CH3COOH
D
把水滴入盛有少量Na2O2的试管中,立即把带火星木条放在试管口
木条复燃
反应生成了O2
A、A B、B C、C D、D19. Li电池使用过程中会产生LiH,对电池的性能和安全性带来影响。可用D2O与LiH进行反应测定LiH含量,由产物中的n(D2)/n(HD)比例可推算n(Li)/n(LiH)。已知:①2LiH⇌2Li+H2 △H>0
②LiH+H2O=LiOH+H2↑
下列说法错误的是( )
A、H2O、D2O的化学性质基本相同 B、Li与D2O反应的方程式是2Li+2D2O=2LiOD+D2↑ C、n(D2)/n(HD)比例小说明n(Li)/n(LiH)比例大 D、80℃下的n(D2)/n(HD)大于25℃下的n(D2)/n(HD)20. 下列方程式不能准确解释相应实验现象的是( )A、酚酞滴入醋酸钠溶液中变为浅红色:CH3COO-+H2O⇌CH3COOH+OH- B、金属钠在空气中加热生成淡黄色固体:4Na+O2=2Na2O C、铝溶于氢氧化钠溶液,有无色气体产生:2Al+2OH-+2H2O=2 +3H2↑ D、将二氧化硫通入氢硫酸中产生黄色沉淀:SO2+2H2S=3S↓+2H2O二、非选择题
-
21. 金属对有强吸附作用,被广泛用于硝基或羰基等不饱和基团的催化氢化反应,将块状转化成多孔型雷尼后,其催化活性显著提高。
已知:①雷尼暴露在空气中可以自燃,在制备和使用时,需用水或有机溶剂保持其表面“湿润”;
②邻硝基苯胺在极性有机溶剂中更有利于反应的进行。
某实验小组制备雷尼并探究其催化氢化性能的实验如下:
步骤1:雷尼的制备
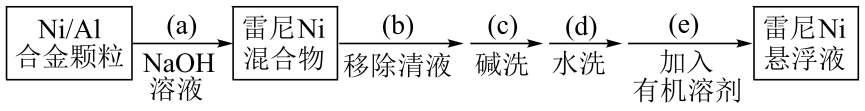
步骤2:邻硝基苯胺的催化氢化反应
反应的原理和实验装置图如下(夹持装置和搅拌装置略)。装置Ⅰ用于储存和监测反应过程。
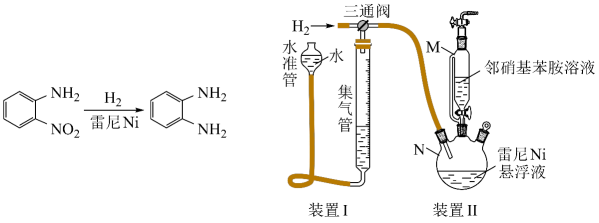
回答下列问题:
(1)、操作(a)中,反应的离子方程式是;(2)、操作(d)中,判断雷尼被水洗净的方法是;(3)、操作(e)中,下列溶剂中最有利于步骤2中氢化反应的是____;A、丙酮 B、四氯化碳 C、乙醇 D、正己烷(4)、向集气管中充入时,三通阀的孔路位置如下图所示:发生氢化反应时,集气管向装置Ⅱ供气,此时孔路位置需调节为; (5)、仪器M的名称是;(6)、反应前应向装置Ⅱ中通入一段时间,目的是;(7)、如果将三颈瓶N中的导气管口插入液面以下,可能导致的后果是;(8)、判断氢化反应完全的现象是。22. 是生产多晶硅的副产物。利用对废弃的锂电池正极材料进行氯化处理以回收Li、Co等金属,工艺路线如下:
(5)、仪器M的名称是;(6)、反应前应向装置Ⅱ中通入一段时间,目的是;(7)、如果将三颈瓶N中的导气管口插入液面以下,可能导致的后果是;(8)、判断氢化反应完全的现象是。22. 是生产多晶硅的副产物。利用对废弃的锂电池正极材料进行氯化处理以回收Li、Co等金属,工艺路线如下: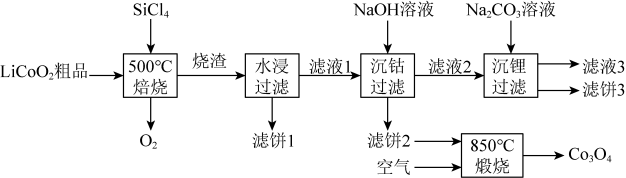
回答下列问题:
(1)、Co位于元素周期表第周期,第族。(2)、烧渣是LiCl、和的混合物,“500℃焙烧”后剩余的应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因。(3)、鉴别洗净的“滤饼3”和固体常用方法的名称是。(4)、已知 , 若“沉钴过滤”的pH控制为10.0,则溶液中浓度为。“850℃煅烧”时的化学方程式为。(5)、导致比易水解的因素有(填标号)。a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
23. 以焙烧黄铁矿(杂质为石英等)产生的红渣为原料制备铵铁蓝颜料。工艺流程如下:
回答下列问题:
(1)、红渣的主要成分为(填化学式),滤渣①的主要成分为(填化学式)。(2)、黄铁矿研细的目的是。(3)、还原工序中,不生成S单质的反应的化学方程式为。(4)、工序①的名称为 , 所得母液循环使用。(5)、沉铁工序产生的白色沉淀中的化合价为 , 氧化工序发生反应的离子方程式为。(6)、若用还原工序得到的滤液制备和 , 所加试剂为和(填化学式,不引入杂质)。24. 化合物X由三种元素组成,某学习小组按如下流程进行实验: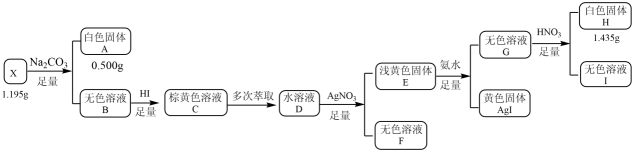
已知:白色固体A用溶解后,多余的酸用恰好中和,请回答:
(1)、X的组成元素是 , X的化学式是。(2)、写出溶液呈棕黄色所发生的化学反应方程式。(3)、写出生成白色固体H的离子方程式。(4)、设计实验检验溶液Ⅰ中的阳离子。25. 氯化铁是重要的化工原料。针对氯化铁的实验室制备方法,回答下列问题:(1)、Ⅰ.的制备制备流程图如下:

将废铁屑分批加入稀盐酸中,至盐酸反应完全。判断反应完全的现象为。含有少量铜的废铁屑比纯铁屑反应快,原因为。
(2)、操作①所必需的玻璃仪器中,除烧杯外还有。(3)、检验溶液中是否残留的试剂是。(4)、为增大溶液的浓度,向稀溶液中加入纯Fe粉后通入。此过程中发生的主要反应的离子方程式为。(5)、操作②为。(6)、Ⅱ.由制备无水将与液体混合并加热,制得无水。已知沸点为77℃,反应方程式为: , 装置如下图所示(夹持和加热装置略)。

仪器A的名称为 , 其作用为。NaOH溶液的作用是。
(7)、干燥管中无水不能换成碱石灰,原因是。(8)、由下列结晶水合物制备无水盐,适宜使用上述方法的是(填序号)。a. b. c.
26. 粉煤灰是火电厂的大宗固废。以某电厂的粉煤灰为原料(主要含和等)提铝的工艺流程如下:
回答下列问题:
(1)、“浸出”时适当升温的主要目的是 , 发生反应的离子方程式为。(2)、“浸渣”的主要成分除残余外,还有。实验测得,粉煤灰(的质量分数为)经浸出、干燥后得到“浸渣”(的质量分数为),的浸出率为。(3)、“沉铝”时,体系中三种物质的溶解度曲线如下图所示,加入沉铝的目的是 , “沉铝”的最佳方案为。 (4)、“焙烧”时,主要反应的化学方程式为。(5)、“水浸”后得到的“滤液2”可返回工序循环使用。27. 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:(1)、基态Na原子的价层电子轨道表示式为。(2)、NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na,电解反应方程式: , 加入的目的是。(3)、的电子式为。在25℃和101kPa时,Na与反应生成1mol 放热510.9kJ,写出该反应的热化学方程式:。(4)、采用空气和Na为原料可直接制备。空气与熔融金属Na反应前需依次通过、(填序号)
(4)、“焙烧”时,主要反应的化学方程式为。(5)、“水浸”后得到的“滤液2”可返回工序循环使用。27. 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:(1)、基态Na原子的价层电子轨道表示式为。(2)、NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na,电解反应方程式: , 加入的目的是。(3)、的电子式为。在25℃和101kPa时,Na与反应生成1mol 放热510.9kJ,写出该反应的热化学方程式:。(4)、采用空气和Na为原料可直接制备。空气与熔融金属Na反应前需依次通过、(填序号)a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.溶液
(5)、钠的某氧化物晶胞如下图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为。 (6)、天然碱的主要成分为 , 1mol 经充分加热得到的质量为g。28. 钛( )及其合金是理想的高强度、低密度结构材料。以钛渣(主要成分为 ,含少量V、 和 的氧化物杂质)为原料,制备金属钛的工艺流程如下:
(6)、天然碱的主要成分为 , 1mol 经充分加热得到的质量为g。28. 钛( )及其合金是理想的高强度、低密度结构材料。以钛渣(主要成分为 ,含少量V、 和 的氧化物杂质)为原料,制备金属钛的工艺流程如下:
已知“降温收尘”后,粗 中含有的几种物质的沸点:
物质
沸点/
136
127
57
180
回答下列问题:
(1)、已知 , 的值只决定于反应体系的始态和终态,忽略 、 随温度的变化。若 ,则该反应可以自发进行。根据下图判断: 时,下列反应不能自发进行的是______________。 A、 B、 C、 D、(2)、 与C、 在 的沸腾炉中充分反应后,混合气体中各组分的分压如下表:
A、 B、 C、 D、(2)、 与C、 在 的沸腾炉中充分反应后,混合气体中各组分的分压如下表:物质
分压/
①该温度下, 与C、 反应的总化学方程式为;
②随着温度升高,尾气中 的含量升高,原因是。
(3)、“除钒”过程中的化学方程式为;“除硅、铝”过程中,分离 中含 、 杂质的方法是。(4)、“除钒”和“除硅、铝”的顺序(填“能”或“不能”)交换,理由是。(5)、下列金属冶炼方法与本工艺流程中加入 冶炼 的方法相似的是______________。A、高炉炼铁 B、电解熔融氯化钠制钠 C、铝热反应制锰 D、氧化汞分解制汞29. 化合物X由4种元素组成。某兴趣小组按如图流程进行实验: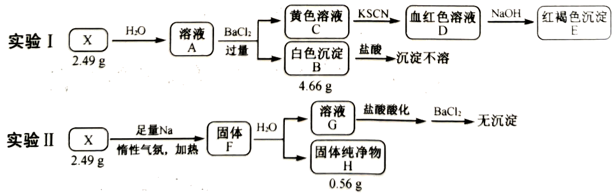
请回答:
(1)、组成X的元素有 , X的化学式为。(2)、溶液C中溶质的成分是(用化学式表示);根据C→D→E的现象,给出相应微粒与阳离子结合由弱到强的排序。(3)、X与足量Na反应生成固体F的化学方程式是。(4)、设计实验确定溶液G中阴离子。30. 对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝( )、钼( )、镍( )等元素的氧化物,一种回收利用工艺的部分流程如下: 已知:25℃时, 的 , ; ; ;该工艺中, 时,溶液中 元素以 的形态存在。(1)、“焙烧”中,有 生成,其中 元素的化合价为。(2)、“沉铝”中,生成的沉淀 为。(3)、“沉钼”中, 为7.0。
已知:25℃时, 的 , ; ; ;该工艺中, 时,溶液中 元素以 的形态存在。(1)、“焙烧”中,有 生成,其中 元素的化合价为。(2)、“沉铝”中,生成的沉淀 为。(3)、“沉钼”中, 为7.0。①生成 的离子方程式为。
②若条件控制不当, 也会沉淀。为避免 中混入 沉淀,溶液中 (列出算式)时,应停止加入 溶液。
(4)、①滤液Ⅲ中,主要存在的钠盐有 和 , 为。②往滤液Ⅲ中添加适量 固体后,通入足量(填化学式)气体,再通入足量 ,可析出 。
(5)、高纯 (砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止 刻蚀液与下层 (砷化镓)反应。
①该氧化物为。②已知: 和 同族, 和 同族。在 与上层 的反应中, 元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为。