近三年高考化学真题分类汇编:氧族与碳族及其应用
试卷更新日期:2023-07-24 类型:二轮复习
一、选择题
-
1. 中华文化源远流长,化学与文化传承密不可分。下列说法错误的是A、青铜器“四羊方尊”的主要材质为合金 B、长沙走马楼出土的竹木简牍主要成分是纤维素 C、蔡伦采用碱液蒸煮制浆法造纸,该过程不涉及化学变化 D、铜官窑彩瓷是以黏土为主要原料,经高温烧结而成2. 下列鉴别或检验不能达到实验目的的是A、用石灰水鉴别Na2CO3与NaHCO3 B、用KSCN溶液检验FeSO4是否变质 C、用盐酸酸化的BaCl2溶液检验Na2SO3是否被氧化 D、加热条件下用银氨溶液检验乙醇中是否混有乙醛3. 下列有关物质的工业制备反应错误的是A、合成氨:N2+3H22NH3 B、制HCl:H2+Cl22HCl C、制粗硅:SiO2+2CSi+2CO D、冶炼镁:2MgO(熔融)2Mg+O2↑4. 化学与生活密切相关,下列说法正确的是A、苯甲酸钠可作为食品防腐剂是由于其具有酸性 B、豆浆能产生丁达尔效应是由于胶体粒子对光线的散射 C、SO2可用于丝织品漂白是由于其能氧化丝织品中有色成分 D、维生素C可用作水果罐头的抗氧化剂是由于其难以被氧化5. 物质的性质决定用途,下列两者对应关系错误的是A、能使某些色素褪色,可用作漂白剂 B、金属钠导热性好,可用作传热介质 C、溶液呈碱性,可用作消毒剂 D、呈红色,可用作颜料6. 北京冬奥会备受世界瞩目。下列说法错误的是( )A、冰壶主材料花岗岩属于无机非金属材料 B、火炬“飞扬”使用的碳纤维属于有机高分子材料 C、冬奥会“同心”金属奖牌属于合金材料 D、短道速滑服使用的超高分子量聚乙烯属于有机高分子材料7. 实验室制取少量水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是 ( )
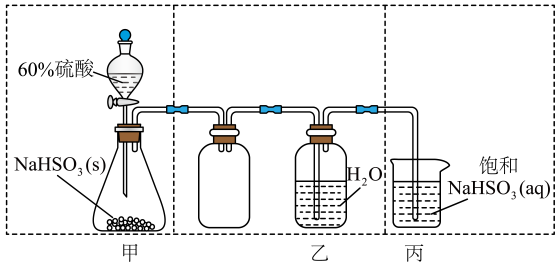 A、用装置甲制取气体 B、用装置乙制取水溶液 C、用装置丙吸收尾气中的 D、用干燥pH试纸检验水溶液的酸性8. 下列实验装置(夹持装置略)及操作正确的是( )
A、用装置甲制取气体 B、用装置乙制取水溶液 C、用装置丙吸收尾气中的 D、用干燥pH试纸检验水溶液的酸性8. 下列实验装置(夹持装置略)及操作正确的是( ) A、装置甲气体干燥 B、装置乙固液分离 C、装置丙Cl2制备 D、装置丁pH测试9. 福建多个科研机构经过长期联合研究发现,使用和改性的基催化剂,可打通从合成气经草酸二甲酯常压催化加氢制备乙二醇的技术难关。下列说法正确的是( )A、草酸属于无机物 B、与石墨互为同分异构体 C、属于过渡元素 D、催化剂通过降低焓变加快反应速率10. 化学是材料科学的基础。下列说法错误的是( )A、制造5G芯片的氮化铝晶圆属于无机非金属材料 B、制造阻燃或防火线缆的橡胶不能由加聚反应合成 C、制造特种防护服的芳纶纤维属于有机高分子材料 D、可降解聚乳酸塑料的推广应用可减少“白色污染”11. 下列叙述错误的是( )A、是极性分子 B、原子的中子数为10 C、与互为同素异形体 D、
A、装置甲气体干燥 B、装置乙固液分离 C、装置丙Cl2制备 D、装置丁pH测试9. 福建多个科研机构经过长期联合研究发现,使用和改性的基催化剂,可打通从合成气经草酸二甲酯常压催化加氢制备乙二醇的技术难关。下列说法正确的是( )A、草酸属于无机物 B、与石墨互为同分异构体 C、属于过渡元素 D、催化剂通过降低焓变加快反应速率10. 化学是材料科学的基础。下列说法错误的是( )A、制造5G芯片的氮化铝晶圆属于无机非金属材料 B、制造阻燃或防火线缆的橡胶不能由加聚反应合成 C、制造特种防护服的芳纶纤维属于有机高分子材料 D、可降解聚乳酸塑料的推广应用可减少“白色污染”11. 下列叙述错误的是( )A、是极性分子 B、原子的中子数为10 C、与互为同素异形体 D、 和
和 互为同系物
12. 定窑是宋代五大名窑之一,其生产的白瓷闻名于世。下列说法正确的是( )A、传统陶瓷是典型的绝缘材料 B、陶瓷主要成分为和 C、陶瓷烧制的过程为物理变化 D、白瓷的白色是因铁含量较高13. 下列说法错误的是( )A、CaF2与浓H2SO4糊状混合物可用于刻蚀玻璃 B、NaOH是强碱,因此钠盐的水溶液不会呈酸性 C、溶洞的形成主要源于溶解CO2的水对岩石的溶蚀作用 D、KMnO4与H2C2O4的反应中,Mn2+既是还原产物又是催化剂14. 在高温高压下可转变为具有一定导电性、高硬度的非晶态碳玻璃。下列关于该碳玻璃的说法错误的是( )A、具有自范性 B、与互为同素异形体 C、含有杂化的碳原子 D、化学性质与金刚石有差异15. 实验室制备过程为:①高温下在熔融强碱性介质中用氧化制备;②水溶后冷却,调溶液至弱碱性,歧化生成和;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得。下列说法正确的是( )A、①中用瓷坩埚作反应器 B、①中用作强碱性介质 C、②中只体现氧化性 D、转化为的理论转化率约为66.7%16. 下列说法不正确的是( )A、晶体硅的导电性介于导体和绝缘体之间,常用于制造光导纤维 B、高压钠灯发出的黄光透雾能力强、射程远,可用于道路照明 C、氧化铝熔点高,常用于制造耐高温材料 D、用石灰石-石膏法对燃煤烟气进行脱硫,同时可得到石膏17. 下列说法不正确的是( )A、乙醇和丙三醇互为同系物 B、和互为同位素 C、和互为同素异形体 D、丙酮()和环氧丙烷(
互为同系物
12. 定窑是宋代五大名窑之一,其生产的白瓷闻名于世。下列说法正确的是( )A、传统陶瓷是典型的绝缘材料 B、陶瓷主要成分为和 C、陶瓷烧制的过程为物理变化 D、白瓷的白色是因铁含量较高13. 下列说法错误的是( )A、CaF2与浓H2SO4糊状混合物可用于刻蚀玻璃 B、NaOH是强碱,因此钠盐的水溶液不会呈酸性 C、溶洞的形成主要源于溶解CO2的水对岩石的溶蚀作用 D、KMnO4与H2C2O4的反应中,Mn2+既是还原产物又是催化剂14. 在高温高压下可转变为具有一定导电性、高硬度的非晶态碳玻璃。下列关于该碳玻璃的说法错误的是( )A、具有自范性 B、与互为同素异形体 C、含有杂化的碳原子 D、化学性质与金刚石有差异15. 实验室制备过程为:①高温下在熔融强碱性介质中用氧化制备;②水溶后冷却,调溶液至弱碱性,歧化生成和;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得。下列说法正确的是( )A、①中用瓷坩埚作反应器 B、①中用作强碱性介质 C、②中只体现氧化性 D、转化为的理论转化率约为66.7%16. 下列说法不正确的是( )A、晶体硅的导电性介于导体和绝缘体之间,常用于制造光导纤维 B、高压钠灯发出的黄光透雾能力强、射程远,可用于道路照明 C、氧化铝熔点高,常用于制造耐高温材料 D、用石灰石-石膏法对燃煤烟气进行脱硫,同时可得到石膏17. 下列说法不正确的是( )A、乙醇和丙三醇互为同系物 B、和互为同位素 C、和互为同素异形体 D、丙酮()和环氧丙烷(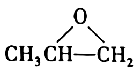 )互为同分异构体
18. 下列说法错误的是( )A、氢键、离子键和共价键都属于化学键 B、化学家门捷列夫编制了第一张元素周期表 C、药剂师和营养师必须具备化学相关专业知识 D、石灰石是制造玻璃和水泥的主要原料之一19. “碳中和”有利于全球气候改善。下列有关CO2的说法错误的是( )A、CO2是Ⅴ形的极性分子 B、CO2可催化还原为甲酸 C、CO2晶体可用于人工增雨 D、CO2是侯氏制碱法的原料之一20. 关于反应 所涉及的物质,下列说法错误的是( )A、H2SO4在该反应中为氧化剂 B、Na2SO3容易被空气中的O2氧化变质 C、Na2SO4是含有共价键的离子化合物 D、SO2是导致酸雨的主要有害污染物21. 下列说法错误的是( )A、纯铁比生铁易生锈 B、臭氧可用于自来水消毒 C、酚醛树脂可用作绝缘、隔热材料 D、高纯硅可用于制芯片22. 下列说法正确的是( )A、 (标准状况)与水充分反应转移 电子 B、 和 均可通过化合反应得到 C、将蘸有浓氨水和浓硫酸的玻璃棒相互靠近,有白烟产生 D、 与 溶液反应:23. 含S元素的某钠盐a能发生如图转化。下列说法错误的是( )
)互为同分异构体
18. 下列说法错误的是( )A、氢键、离子键和共价键都属于化学键 B、化学家门捷列夫编制了第一张元素周期表 C、药剂师和营养师必须具备化学相关专业知识 D、石灰石是制造玻璃和水泥的主要原料之一19. “碳中和”有利于全球气候改善。下列有关CO2的说法错误的是( )A、CO2是Ⅴ形的极性分子 B、CO2可催化还原为甲酸 C、CO2晶体可用于人工增雨 D、CO2是侯氏制碱法的原料之一20. 关于反应 所涉及的物质,下列说法错误的是( )A、H2SO4在该反应中为氧化剂 B、Na2SO3容易被空气中的O2氧化变质 C、Na2SO4是含有共价键的离子化合物 D、SO2是导致酸雨的主要有害污染物21. 下列说法错误的是( )A、纯铁比生铁易生锈 B、臭氧可用于自来水消毒 C、酚醛树脂可用作绝缘、隔热材料 D、高纯硅可用于制芯片22. 下列说法正确的是( )A、 (标准状况)与水充分反应转移 电子 B、 和 均可通过化合反应得到 C、将蘸有浓氨水和浓硫酸的玻璃棒相互靠近,有白烟产生 D、 与 溶液反应:23. 含S元素的某钠盐a能发生如图转化。下列说法错误的是( )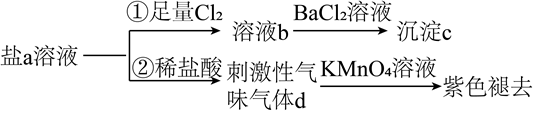 A、a可能为正盐,也可能为酸式盐 B、c为不溶于盐酸的白色沉淀 C、d为含极性键的非极性分子 D、反应②中还可能生成淡黄色沉淀24. 2020年9月22日,中国向全世界宣布,努力争取2060年前实现碳中和。下列措施不利于大气中 减少的是( )A、用氨水捕集废气中的 ,将其转化为氮肥 B、大力推广使用风能、水能、氢能等清洁能源 C、大力推广使用干冰实现人工增雨,缓解旱情 D、通过植树造林,利用光合作用吸收大气中的25. 室温下,1体积的水能溶解约40体积的SO2。用试管收集SO2后进行如下实验。对实验现象的分析正确的是( )
A、a可能为正盐,也可能为酸式盐 B、c为不溶于盐酸的白色沉淀 C、d为含极性键的非极性分子 D、反应②中还可能生成淡黄色沉淀24. 2020年9月22日,中国向全世界宣布,努力争取2060年前实现碳中和。下列措施不利于大气中 减少的是( )A、用氨水捕集废气中的 ,将其转化为氮肥 B、大力推广使用风能、水能、氢能等清洁能源 C、大力推广使用干冰实现人工增雨,缓解旱情 D、通过植树造林,利用光合作用吸收大气中的25. 室温下,1体积的水能溶解约40体积的SO2。用试管收集SO2后进行如下实验。对实验现象的分析正确的是( ) A、试管内液面上升,证明SO2与水发生了反应 B、试管中剩余少量气体,是因为SO2的溶解已达饱和 C、取出试管中的溶液,立即滴入紫色石蕊试液,溶液显红色,原因是:SO2+H2O⇌H2SO3、H2SO3⇌H++ 、 ⇌H++ D、取出试管中溶液,在空气中放置一段时间后pH下降,是由于SO2挥发26. 有利于实现“碳达峰、碳中和”的是( )A、风能发电 B、粮食酿酒 C、燃煤脱硫 D、石油裂化
A、试管内液面上升,证明SO2与水发生了反应 B、试管中剩余少量气体,是因为SO2的溶解已达饱和 C、取出试管中的溶液,立即滴入紫色石蕊试液,溶液显红色,原因是:SO2+H2O⇌H2SO3、H2SO3⇌H++ 、 ⇌H++ D、取出试管中溶液,在空气中放置一段时间后pH下降,是由于SO2挥发26. 有利于实现“碳达峰、碳中和”的是( )A、风能发电 B、粮食酿酒 C、燃煤脱硫 D、石油裂化二、非选择题
-
27. 某兴趣小组设计实验探究 , 催化空气氧化的效率。回答下列问题:(1)、步骤Ⅰ 制备
在通风橱中用下图装置制备(加热及夹持装置省略),反应方程式:

装置A中盛放甲酸的仪器的名称是。
(2)、从B、C、D中选择合适的装置收集 , 正确的接口连接顺序为a→→→→→h(每空填一个接口标号)。(3)、步骤Ⅱ 检验将通入新制银氨溶液中,有黑色沉淀生成。
该反应的化学方程式为。(4)、步骤Ⅲ 探究催化空气氧化的效率将一定量与空气混合,得到体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至 , 按一定流速通入气体样品。(已知:是白色固体,易吸水潮解:)

通入(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了。
①能证明被空气氧化的现象是;
②被催化氧化的百分率为;
③若未通入氮气,②的结果将(填“偏大”“偏小”或“无影响”)。
(5)、探究气体与催化剂接触时长对催化氧化效率的影响时,采用方法可以缩短接触时长。(6)、步骤Ⅲ装置存在的不足之处是。28.(1)、已知3种原子晶体的熔点数据如下表:金刚石
碳化硅
晶体硅
熔点/℃
>3550
2600
1415
金刚石熔点比晶体硅熔点高的原因是。
(2)、提纯含有少量氯化钠的甘氨酸样品:将样品溶于水,调节溶液的pH使甘氨酸结晶析出,可实现甘氨酸的提纯。其理由是。29. 胆矾( )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的 (杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:(1)、制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有(填标号)。A.烧杯 B.容量瓶 C.蒸发皿 D.移液管
(2)、将 加入到适量的稀硫酸中,加热,其主要反应的化学方程式为 , 与直接用废铜和浓硫酸反应相比,该方法的优点是。(3)、待 完全反应后停止加热,边搅拌边加入适量 ,冷却后用 调 为3.5~4,再煮沸 ,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、、乙醇洗涤、 , 得到胆矾。其中,控制溶液 为3.5~4的目的是 , 煮沸 的作用是。(4)、结晶水测定:称量干燥坩埚的质量为 ,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为 。根据实验数据,胆矾分子中结晶水的个数为(写表达式)。(5)、下列操作中,会导致结晶水数目测定值偏高的是(填标号)。①胆矾未充分干燥 ②坩埚未置于干燥器中冷却 ③加热时有少胆矾迸溅出来
30. 某兴趣小组对化合物X开展探究实验。
其中:X是易溶于水的强酸盐,由3种元素组成;A和B均为纯净物;B可使品红水溶液褪色。请回答:
(1)、组成X的3种元素是(填元素符号),X的化学式是。(2)、将固体X加入温热的稀H2SO4中,产生气体B,该反应的离子方程式是。(3)、步骤I,发生反应的化学方程式是。(4)、步骤II,某同学未加H2O2溶液,发现也会缓慢出现白色浑浊,原因是。(5)、关于气体B使品红水溶液褪色的原因,一般认为:B不能使品红褪色,而是B与水反应的生成物使品红褪色。请设计实验证明。