近三年高考化学真题分类汇编:化学用语1
试卷更新日期:2023-07-24 类型:二轮复习
一、选择题
-
1. 是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某(Ⅱ)催化剂(用表示)能高效电催化氧化合成 , 其反应机理如图所示。

下列说法错误的是
A、(Ⅱ)被氧化至(Ⅲ)后,配体失去质子能力增强 B、M中的化合价为 C、该过程有非极性键的形成 D、该过程的总反应式:2. 下列反应的离子方程式错误的是A、通入氢氧化钠溶液: B、氧化铝溶于氢氧化钠溶液: C、过量通入饱和碳酸钠溶液: D、溶液中滴入氯化钙溶液:3. 下列物质中属于耐高温酸性氧化物的是A、 B、 C、 D、4. 阅读下列材料,完成5~7题:周期表中IVA族元素及其化合物应用广泛。甲烷具有较大的燃烧热(890.3 kJ·mol-1),是常见燃料;Si、 Ge是重要的半导体材料,硅晶体表面SiO2能与氢氟酸(HF,弱酸)反应生成H2SiF6 (H2SiF6在水中完全电离为H+和SiF62- ); 1885年德国化学家将硫化锗(GeS2)与H2共热制得了门捷列夫预言的类硅-锗;我国古代就掌握了青铜(铜-锡合金)的冶炼、加工技术,制造出许多精美的青铜器;Pb、PbO2是铅蓄电池的电极材料,不同铅化合物一般具有不同颜色,历史上曾广泛用作颜料。
(1)、下列说法正确的是( )A、金刚石与石墨烯中的夹角都为 B、、都是由极性键构成的非极性分子 C、锗原子()基态核外电子排布式为 D、ⅣA族元素单质的晶体类型相同(2)、下列化学反应表示正确的是( )A、与HF溶液反应: B、高温下还原: C、铅蓄电池放电时的正极反应: D、甲烷的燃烧:(3)、下列物质性质与用途具有对应关系的是( )A、石墨能导电,可用作润滑剂 B、单晶硅熔点高,可用作半导体材料 C、青铜比纯铜熔点低、硬度大,古代用青铜铸剑 D、含铅化合物颜色丰富,可用作电极材料5. 下列符号表征或说法正确的是( )A、电离: B、位于元素周期表p区 C、空间结构:平面三角形 D、电子式: 6. BCl3水解反应方程式为:BCl3+3H2O=B(OH)3+3HCl,下列说法错误的是( )A、Cl的原子结构示意图为
6. BCl3水解反应方程式为:BCl3+3H2O=B(OH)3+3HCl,下列说法错误的是( )A、Cl的原子结构示意图为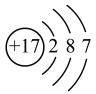 B、H2O的空间填充模型为
B、H2O的空间填充模型为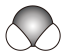 C、BCl3的电子式为:
C、BCl3的电子式为: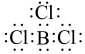 D、B(OH)3的结构简式为
D、B(OH)3的结构简式为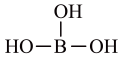 7. 近年我国在科技领域不断取得新成就。对相关成就所涉及的化学知识理解错误的是( )A、我国科学家实现了从二氧化碳到淀粉的人工合成,淀粉是一种单糖 B、中国“深海一号”平台成功实现从深海中开采石油和天然气,石油和天然气都是混合物 C、我国实现了高性能纤维锂离子电池的规模化制备,锂离子电池放电时将化学能转化为电能 D、以硅树脂为基体的自供电软机器人成功挑战马里亚纳海沟,硅树脂是一种高分子材料8. 磷酰三叠氮是一种高能分子,结构简式为。下列关于该分子的说法正确的是( )A、为非极性分子 B、立体构型为正四面体形 C、加热条件下会分解并放出 D、分解产物的电子式为9. 下列方程式与所给事实不相符的是( )A、加热固体,产生无色气体: B、过量铁粉与稀硝酸反应,产生无色气体: C、苯酚钠溶液中通入 , 出现白色浑浊:
7. 近年我国在科技领域不断取得新成就。对相关成就所涉及的化学知识理解错误的是( )A、我国科学家实现了从二氧化碳到淀粉的人工合成,淀粉是一种单糖 B、中国“深海一号”平台成功实现从深海中开采石油和天然气,石油和天然气都是混合物 C、我国实现了高性能纤维锂离子电池的规模化制备,锂离子电池放电时将化学能转化为电能 D、以硅树脂为基体的自供电软机器人成功挑战马里亚纳海沟,硅树脂是一种高分子材料8. 磷酰三叠氮是一种高能分子,结构简式为。下列关于该分子的说法正确的是( )A、为非极性分子 B、立体构型为正四面体形 C、加热条件下会分解并放出 D、分解产物的电子式为9. 下列方程式与所给事实不相符的是( )A、加热固体,产生无色气体: B、过量铁粉与稀硝酸反应,产生无色气体: C、苯酚钠溶液中通入 , 出现白色浑浊: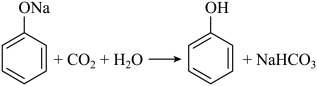 D、乙醇、乙酸和浓硫酸混合加热,产生有香味的油状液体:
10. 下列化学用语或图示表达错误的是( )A、乙炔的结构简式: B、顺丁烯的分子结构模型:
D、乙醇、乙酸和浓硫酸混合加热,产生有香味的油状液体:
10. 下列化学用语或图示表达错误的是( )A、乙炔的结构简式: B、顺丁烯的分子结构模型: C、基态原子的价层电子的轨道表示式:
C、基态原子的价层电子的轨道表示式: D、的电子式:
D、的电子式: 11. 对于下列实验,不能正确描述其反应的离子方程式是( )A、向氢氧化钡溶液中加入盐酸:H++OH-=H2O B、向硝酸银溶液中滴加少量碘化钾溶液:Ag++I-=AgI↓ C、向烧碱溶液中加入一小段铝片:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ D、向次氯酸钙溶液中通入少量二氧化碳气体:ClO-+CO2+H2O=HClO+HCO12. 下列化学用语表达正确的是( )A、F-的离子结构示意图:
11. 对于下列实验,不能正确描述其反应的离子方程式是( )A、向氢氧化钡溶液中加入盐酸:H++OH-=H2O B、向硝酸银溶液中滴加少量碘化钾溶液:Ag++I-=AgI↓ C、向烧碱溶液中加入一小段铝片:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ D、向次氯酸钙溶液中通入少量二氧化碳气体:ClO-+CO2+H2O=HClO+HCO12. 下列化学用语表达正确的是( )A、F-的离子结构示意图: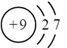 B、基态碳原子的轨道表示式:
B、基态碳原子的轨道表示式:  C、丙炔的键线式:
C、丙炔的键线式: 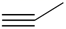 D、H2O分子的球棍模型:
D、H2O分子的球棍模型: 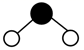 13. 核聚变发电有望成为解决人类能源问题的重要手段之一、氘( )是核聚变反应的主要原料,下列有关叙述正确的是( )A、 的中子数为2 B、 的核电荷数为1 C、 是自然界中最轻的原子 D、 是氢元素的一种同素异形体14. 下列化学用语使用正确的是( )A、基态C原子价电子排布图:
13. 核聚变发电有望成为解决人类能源问题的重要手段之一、氘( )是核聚变反应的主要原料,下列有关叙述正确的是( )A、 的中子数为2 B、 的核电荷数为1 C、 是自然界中最轻的原子 D、 是氢元素的一种同素异形体14. 下列化学用语使用正确的是( )A、基态C原子价电子排布图: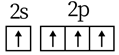 B、 结构示意图:
B、 结构示意图: 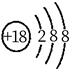 C、 形成过程:
C、 形成过程: 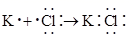 D、质量数为2的氢核素:
15. 代表阿伏加德罗常数的值。下列说法正确的是( )A、 中含有的电子数为1.3 B、 中含有的共价键的数目为0.1 C、 肼 含有的孤电子对数为0.2 D、 ,生成 乙烷时断裂的共价键总数为16. 下列有关放射性核素氚( H)的表述错误的是( )A、 H原子核外电子数为1 B、 H原子核内中子数为3 C、 与H2化学性质基本相同 D、 具有放射性17. 下列化学用语或图示表达错误的是( )A、N2的结构式:N≡N B、Na+的原子结构示意图:
D、质量数为2的氢核素:
15. 代表阿伏加德罗常数的值。下列说法正确的是( )A、 中含有的电子数为1.3 B、 中含有的共价键的数目为0.1 C、 肼 含有的孤电子对数为0.2 D、 ,生成 乙烷时断裂的共价键总数为16. 下列有关放射性核素氚( H)的表述错误的是( )A、 H原子核外电子数为1 B、 H原子核内中子数为3 C、 与H2化学性质基本相同 D、 具有放射性17. 下列化学用语或图示表达错误的是( )A、N2的结构式:N≡N B、Na+的原子结构示意图: C、溴乙烷的分子模型:
C、溴乙烷的分子模型:  D、CO2的电子式:
D、CO2的电子式:  18. 下列方程式不能准确解释相应实验现象的是( )A、酚酞滴入醋酸钠溶液中变为浅红色:CH3COO-+H2O⇌CH3COOH+OH- B、金属钠在空气中加热生成淡黄色固体:4Na+O2=2Na2O C、铝溶于氢氧化钠溶液,有无色气体产生:2Al+2OH-+2H2O=2 +3H2↑ D、将二氧化硫通入氢硫酸中产生黄色沉淀:SO2+2H2S=3S↓+2H2O19. 使用如图装置(搅拌装置略)探究溶液离子浓度变化,灯光变化不可能出现“亮→暗(或灭)→亮”现象的是( )
18. 下列方程式不能准确解释相应实验现象的是( )A、酚酞滴入醋酸钠溶液中变为浅红色:CH3COO-+H2O⇌CH3COOH+OH- B、金属钠在空气中加热生成淡黄色固体:4Na+O2=2Na2O C、铝溶于氢氧化钠溶液,有无色气体产生:2Al+2OH-+2H2O=2 +3H2↑ D、将二氧化硫通入氢硫酸中产生黄色沉淀:SO2+2H2S=3S↓+2H2O19. 使用如图装置(搅拌装置略)探究溶液离子浓度变化,灯光变化不可能出现“亮→暗(或灭)→亮”现象的是( )
选项
A
B
C
D
试剂a
CuSO4
NH4HCO3
H2SO4
CH3COOH
试剂b
Ba(OH)2
Ca(OH)2
Ba(OH)2
NH3·H2O
A、A B、B C、C D、D二、多选题
-
20. 已知 , 的酸性比强。下列有关说法正确的是( )A、HCl的电子式为
 B、Cl-Cl键的键长比I-I键短
C、分子中只有σ键
D、的酸性比强
21. 下列离子方程式正确的是( )A、 通入冷的 溶液: B、用醋酸和淀粉 溶液检验加碘盐中的 : C、 溶液中加入 产生沉淀: D、 溶液与少量的 溶液混合:
B、Cl-Cl键的键长比I-I键短
C、分子中只有σ键
D、的酸性比强
21. 下列离子方程式正确的是( )A、 通入冷的 溶液: B、用醋酸和淀粉 溶液检验加碘盐中的 : C、 溶液中加入 产生沉淀: D、 溶液与少量的 溶液混合:三、非选择题
-
22. 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:

已知:最高价铬酸根在酸性介质中以存在,在碱性介质中以存在。
回答下列问题:
(1)、煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为(填化学式)。(2)、水浸渣中主要有和。(3)、“沉淀”步骤调到弱碱性,主要除去的杂质是。(4)、“除硅磷”步骤中,使硅、磷分别以和的形式沉淀,该步需要控制溶液的以达到最好的除杂效果,若时,会导致;时,会导致。(5)、“分离钒”步骤中,将溶液调到1.8左右得到沉淀,在时,溶解为或在碱性条件下,溶解为或 , 上述性质说明具有_______(填标号)。A、酸性 B、碱性 C、两性(6)、“还原”步骤中加入焦亚硫酸钠()溶液,反应的离子方程式为。23. 硫铁化合物(、等)应用广泛。(1)、纳米可去除水中微量六价铬。在的水溶液中,纳米颗粒表面带正电荷,主要以、、好形式存在,纳米去除水中主要经过“吸附→反应→沉淀”的过程。已知: , ;电离常数分别为、。
①在弱碱性溶液中,与反应生成、和单质S,其离子方程式为。
②在弱酸性溶液中,反应的平衡常数K的数值为。
③在溶液中,pH越大,去除水中的速率越慢,原因是。
(2)、具有良好半导体性能。的一种晶体与晶体的结构相似,该晶体的一个晶胞中的数目为 , 在晶体中,每个S原子与三个紧邻,且间距相等,如图给出了晶胞中的和位于晶胞体心的(中的键位于晶胞体对角线上,晶胞中的其他已省略)。如图中用“-”将其中一个S原子与紧邻的连接起来。 (3)、、在空气中易被氧化,将在空气中氧化,测得氧化过程中剩余固体的质量与起始的质量的比值随温度变化的曲线如图所示。时,氧化成含有两种元素的固体产物为(填化学式,写出计算过程)。
(3)、、在空气中易被氧化,将在空气中氧化,测得氧化过程中剩余固体的质量与起始的质量的比值随温度变化的曲线如图所示。时,氧化成含有两种元素的固体产物为(填化学式,写出计算过程)。 24. 氢气是一种清洁能源,绿色环保制氢技术研究具有重要意义。(1)、“热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
24. 氢气是一种清洁能源,绿色环保制氢技术研究具有重要意义。(1)、“热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。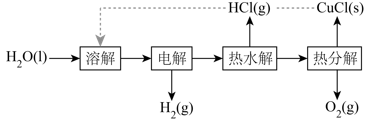
①电解在质子交换膜电解池中进行。阳极区为酸性溶液,阴极区为盐酸,电解过程中转化为。电解时阳极发生的主要电极反应为(用电极反应式表示)。
②电解后,经热水解和热分解的物质可循环使用。在热水解和热分解过程中,发生化合价变化的元素有(填元素符号)。
(2)、“热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收制得的溶液反应,生成、和;再经生物柴油副产品转化为Fe。①实验中发现,在时,密闭容器中溶液与铁粉反应,反应初期有生成并放出 , 该反应的离子方程式为。
②随着反应进行,迅速转化为活性 , 活性是转化为的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为。

③在其他条件相同时,测得Fe的转化率、的产率随变化如题图所示。的产率随增加而增大的可能原因是。
 (3)、从物质转化与资源综合利用角度分析,“热循环制氢和甲酸”的优点是。25. 全球对锂资源的需求不断增长,“盐湖提锂”越来越受到重视。某兴趣小组取盐湖水进行浓缩和初步除杂后,得到浓缩卤水(含有和少量),并设计了以下流程通过制备碳酸锂来提取锂。
(3)、从物质转化与资源综合利用角度分析,“热循环制氢和甲酸”的优点是。25. 全球对锂资源的需求不断增长,“盐湖提锂”越来越受到重视。某兴趣小组取盐湖水进行浓缩和初步除杂后,得到浓缩卤水(含有和少量),并设计了以下流程通过制备碳酸锂来提取锂。
时相关物质的参数如下:
的溶解度:
化合物

回答下列问题:
(1)、“沉淀1”为。(2)、向“滤液1”中加入适量固体的目的是。(3)、为提高的析出量和纯度,“操作A”依次为、、洗涤。(4)、有同学建议用“侯氏制碱法”的原理制备。查阅资料后,发现文献对常温下的有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究的性质,将饱和溶液与饱和溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,在该实验条件下(填“稳定”或“不稳定”),有关反应的离子方程式为。(5)、他们结合(4)的探究结果,拟将原流程中向“滤液2”加入改为通入。这一改动能否达到相同的效果,作出你的判断并给出理由。26. 工业上以氟磷灰石[ , 含等杂质]为原料生产磷酸和石膏,工艺流程如下:
回答下列问题:
(1)、酸解时有产生。氢氟酸与反应生成二元强酸 , 离子方程式为。(2)、部分盐的溶度积常数见下表。精制Ⅰ中,按物质的量之比加入脱氟,充分反应后,;再分批加入一定量的 , 首先转化为沉淀的离子是。(3)、浓度(以计)在一定范围时,石膏存在形式与温度、浓度(以计)的关系如图甲所示。酸解后,在所得、为45的混合体系中,石膏存在形式为(填化学式);洗涤时使用一定浓度的硫酸溶液而不使用水,原因是 , 回收利用洗涤液X的操作单元是;一定温度下,石膏存在形式与溶液中和的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是(填标号)。
A.、、 B.、、
C.、、 D.、、
27. 废旧铅蓄电池的铅膏中主要含有、、和 , 还有少量、、的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。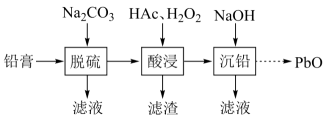
一些难溶电解质的溶度积常数如下表:
难溶电解质
一定条件下,一些金属氢氧化物沉淀时的如下表:
金属氢氧化物
开始沉淀的
2.3
6.8
3.5
7.2
完全沉淀的
3.2
8.3
4.6
9.1
回答下列问题:
(1)、在“脱硫”中转化反应的离子方程式为 , 用沉淀溶解平衡原理解释选择的原因。(2)、在“脱硫”中,加入不能使铅膏中完全转化,原因是。(3)、在“酸浸”中,除加入醋酸(),还要加入。(ⅰ)能被氧化的离子是;
(ⅱ)促进了金属在醋酸中转化为 , 其化学方程式为;
(ⅲ)也能使转化为 , 的作用是。
(4)、“酸浸”后溶液的约为4.9,滤渣的主要成分是。(5)、“沉铅”的滤液中,金属离子有。28. 铁单质及其化合物的应用非常广泛。(1)、基态Fe原子的价层电子排布式为。(2)、用X射线衍射测定,得到Fe的两种晶胞A、B,其结构如图所示。晶胞A中每个Fe原子紧邻的原子数为。每个晶胞B中含Fe原子数为。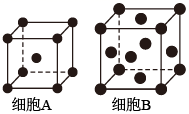 (3)、合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式。从能量角度分析,铁触媒的作用是。
(3)、合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式。从能量角度分析,铁触媒的作用是。 (4)、Fe3+可与H2O、SCN-、F-等配体形成配位数为6的配离子,如 、 、 。某同学按如下步骤完成实验:
(4)、Fe3+可与H2O、SCN-、F-等配体形成配位数为6的配离子,如 、 、 。某同学按如下步骤完成实验:
① 为浅紫色,但溶液Ⅰ却呈黄色,其原因是 , 为了能观察到溶液Ⅰ中 的浅紫色,可采取的方法是。
②已知Fe3+与SCN-、F-的反应在溶液中存在以下平衡: ; ,向溶液Ⅱ中加入NaF后,溶液颜色由红色转变为无色。若该反应是可逆反应,其离子方程式为 , 平衡常数为(用K1和K2表示)。
29. CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2 , S8受热分解成气态S2 , 发生反应 ,回答下列问题:(1)、CH4的电子式为 , CS2分子的立体构型为。(2)、某温度下,若S8完全分解成气态S2。在恒温密闭容器中,S2与CH4物质的量比为2∶1时开始反应。①当CS2的体积分数为10%时,CH4的转化率为。
②当以下数值不变时,能说明该反应达到平衡的是(填序号)。
a.气体密度b.气体总压c.CH4与S2体积比d.CS2的体积分数
(3)、一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为(填“放热”或“吸热”)反应。工业上通常采用在600~650℃的条件下进行此反应,不采用低于600℃的原因是。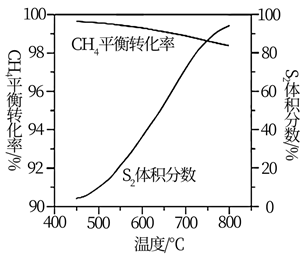 (4)、用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单后硫S,可实现废物利用,保护环境,写出其中一个反应的化学方程式。30. 一种利胆药物F的合成路线如图:
(4)、用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单后硫S,可实现废物利用,保护环境,写出其中一个反应的化学方程式。30. 一种利胆药物F的合成路线如图: 已知:Ⅰ.
已知:Ⅰ. 
 +
+ 
Ⅱ.

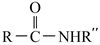
回答下列问题:
(1)、A的结构简式为;符合下列条件的A的同分异构体有种。①含有酚羟基 ②不能发生银镜反应 ③含有四种化学环境的氢
(2)、检验B中是否含有A的试剂为;B→C的反应类型为。(3)、C→D的化学方程式为;E中含氧官能团共种。(4)、已知: ,综合上述信息,写出由
,综合上述信息,写出由  和
和  制备
制备  的合成路线。
的合成路线。