近三年高考化学真题分类汇编:化学与生活
试卷更新日期:2023-07-24 类型:二轮复习
一、选择题
-
1. 中华文化源远流长,化学与文化传承密不可分。下列说法错误的是A、青铜器“四羊方尊”的主要材质为合金 B、长沙走马楼出土的竹木简牍主要成分是纤维素 C、蔡伦采用碱液蒸煮制浆法造纸,该过程不涉及化学变化 D、铜官窑彩瓷是以黏土为主要原料,经高温烧结而成2. 下列有关物质的工业制备反应错误的是A、合成氨:N2+3H22NH3 B、制HCl:H2+Cl22HCl C、制粗硅:SiO2+2CSi+2CO D、冶炼镁:2MgO(熔融)2Mg+O2↑3. 化学与生活密切相关,下列说法正确的是A、苯甲酸钠可作为食品防腐剂是由于其具有酸性 B、豆浆能产生丁达尔效应是由于胶体粒子对光线的散射 C、SO2可用于丝织品漂白是由于其能氧化丝织品中有色成分 D、维生素C可用作水果罐头的抗氧化剂是由于其难以被氧化4. 定窑是宋代五大名窑之一,其生产的白瓷闻名于世。下列说法正确的是( )A、传统陶瓷是典型的绝缘材料 B、陶瓷主要成分为和 C、陶瓷烧制的过程为物理变化 D、白瓷的白色是因铁含量较高5. 化学与生活密切相关,下列不涉及化学变化的是( )A、加入明矾后泥水变澄清 B、北京冬奥会用水快速制冰 C、炖排骨汤时加点醋味道更鲜 D、切开的茄子放置后切面变色6. 化学与日常生活息息相关。下列说法错误的是( )A、使用含氟牙膏能预防龋齿 B、小苏打的主要成分是 C、可用食醋除去水垢中的碳酸钙 D、使用食品添加剂不应降低食品本身营养价值7. 化学物质在体育领域有广泛用途。下列说法错误的是( )A、涤纶可作为制作运动服的材料 B、纤维素可以为运动员提供能量 C、木糖醇可用作运动饮料的甜味剂 D、“复方氯乙烷气雾剂”可用于运动中急性损伤的镇痛8. 下列说法正确的是( )A、工业上通过电解六水合氯化镁制取金属镁 B、接触法制硫酸时,煅烧黄铁矿以得到三氧化硫 C、浓硝酸与铁在常温下不反应,所以可用铁质容器贮运浓硝酸 D、“洁厕灵”(主要成分为盐酸)和“84消毒液”(主要成分为次氯酸钠)不能混用9. 化学促进了科技进步和社会发展。下列叙述中没有涉及化学变化的是( )A、《神农本草经》中记载的“石胆能化铁为铜” B、利用“侯氏联合制碱法”制备纯碱 C、科学家成功将 转化为淀粉或葡萄糖 D、北京冬奥会场馆使用 跨临界直冷制冰10. 劳动开创未来。下列劳动项目与所述的化学知识没有关联的是( )
选项
劳动项目
化学知识
A
面包师用小苏打作发泡剂烘焙面包
可与酸反应
B
环保工程师用熟石灰处理酸性废水
熟石灰具有碱性
C
工人将模具干燥后再注入熔融钢水
铁与 高温下会反应
D
技术人员开发高端耐腐蚀镀铝钢板
铝能形成致密氧化膜
A、A B、B C、C D、D11. 中华文明源远流长,在世界文明中独树一帜,汉字居功至伟。随着时代发展,汉字被不断赋予新的文化内涵,其载体也发生相应变化。下列汉字载体主要由合金材料制成的是( )汉字载体




选项
A.兽骨
B.青铜器
C.纸张
D.液晶显示屏
A、A B、B C、C D、D12. 北京冬奥会成功举办、神舟十三号顺利往返、“天宫课堂”如期开讲及“华龙一号”核电海外投产等,均展示了我国科技发展的巨大成就。下列相关叙述正确的是( )A、冬奥会“飞扬”火炬所用的燃料 为氧化性气体 B、飞船返回舱表层材料中的玻璃纤维属于天然有机高分子 C、乙酸钠过饱和溶液析出晶体并放热的过程仅涉及化学变化 D、核电站反应堆所用铀棒中含有的 与 互为同位素13. 广东一直是我国对外交流的重要窗口,馆藏文物是其历史见证。下列文物主要由硅酸盐制成的是( )文物




选项
A.南宋鎏金饰品
B.蒜头纹银盒
C.广彩瓷咖啡杯
D.铜镀金钟座
A、A B、B C、C D、D14. 陈述Ⅰ和Ⅱ均正确但不具有因果关系的是( )选项
陈述Ⅰ
陈述Ⅱ
A
用焦炭和石英砂制取粗硅
可制作光导纤维
B
利用海水制取溴和镁单质
可被氧化, 可被还原
C
石油裂解气能使溴的 溶液褪色
石油裂解可得到乙烯等不饱和烃
D
水解可生成 胶体
可用作净水剂
A、A B、B C、C D、D15. 生活中处处有化学,下列叙述正确的是( )A、铅笔芯的成分为二氧化铅 B、碳酸氢钠可做食品膨松剂 C、青铜和黄铜是不同结构的单质铜 D、焰火中红色来源于钠盐灼烧16. 下列说法不正确的是( )A、镁合金密度较小、强度较大,可用于制造飞机部件 B、还原铁粉可用作食品干燥剂 C、氯气、臭氧、二氧化氯都可用于饮用水的消毒 D、油脂是热值最高的营养物质17. “碳中和”有利于全球气候改善。下列有关CO2的说法错误的是( )A、CO2是Ⅴ形的极性分子 B、CO2可催化还原为甲酸 C、CO2晶体可用于人工增雨 D、CO2是侯氏制碱法的原料之一18. 下列说法错误的是( )A、纯铁比生铁易生锈 B、臭氧可用于自来水消毒 C、酚醛树脂可用作绝缘、隔热材料 D、高纯硅可用于制芯片19. 下列物质应用错误的是( )A、石墨用作润滑剂 B、氧化钙用作食品干燥剂 C、聚乙炔用作绝缘材料 D、乙二醇溶液用作汽车防冻液20. 关于CH3OH、N2H4和(CH3)2NNH2的结构与性质,下列说法错误的是( )A、CH3OH为极性分子 B、N2H4空间结构为平面形 C、N2H4的沸点高于(CH3)2NNH2 D、CH3OH和(CH3)2NNH2中C、O、N杂化方式均相同21. 关于化合物 的性质,下列推测不合理的是( )A、具有强氧化性 B、与 溶液反应可生成两种钠盐 C、与盐酸作用能产生氯气 D、水解生成盐酸和硝酸22. 下列说法不正确的是( )A、应避免铵态氮肥与草木灰混合施用 B、工业上可用离子交换法提高海带中碘的提取率 C、电解饱和食盐水可以得到金属钠和氯气 D、将生铁进一步炼制减少含碳量,能得到耐腐蚀的钢23. 广东有众多国家级非物质文化遗产,如广东剪纸、粤绣、潮汕工夫茶艺和香云纱染整技艺等。下列说法不正确的是( )A、广东剪纸的裁剪过程不涉及化学变化 B、冲泡工夫茶时茶香四溢,体现了分子是运动的 C、制作粤绣所用的植物纤维布含有天然高分子化合物 D、染整技艺中去除丝胶所用的纯碱水溶液属于纯净物24. 化学与人体健康及环境保护息息相关。下列叙述正确的是( )A、食品加工时不可添加任何防腐剂 B、掩埋废旧电池不会造成环境污染 C、天然气不完全燃烧会产生有毒气体 D、使用含磷洗涤剂不会造成水体污染25. 下列有关湘江流域的治理和生态修复的措施中,没有涉及到化学变化的是( )A、定期清淤,疏通河道 B、化工企业“三废”处理后,达标排放 C、利用微生物降解水域中的有毒有害物质 D、河道中的垃圾回收分类后,进行无害化处理26. 硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境问题也日益受到关注,下列说法正确的是( )A、NO2和SO2均为红棕色且有刺激性气味的气体,是酸雨的主要成因 B、汽车尾气中的主要大气污染物为NO、SO2和PM2.5 C、植物直接吸收利用空气中的NO和NO2作为肥料,实现氮的固定 D、工业废气中的SO2可采用石灰法进行脱除27. 用中子轰击 X原子产生α粒子(即氮核 He)的核反应为: X+ n→ Y+ He。已知元素Y在化合物中呈+1价。下列说法正确的是( )A、H3XO3可用于中和溅在皮肤上的NaOH溶液 B、Y单质在空气中燃烧的产物是Y2O2 C、X和氢元素形成离子化合物 D、6Y和7Y互为同素异形体二、非选择题
-
28. 对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝( )、钼( )、镍( )等元素的氧化物,一种回收利用工艺的部分流程如下:
 已知:25℃时, 的 , ; ; ;该工艺中, 时,溶液中 元素以 的形态存在。(1)、“焙烧”中,有 生成,其中 元素的化合价为。(2)、“沉铝”中,生成的沉淀 为。(3)、“沉钼”中, 为7.0。
已知:25℃时, 的 , ; ; ;该工艺中, 时,溶液中 元素以 的形态存在。(1)、“焙烧”中,有 生成,其中 元素的化合价为。(2)、“沉铝”中,生成的沉淀 为。(3)、“沉钼”中, 为7.0。①生成 的离子方程式为。
②若条件控制不当, 也会沉淀。为避免 中混入 沉淀,溶液中 (列出算式)时,应停止加入 溶液。
(4)、①滤液Ⅲ中,主要存在的钠盐有 和 , 为。②往滤液Ⅲ中添加适量 固体后,通入足量(填化学式)气体,再通入足量 ,可析出 。
(5)、高纯 (砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止 刻蚀液与下层 (砷化镓)反应。
①该氧化物为。②已知: 和 同族, 和 同族。在 与上层 的反应中, 元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为。
29. 化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备NaHCO3 , 进一步处理得到产品Na2CO3和NH4Cl,实验流程如图: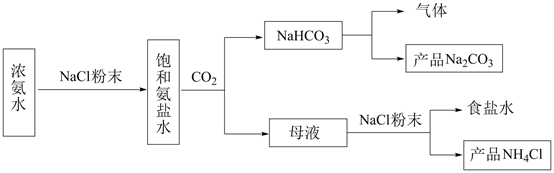
回答下列问题:
(1)、从A~E中选择合适的仪器制备NaHCO3 , 正确的连接顺序是(按气流方向,用小写字母表示)。为使A中分液漏斗内的稀盐酸顺利滴下,可将分液漏斗上部的玻璃塞打开或。A.
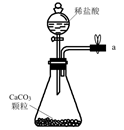 B.
B. 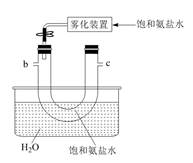 C.
C.  D.
D. 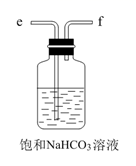 E.
E.  (2)、B中使用雾化装置的优点是 。(3)、生成NaHCO3的总反应的化学方程式为。(4)、反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:
(2)、B中使用雾化装置的优点是 。(3)、生成NaHCO3的总反应的化学方程式为。(4)、反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:①对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2 , Na2O2增重0.14g,则固体NaHCO3的质量为g。
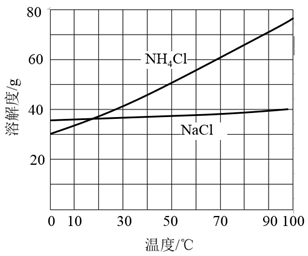
②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为、、洗涤、干燥。
 (5)、无水NaHCO3可作为基准物质标定盐酸浓度.称量前,若无水NaHCO3保存不当,吸收了一定量水分,用其标定盐酸浓度时,会使结果___(填标号)。A、偏高 B、偏低 不变30. “氯碱工业”以电解饱和食盐水为基础制取氯气等产品, 氯气是实验室和工业上的常用气体。请回答:(1)、电解饱和食盐水制取氯气的化学方程式是。(2)、下列说法错误的是______。A、可采用碱石灰干燥氯气 B、可通过排饱和食盐水法收集氯气 C、常温下,可通过加压使氯气液化而储存于钢瓶中 D、工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸(3)、在一定温度下,氯气溶于水的过程及其平衡常数为:
(5)、无水NaHCO3可作为基准物质标定盐酸浓度.称量前,若无水NaHCO3保存不当,吸收了一定量水分,用其标定盐酸浓度时,会使结果___(填标号)。A、偏高 B、偏低 不变30. “氯碱工业”以电解饱和食盐水为基础制取氯气等产品, 氯气是实验室和工业上的常用气体。请回答:(1)、电解饱和食盐水制取氯气的化学方程式是。(2)、下列说法错误的是______。A、可采用碱石灰干燥氯气 B、可通过排饱和食盐水法收集氯气 C、常温下,可通过加压使氯气液化而储存于钢瓶中 D、工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸(3)、在一定温度下,氯气溶于水的过程及其平衡常数为:Cl2(g)⇌Cl2(aq) K1=c(Cl2)/p
Cl2(aq) + H2O(l)⇌H+ (aq)+Cl- (aq) + HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)⇌Cl2(aq)的焓变ΔH10。(填”>”、“=”或“<”)
②平衡常数K2的表达式为K2=。
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=。(用平衡压强p和上述平衡常数表示,忽略HClO的电离)
(4)、工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4 , 相应的化学方程式为;I.TiO2(s)+2Cl2(g)⇌TiCl4(g)+O2(g) ΔHI=181 mol·L-1 , KI=-3.4×10-29
II.2C(s)+O2(g)⇌2CO(g) ΔHII= - 221 mol·L-1 , KII=1.2×1048
结合数据说明氯化过程中加碳的理由 。
(5)、在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5 mol·L-1 , 反应30 min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是______。A、适当提高反应温度 B、改变催化剂 C、适当降低反应温度 D、改变反应物浓度