【高考真题】2023年北京市高考真题化学试题
试卷更新日期:2023-07-20 类型:高考真卷
一、单选题(本大题共14小题,共42.0分)
-
1. 中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
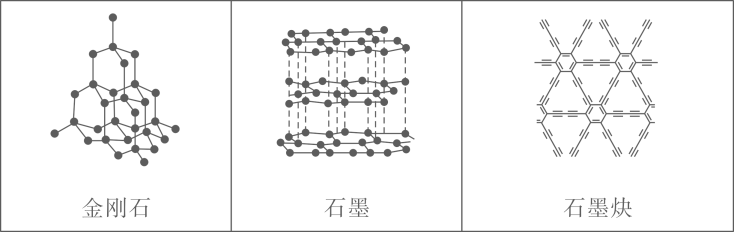
下列关于金刚石、石墨、石墨炔的说法正确的是( )
A、三种物质中均有碳碳原子间的键 B、三种物质中的碳原子都是杂化 C、三种物质的晶体类型相同 D、三种物质均能导电2. 下列化学用语或图示表达正确的是( )A、的电子式为 B、的模型为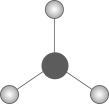 C、电子云图为
C、电子云图为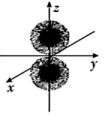 D、基态原子的价层电子轨道表示式为
D、基态原子的价层电子轨道表示式为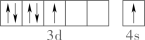 3. 下列过程与水解反应无关的是( )A、热的纯碱溶液去除油脂 B、重油在高温、高压和催化剂作用下转化为小分子烃 C、蛋白质在酶的作用下转化为氨基酸 D、向沸水中滴入饱和溶液制备胶体4. 下列事实能用平衡移动原理解释的是( )A、溶液中加入少量固体,促进分解 B、密闭烧瓶内的和的混合气体,受热后颜色加深 C、铁钉放入浓中,待不再变化后,加热能产生大量红棕色气体 D、锌片与稀反应过程中,加入少量固体,促进的产生5. 回收利用工业废气中的和 , 实验原理示意图如下。
3. 下列过程与水解反应无关的是( )A、热的纯碱溶液去除油脂 B、重油在高温、高压和催化剂作用下转化为小分子烃 C、蛋白质在酶的作用下转化为氨基酸 D、向沸水中滴入饱和溶液制备胶体4. 下列事实能用平衡移动原理解释的是( )A、溶液中加入少量固体,促进分解 B、密闭烧瓶内的和的混合气体,受热后颜色加深 C、铁钉放入浓中,待不再变化后,加热能产生大量红棕色气体 D、锌片与稀反应过程中,加入少量固体,促进的产生5. 回收利用工业废气中的和 , 实验原理示意图如下。
下列说法不正确的是( )
A、废气中排放到大气中会形成酸雨 B、装置中溶液显碱性的原因是的水解程度大于的电离程度 C、装置中溶液的作用是吸收废气中的和 D、装置中的总反应为6. 下列离子方程式与所给事实不相符的是( )A、制备消毒液主要成分是: B、食醋去除水垢中的: C、利用覆铜板制作印刷电路板: D、去除废水中的:7. 蔗糖与浓硫酸发生作用的过程如图所示。
下列关于该过程的分析不正确的是( )
A、过程白色固体变黑,主要体现了浓硫酸的脱水性 B、过程固体体积膨胀,与产生的大量气体有关 C、过程中产生能使品红溶液褪色的气体,体现了浓硫酸的酸性 D、过程中蔗糖分子发生了化学键的断裂8. 完成下述实验,装置或试剂不正确的是( )实验室制
实验室收集
验证易溶于水且溶液呈碱性
除去中混有的少量
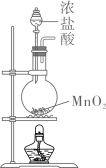
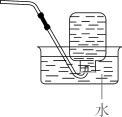
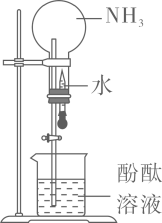
 A、 B、 C、 D、9. 一种聚合物的结构简式如下,下列说法不正确的是( )
A、 B、 C、 D、9. 一种聚合物的结构简式如下,下列说法不正确的是( )
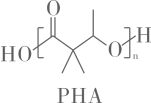 A、的重复单元中有两种官能团 B、可通过单体
A、的重复单元中有两种官能团 B、可通过单体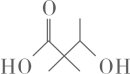 缩聚合成
C、在碱性条件下可发生降解
D、中存在手性碳原子
10. 下列事实不能通过比较氟元素和氯元素的电负性进行解释的是( )A、键的键能小于键的键能 B、三氟乙酸的大于三氯乙酸的 C、氟化氢分子的极性强于氯化氢分子的极性 D、气态氟化氢中存在 , 而气态氯化氢中是分子11. 化合物与反应可合成药物中间体 , 转化关系如下。
缩聚合成
C、在碱性条件下可发生降解
D、中存在手性碳原子
10. 下列事实不能通过比较氟元素和氯元素的电负性进行解释的是( )A、键的键能小于键的键能 B、三氟乙酸的大于三氯乙酸的 C、氟化氢分子的极性强于氯化氢分子的极性 D、气态氟化氢中存在 , 而气态氯化氢中是分子11. 化合物与反应可合成药物中间体 , 转化关系如下。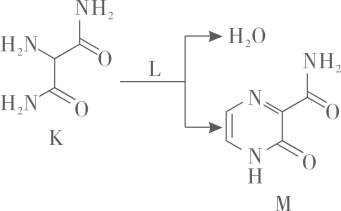
已知能发生银镜反应,下列说法正确的是( )
A、的核磁共振氢谱有两组峰 B、是乙醛 C、完全水解可得到和 D、反应物与的化学计量比是12. 离子化合物和与水的反应分别为;。下列说法正确的是( )A、中均有非极性共价键 B、中水发生氧化反应,中水发生还原反应 C、中阴、阳离子个数比为 , 中阴、阳离子个数比为 D、当反应和中转移的电子数相同时,产生的和的物质的量相同13. 一种分解氯化铵实现产物分离的物质转化关系如下,其中代表或中的一种。下列说法正确的是( )
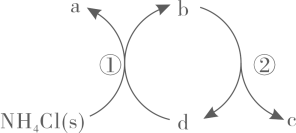 A、、分别是 B、既可以是 , 也可以是 C、已知为副产物,则通入水蒸气可减少的产生 D、等压条件下,反应、的反应热之和,小于氯化铵直接分解的反应热14. 利用平衡移动原理,分析一定温度下在不同的体系中的可能产物。
A、、分别是 B、既可以是 , 也可以是 C、已知为副产物,则通入水蒸气可减少的产生 D、等压条件下,反应、的反应热之和,小于氯化铵直接分解的反应热14. 利用平衡移动原理,分析一定温度下在不同的体系中的可能产物。已知:图中曲线表示体系中各含碳粒子的物质的量分数与的关系。
图中曲线Ⅰ的离子浓度关系符合;曲线Ⅱ的离子浓度关系符合注:起始 , 不同下由图得到。
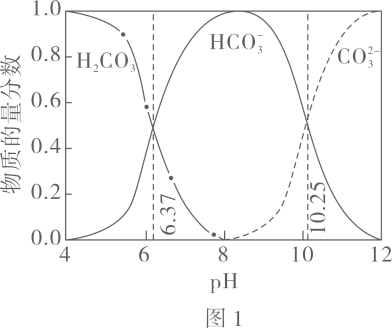
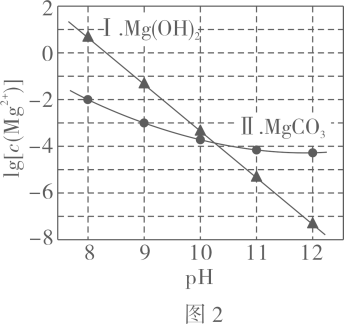
下列说法不正确的是( )
A、由图 , B、由图 , 初始状态 , 无沉淀生成 C、由图 , 初始状态 , 平衡后溶液中存在 D、由图和图 , 初始状态、 , 发生反应:二、流程题(本大题共1小题,共13.0分)
-
15. 以银锰精矿主要含、、和氧化锰矿主要含为原料联合提取银和锰的一种流程示意图如下。
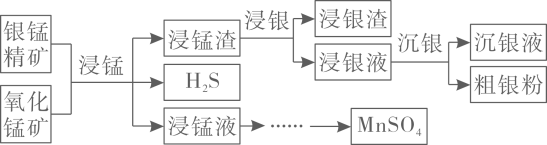
已知:酸性条件下,的氧化性强于。
(1)、“浸锰”过程是在溶液中使矿石中的锰元素浸出,同时去除 , 有利于后续银的浸出;矿石中的银以的形式残留于浸锰渣中。“浸锰”过程中,发生反应 , 则可推断:填“”或“”。
在溶液中,银锰精矿中的和氧化锰矿中的发生反应,则浸锰液中主要的金属阳离子有。
(2)、“浸银”时,使用过量和的混合液作为浸出剂,将中的银以形式浸出。将“浸银”反应的离子方程式补充完整:
结合平衡移动原理,解释浸出剂中的作用:。
(3)、“沉银”过程中需要过量的铁粉作为还原剂。该步反应的离子方程式有。
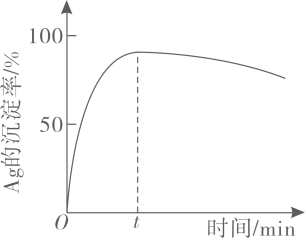
一定温度下,的沉淀率随反应时间的变化如图所示。解释分钟后的沉淀率逐渐减小的原因:。
 (4)、结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优势:。
(4)、结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优势:。三、实验题(本大题共1小题,共14.0分)
-
16. 资料显示,可以将氧化为。某小组同学设计实验探究被氧化的产物及铜元素的价态。
已知:易溶于溶液,发生反应红棕色;和氧化性几乎相同。
(1)、将等体积的溶液加入到铜粉和的固体混合物中,振荡。实验记录如下:
实验现象
实验Ⅰ
极少量溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色
实验Ⅱ
部分溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色
实验Ⅲ
完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色
初始阶段,被氧化的反应速率:实验Ⅰ填“”“”或“”实验Ⅱ。
实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有蓝色或无色 , 进行以下实验探究:
步骤取实验Ⅲ的深红棕色溶液,加入 , 多次萃取、分液。
步骤取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
步骤的目的是。
查阅资料, , 无色容易被空气氧化。用离子方程式解释步骤的溶液中发生的变化:。
结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是 , 实验Ⅰ中铜被氧化的化学方程式是。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓溶液,填实验现象 , 观察到少量红色的铜。分析铜未完全反应的原因是。
(2)、上述实验结果,仅将氧化为价。在隔绝空气的条件下进行电化学实验,证实了能将氧化为。装置如图所示,分别是。 (3)、运用氧化还原反应规律,分析在上述实验中被氧化的产物中价态不同的原因:。
(3)、运用氧化还原反应规律,分析在上述实验中被氧化的产物中价态不同的原因:。四、简答题(本大题共2小题,共19.0分)
-
17. 硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根可看作是中的一个原子被原子取代的产物。(1)、基态原子价层电子排布式是。(2)、比较原子和原子的第一电离能大小,从原子结构的角度说明理由:。(3)、的空间结构是。(4)、同位素示踪实验可证实中两个原子的化学环境不同,实验过程为。过程中,断裂的只有硫硫键,若过程所用试剂是和 , 过程含硫产物是。(5)、的晶胞形状为长方体,边长分别为、 , 结构如图所示。

晶胞中的个数为。已知的摩尔质量是 , 阿伏加德罗常数为 , 该晶体的密度为。
(6)、浸金时,作为配体可提供孤电子对与形成。分别判断中的中心原子和端基原子能否做配位原子并说明理由:。18. 尿素合成的发展体现了化学科学与技术的不断进步。(1)、十九世纪初,用氰酸银与在一定条件下反应制得 , 实现了由无机物到有机物的合成。该反应的化学方程式是 。(2)、二十世纪初,工业上以和为原料在一定温度和压强下合成尿素。反应分两步:和生成;
分解生成尿素。

结合反应过程中能量变化示意图,下列说法正确的是填序号。
活化能:反应反应
为放热反应,为吸热反应
(3)、近年研究发现,电催化和含氮物质等在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的溶液通至饱和,在电极上反应生成 , 电解原理如图所示。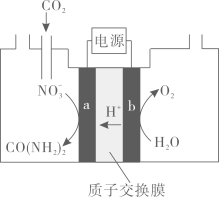
电极是电解池的极。
电解过程中生成尿素的电极反应式是。
(4)、尿素样品含氮量的测定方法如下。已知:溶液中不能直接用溶液准确滴定。

消化液中的含氮粒子是。
步骤中标准溶液的浓度和消耗的体积分别为和 , 计算样品含氮量还需要的实验数据有。
五、推断题(本大题共1小题,共12.0分)
-
19. 化合物是合成抗病毒药物普拉那韦的原料,其合成路线如下。
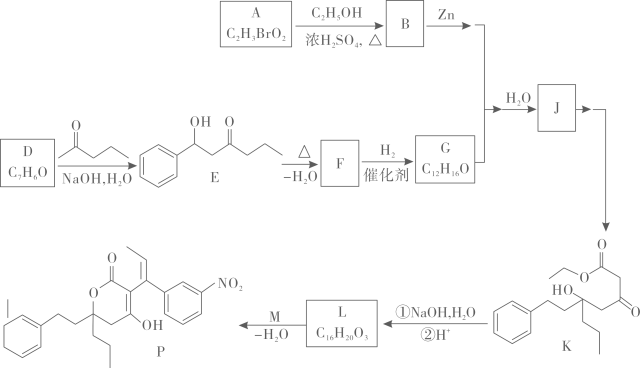
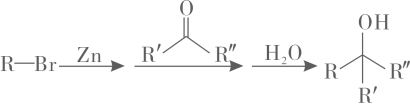
已知:
 (1)、A中含有羧基,的化学方程式是。(2)、D中含有的官能团是。(3)、关于的反应:
(1)、A中含有羧基,的化学方程式是。(2)、D中含有的官能团是。(3)、关于的反应: 的羰基相邻碳原子上的键极性强,易断裂,原因是。
的羰基相邻碳原子上的键极性强,易断裂,原因是。该条件下还可能生成一种副产物,与互为同分异构体。该副产物的结构简式是。
(4)、下列说法正确的是填序号。存在顺反异构体
和互为同系物
在加热和催化条件下,不能被氧化
(5)、L分子中含有两个六元环。的结构简式是。(6)、已知: , 依据的原理,和反应得到了。的结构简式是。
, 依据的原理,和反应得到了。的结构简式是。
-
-