江苏省扬州市2023年中考化学真题
试卷更新日期:2023-07-20 类型:中考真卷
一、单选题
-
1. 下列是我国“国家最高科学技术奖”几位获得者及其部分研究领域,其中研究领域主要涉及具有优良性能导电材料开发的是( )A、闵恩泽,石油化工催化剂研究 B、师昌绪,材料腐蚀研究 C、赵忠贤,高温超导材料研究 D、张存浩,高能化学激光研究2. 保存珍贵文物可用空气中含量最多的气体,该气体的化学式为( )A、N2 B、O2 C、CO2 D、H2O3. 绿色植物通过光合作用将气体X与H2O转化为葡萄糖与O2 , 气体X是( )A、N2 B、Ar C、CO2 D、SO24. 用手触摸生活中的碱性溶液时常有滑腻感。下列溶液显碱性的是( )A、食盐水 B、肥皂水 C、蔗糖溶液 D、食醋5. 重氢可应用于光导纤维制备。重氢和氢都属于氢元素,是因为它们的原子具有相同的( )A、质子数 B、中子数 C、体积 D、相对原子质量6. 关于某可再生能源的描述如下:该能源储量巨大,但阴雨天等因素会影响其使用。如图为该能源在生活中的运用。该能源是( )
 A、地热能 B、太阳能 C、水能 D、化石燃料7. 下列属于分解反应的是( )A、 B、 C、 D、8. Y是生活中常见的物质,完全燃烧的化学方程式为。Y的化学式为( )A、CH4O B、C2H4 C、C3H8 D、C2H6O9. 化学肥料中通常含有N、P、K等元素。下列属于复合肥料的是( )A、KH2PO4 B、K2SO4 C、NH4HCO3 D、CO(NH2)210. 《天工开物》记载“泥瓦罐载铜十斤,继入炉甘石六斤……,即成黄铜”。炉甘石的主要成分为ZnCO3 , ZnCO3属于( )A、氧化物 B、酸 C、碱 D、盐11. 构成物质的微粒有分子、原子、离子等。下列物质由离子构成的是( )A、
A、地热能 B、太阳能 C、水能 D、化石燃料7. 下列属于分解反应的是( )A、 B、 C、 D、8. Y是生活中常见的物质,完全燃烧的化学方程式为。Y的化学式为( )A、CH4O B、C2H4 C、C3H8 D、C2H6O9. 化学肥料中通常含有N、P、K等元素。下列属于复合肥料的是( )A、KH2PO4 B、K2SO4 C、NH4HCO3 D、CO(NH2)210. 《天工开物》记载“泥瓦罐载铜十斤,继入炉甘石六斤……,即成黄铜”。炉甘石的主要成分为ZnCO3 , ZnCO3属于( )A、氧化物 B、酸 C、碱 D、盐11. 构成物质的微粒有分子、原子、离子等。下列物质由离子构成的是( )A、 氧气
B、
氧气
B、 水
C、
水
C、 氯化钠
D、
氯化钠
D、 金刚石
12. 在实验室中进行下列实验,其中实验方案设计正确且能达到实验目的的是( )
金刚石
12. 在实验室中进行下列实验,其中实验方案设计正确且能达到实验目的的是( )选项
实验目的
实验方案
A
鉴别CO和O2
将两种气体分别通入澄清石灰水
B
除去粗盐中的CaCl2
将粗盐用足量水溶解,过滤
C
测定溶液的pH
将湿润的pH试纸浸入溶液中,取出,与标准比色卡对照
D
制备O2
向装有少量MnO2的锥形瓶中慢慢加入稀H2O2溶液
A、A B、B C、C D、D13. 下列物质性质和用途对应关系正确的是( )A、活性炭有吸附性,可用作除味剂 B、铝有导热性,可用于制电线 C、石墨有导电性,可用作润滑剂 D、盐酸有挥发性,可用于除铁锈14. 实验室量取40.0mLNaCl溶液时,可供选用的仪器如图所示,应选择的仪器及原因均正确的是( ) A、50mL烧杯,因为烧杯放置于桌面时更稳定,不易翻倒 B、50mL烧杯,因为烧杯的杯口较大,便于加入溶液 C、50mL量筒,因为量筒量取液体体积更精准 D、50mL量筒,因为量筒操作时便于手握15. 俗名往往反映了物质的组成、性质或用途。下列对物质俗名的理解正确的是( )A、烧碱:NaOH具有可燃性 B、食盐:NaCl可用作食品调味剂 C、水银:汞(Hg)是液态的银(Ag) D、干冰:干净无杂质的冰16. KNO3和NaCl的溶解度曲线如图所示。下列说法正确的是( )
A、50mL烧杯,因为烧杯放置于桌面时更稳定,不易翻倒 B、50mL烧杯,因为烧杯的杯口较大,便于加入溶液 C、50mL量筒,因为量筒量取液体体积更精准 D、50mL量筒,因为量筒操作时便于手握15. 俗名往往反映了物质的组成、性质或用途。下列对物质俗名的理解正确的是( )A、烧碱:NaOH具有可燃性 B、食盐:NaCl可用作食品调味剂 C、水银:汞(Hg)是液态的银(Ag) D、干冰:干净无杂质的冰16. KNO3和NaCl的溶解度曲线如图所示。下列说法正确的是( ) A、KNO3的溶解度比NaCl大 B、将室温下KNO3的饱和溶液升高温度,溶液仍饱和 C、KNO3和NaCl均属于难溶物质 D、除去KNO3中少量NaCl可用冷却热饱和溶液结晶的方法17. 下列对实验现象的解释不正确的是( )
A、KNO3的溶解度比NaCl大 B、将室温下KNO3的饱和溶液升高温度,溶液仍饱和 C、KNO3和NaCl均属于难溶物质 D、除去KNO3中少量NaCl可用冷却热饱和溶液结晶的方法17. 下列对实验现象的解释不正确的是( )选项
实验现象
解释
A
将50mL水和50mL酒精混合,总体积小于100mL
分子之间有空隙
B
向锌粒中加入稀硫酸,产生气泡
金属均能与酸反应产生H2
C
将黄铜片和铜片相互刻画,铜片表面有明显划痕
合金的硬度往往比其成分金属大
D
铁丝在空气中不能燃烧,在氧气中可以燃烧
氧气的浓度对物质的燃烧有影响
A、A B、B C、C D、D18. Ca(OH)2与H2O2溶液反应可制备CaO2。反应过程包括:步骤—: , 其中O代表氧原子;
步骤二:主要发生 , 少量发生。
下列说法不正确的是( )
A、为增大反应混合物中Ca(OH)2的含量,应使用石灰乳而非石灰水 B、生成CaO2的总反应为 C、增加Ca(OH)2的用量,可以消耗更多O,减少O2的生成 D、制备时反应每生成72gCaO2 , 同时生成32gO2二、选择题组
-
19. 阅读下列材料,完成下面小题。
有机物DMF是一种水污染物,在疏松多孔Al2O3的催化下,O3先将其转化为小分子化合物,最终降解为CO2而去除。制备O3时,将O2通过臭氧发生器,O2部分转化为O3 , 得到O3与O2的混合气体。为研究Al2O3和O3对DMF的去除效果,取四份DMF溶液,控制其他条件相同,分别进行四个实验:①向溶液中通入O3与O2的混合气体并加入Al2O3;②向溶液中通入O3与O2的混合气体;③向溶液中加入Al2O3;④向溶液中通入O2并加入Al2O3。
(1)、O2通过臭氧发生器转化为O3 , 反应前后发生变化的是( )A、原子总数 B、分子种类 C、元素种类 D、物质的总质量(2)、实验进行20min时,测得实验①、②溶液中DMF的含量几乎为0,实验③、④溶液中DMF的含量略有下降。同时测得四个实验中碳元素的去除率ac()随时间的变化如图所示。下列说法不正确的是( )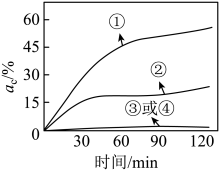 A、Al2O3可能对DMF有微弱的吸附作用 B、实验条件下,O2不能有效降解DMF C、实验①和②进行20min时,DMF部分转化为CO2逸出 D、实验④是为了排除实验①中O2的影响,实验④中O2可用N2代替
A、Al2O3可能对DMF有微弱的吸附作用 B、实验条件下,O2不能有效降解DMF C、实验①和②进行20min时,DMF部分转化为CO2逸出 D、实验④是为了排除实验①中O2的影响,实验④中O2可用N2代替三、填空题
-
20. 扬州是国家首批历史文化名城,有着深厚的文化积淀。(1)、扬州漆器,隽秀精致的艺术。

①制作漆器使用的生漆中含有C21H32O2。C21H32O2中C、H、O元素的质量比为。
②朱漆由生漆和红色硫化汞(HgS)调和而成。Hg和硫磺(S8)加热化合可生成HgS,该反应的化学方程式为。朱漆经调和后,需透过细纱布,以除去其中较大的固体颗粒,该操作的名称为。
(2)、扬州厨刀,心手相应的艺术。①新购的厨刀表面往往涂有一层油膜,目的是。
②厨刀的材质多为钢,钢属于(填序号)。
A.金属材料 B.合成材料 C.复合材料
③“文思豆腐”刀工精细、根根分明。豆腐中含有丰富的营养物质,其中含量较多的某有机物可转化为氨基酸,该有机物的名称为。
(3)、扬州铜镜,精美华贵的艺术。①扬州是唐代铸镜中心城市之一。制作唐镜的主要材料为铜锡铅合金,该合金比纯铜更易熔炼,原因是。
②唐镜表面有一层耐腐蚀的二氧化锡(SnO2)。SnO2是由SnO在空气中受热生成,该反应的化学方程式为。
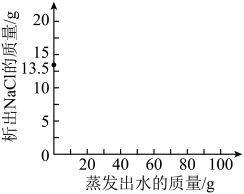
21. 水是宝贵的资源。(1)、电解水可以得到H2和O2 , H2在O2中燃烧可以生成水,这两个实验说明组成水的元素是(填元素符号)。电解水时生成H2与O2的体积比约为。(2)、水能够溶解许多物质。下列观点正确的是____。A、自然界不存在“绝对纯净”的水 B、水易溶解许多物质,因而水也易被污染 C、在自然界中,不同状态的水处于不断循环中 D、地下水是重要的淡水资源,可持续不断大量开采(3)、①溶液的浓度可以用质量分数表示,如医疗上常使用10%的葡萄糖溶液,10%的含义为100g溶液中含葡萄糖的质量为10g。根据不同的需要,浓度还有其他表示方法,如国家关于酿造食醋的标准规定:食醋中的总酸(以醋酸计)含量应≥3.5g/100mL。该浓度的含义为。②取100g质量分数为13.5%的NaCl溶液,温度保持60℃,蒸发水分至NaCl完全析出。在图中画出析出NaCl的质量与蒸发出水质量的关系(已知60℃时NaCl的溶解度约为37g)。
 (4)、人体内的 , 可能会转化为 , 不利于O2在体内的运输。将含有NaNO3的水煮沸,不能除去 , 原因是(填两点)。(5)、自来水厂常用加消毒剂的方法去除水中的细菌等微生物。经处理,微生物含量达标后,国家标准规定自来水出厂时仍需留有一定浓度的消毒剂,原因是。(6)、联合国将每年的3月22日定为“世界水日”。2023年的主题是“加速变革”,呼吁加快落实保护并合理利用水资源的措施,以应对全球淡水资源匮乏的挑战。请写出家庭中可采取的一个节水措施:。22. CO2可用于灭火。(1)、①实验室用块状石灰石和稀盐酸制备CO2 , 该反应的化学方程式为。不使用块状石灰石和稀硫酸制备CO2 , 原因是。(已知CaSO4微溶于水。)
(4)、人体内的 , 可能会转化为 , 不利于O2在体内的运输。将含有NaNO3的水煮沸,不能除去 , 原因是(填两点)。(5)、自来水厂常用加消毒剂的方法去除水中的细菌等微生物。经处理,微生物含量达标后,国家标准规定自来水出厂时仍需留有一定浓度的消毒剂,原因是。(6)、联合国将每年的3月22日定为“世界水日”。2023年的主题是“加速变革”,呼吁加快落实保护并合理利用水资源的措施,以应对全球淡水资源匮乏的挑战。请写出家庭中可采取的一个节水措施:。22. CO2可用于灭火。(1)、①实验室用块状石灰石和稀盐酸制备CO2 , 该反应的化学方程式为。不使用块状石灰石和稀硫酸制备CO2 , 原因是。(已知CaSO4微溶于水。)②下列仪器中,制备并收集CO2时需选用的是(填序号),仪器E的名称为。

③下列干燥剂中,可用于干燥CO2的是(填序号)。
A.碱石灰 B.浓硫酸 C.氢氧化钠固体
(2)、如图—1所示,向燃烧器内通入CH4和空气,点燃,待火焰稳定后,再从进口A分别通入CO2、N2、He,改变通入的三种气体用量,测得火焰刚好熄灭时,通入的CO2、N2、He在混合器中的体积分数如下表所示。气体
CO2
N2
He
体积分数/%
17.65
27.15
23.84
三种气体中灭火效果最好的是(填化学式)。
 (3)、研究KHCO3与CO2联合使用时的灭火效果。
(3)、研究KHCO3与CO2联合使用时的灭火效果。①KHCO3灭火的原理较复杂。KHCO3受热分解时吸收能量,反应的化学方程式为。以初中所学燃烧和灭火的原理分析,KHCO3可用于灭火的原因有。
②向燃烧器内通入CH4和空气,点燃,待火焰稳定后,从进口A通入CO2 , 进口B加入KHCO3粉末。控制其他条件不变,测得火焰刚好熄灭时,KHCO3的用量与混合器中通入的CO2体积分数的关系如图—2所示。CO2体积分数在8%~10%内,随CO2体积分数的增加,使火焰熄灭所需的KHCO3用量不再减少,且燃烧器内残留的KHCO3增多,原因是。
四、综合应用题
-
23. 某酸性含铜废水(主要含CuCl2 , 还有少量HCl)有多种处理方法。(1)、方法一:向废水中加入过量铁粉,充分反应,过滤,将所得金属回收处理得产品。
①加入铁粉的目的是(用化学方程式表示)。过程中还会产生一种气体,其化学式为。
②过滤所得金属的成分是(填化学式)。
(2)、方法二:向废水中加入一定量的Na2CO3溶液,在70℃条件下充分反应,得碱式碳酸铜。①加入Na2CO3溶液后,废水的pH(填“增大”“不变”或“减小”)。
②碱式碳酸铜有多种组成,可表示为Cu(OH)x(CO3)y , x和y需满足的关系式为。
③若反应温度过高,会生成一种黑色固体。该固体可能是(填化学式)。
(3)、方法三:用生石灰或石灰石调节废水的pH。向1L废水中分别加入两种物质,测得废水的pH随加入固体质量的变化如图所示。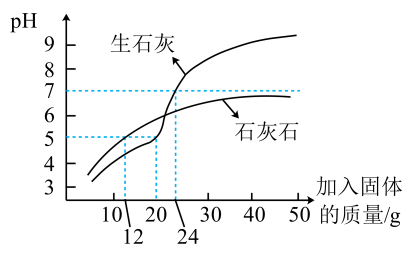
①生石灰与水反应的产物是(填化学式)。
②加入石灰石调节废水的pH,溶液的pH始终小于7,原因是。
③每吨生石灰的价格约为460元,每吨石灰石的价格约为130元。联合使用生石灰和石灰石,将这两种物质先后加入1L废水,调节废水的pH至约为7,经济效益较好的可行方案为。
24. 以工业副产品石膏(主要成分是CaSO4)为原料可制备CaCO3。CaCO3有球霰石、方解石等多种形态,其中球霰石广泛应用于油墨、生物材料等领域。(1)、制备CaCO3时,将石膏与水配成悬浊液,再向其中通入NH3、CO2(不考虑石膏中杂质的反应)。①配制悬浊液时,保持温度不变,为使石膏充分分散在水中,可采取的措施是、。(填两点)
②制备时温度不宜过高,原因是。
③制备可看作是(NH4)2CO3与CaSO4发生复分解反应,(NH4)2CO3与CaSO4反应生成CaCO3的化学方程式为。理论上参加反应的CO2与NH3的质量比为。
④若石膏中CaSO4的质量分数为85%,取160g石膏进行反应,计算理论上可制得CaCO3的质量(写出计算过程)。
(2)、反应生成的CaCO3中球霰石与方解石的质量分数与反应时间的关系如图—1所示。由图示信息得出的结论是。 (3)、反应时加入某表面活性剂可增加产物中球霰石的含量。该表面活性剂一端带正电荷,另一端为排斥水分子的疏水基团,可与球霰石形成两种吸附作用,如图—2所示。
(3)、反应时加入某表面活性剂可增加产物中球霰石的含量。该表面活性剂一端带正电荷,另一端为排斥水分子的疏水基团,可与球霰石形成两种吸附作用,如图—2所示。①两种吸附分别为离子对吸附和离子交换吸附。离子对吸附:球霰石表面的带负电,表面活性剂通过带正电的一端吸附于球霰石表面;离子交换吸附:球霰石表面的Ca2+带正电,表面活性剂中带正电的一端可取代球霰石表面的Ca2+ , 并吸附于球霰石表面。图—2中表示离子对吸附的是(填“A”或“B”)。
②有研究认为,球霰石转化为方解石经历了球霰石溶解、再沉淀为方解石的过程。表面活性剂能增加产物中球霰石的含量,原因是。
-