【高考真题】2023年广东省高考真题化学试题
试卷更新日期:2023-07-17 类型:高考真卷
一、单选题
-
1. “高山流水觅知音”。下列中国古乐器中,主要由硅酸盐材料制成的是( )




A.九霄环佩木古琴
B.裴李岗文化骨笛
C.商朝后期陶埙
D.曾侯乙青铜编钟
A、A B、B C、C D、D2. 科教兴国,“可上九天揽月,可下五洋捉鳖”。下列说法正确的是( )A、“天舟六号”为中国空间站送去推进剂气,是第族元素 B、火星全球影像彩图显示了火星表土颜色,表土中赤铁矿主要成分为 C、创造了可控核聚变运行纪录的“人造太阳”,其原料中的与互为同位素 D、“深地一号”为进军万米深度提供核心装备,制造钻头用的金刚石为金属晶体3. 建设美丽乡村,守护中华家园,衣食住行皆化学。下列说法正确的是( )A、千家万户通光纤,光纤的主要材质为 B、乡村公路铺沥青,沥青属于天然无机材料 C、美容扮靓迎佳节,化妆品中的甘油难溶于水 D、均衡膳食助健康,主食中的淀粉可水解为葡萄糖4. 1827年,英国科学家法拉第进行了喷泉实验。在此启发下,兴趣小组利用以下装置,进行如下实验。其中,难以达到预期目的的是( ) A、图1:喷泉实验 B、图2:干燥 C、图3:收集 D、图4:制备5. 化学处处呈现美。下列说法正确的是( )A、舞台上干冰升华时,共价键断裂 B、饱和溶液可析出无水蓝色晶体 C、苯分子的正六边形结构,单双键交替呈现完美对称 D、晨雾中的光束如梦如幻,是丁达尔效应带来的美景6. 负载有和的活性炭,可选择性去除实现废酸的纯化,其工作原理如图。下列说法正确的是( )
A、图1:喷泉实验 B、图2:干燥 C、图3:收集 D、图4:制备5. 化学处处呈现美。下列说法正确的是( )A、舞台上干冰升华时,共价键断裂 B、饱和溶液可析出无水蓝色晶体 C、苯分子的正六边形结构,单双键交替呈现完美对称 D、晨雾中的光束如梦如幻,是丁达尔效应带来的美景6. 负载有和的活性炭,可选择性去除实现废酸的纯化,其工作原理如图。下列说法正确的是( )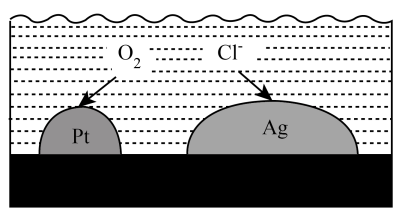 A、作原电池正极 B、电子由经活性炭流向 C、表面发生的电极反应: D、每消耗标准状况下的 , 最多去除7. 劳动有利于“知行合一”。下列劳动项目与所述的化学知识没有关联的是( )
A、作原电池正极 B、电子由经活性炭流向 C、表面发生的电极反应: D、每消耗标准状况下的 , 最多去除7. 劳动有利于“知行合一”。下列劳动项目与所述的化学知识没有关联的是( )选项
劳动项目
化学知识
A
帮厨活动:帮食堂师傅煎鸡蛋准备午餐
加热使蛋白质变性
B
环保行动:宣传使用聚乳酸制造的包装材料
聚乳酸在自然界可生物降解
C
家务劳动:擦干已洗净的铁锅,以防生锈
铁丝在中燃烧生成
D
学农活动:利用秸秆、厨余垃圾等生产沼气
沼气中含有的可作燃料
A、A B、B C、C D、D8. 2022年诺贝尔化学奖授予研究“点击化学”的科学家。图所示化合物是“点击化学”研究中的常用分子。关于该化合物,说法不正确的是( )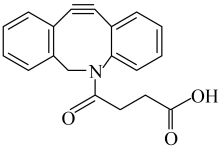 A、能发生加成反应 B、最多能与等物质的量的反应 C、能使溴水和酸性溶液褪色 D、能与氨基酸和蛋白质中的氨基反应9. 按图装置进行实验。将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是( )
A、能发生加成反应 B、最多能与等物质的量的反应 C、能使溴水和酸性溶液褪色 D、能与氨基酸和蛋白质中的氨基反应9. 按图装置进行实验。将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是( )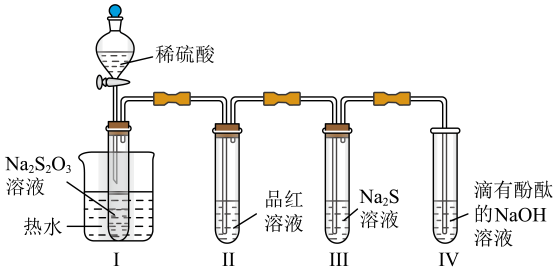 A、Ⅰ中试管内的反应,体现的氧化性 B、Ⅱ中品红溶液褪色,体现的还原性 C、在Ⅰ和Ⅲ的试管中,都出现了浑浊现象 D、撤掉水浴,重做实验,Ⅳ中红色更快褪去10. 部分含或含物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A、Ⅰ中试管内的反应,体现的氧化性 B、Ⅱ中品红溶液褪色,体现的还原性 C、在Ⅰ和Ⅲ的试管中,都出现了浑浊现象 D、撤掉水浴,重做实验,Ⅳ中红色更快褪去10. 部分含或含物质的分类与相应化合价关系如图所示。下列推断不合理的是( ) A、可存在c→d→e的转化 B、能与反应生成c的物质只有b C、新制的d可用于检验葡萄糖中的醛基 D、若b能与反应生成 , 则b中含共价键11. 设为阿伏加德罗常数的值。侯氏制碱法涉及和等物质。下列叙述正确的是( )A、含有的共价键数目为 B、完全分解,得到的分子数目为 C、体积为的溶液中,数目为 D、和的混合物中含 , 则混合物中质子数为12. 下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是( )
A、可存在c→d→e的转化 B、能与反应生成c的物质只有b C、新制的d可用于检验葡萄糖中的醛基 D、若b能与反应生成 , 则b中含共价键11. 设为阿伏加德罗常数的值。侯氏制碱法涉及和等物质。下列叙述正确的是( )A、含有的共价键数目为 B、完全分解,得到的分子数目为 C、体积为的溶液中,数目为 D、和的混合物中含 , 则混合物中质子数为12. 下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是( )选项
陈述Ⅰ
陈述Ⅱ
A
将浓硫酸加入蔗糖中形成多孔炭
浓硫酸具有氧化性和脱水性
B
装有的密闭烧瓶冷却后颜色变浅
转化为的反应吸热
C
久置空气中的漂白粉遇盐酸产生
漂白粉的有效成分是
D
溶液导电性比同浓度醋酸强
溶液的比醋酸的高
A、A B、B C、C D、D13. 利用活性石墨电极电解饱和食盐水,进行如图所示实验。闭合 , 一段时间后( )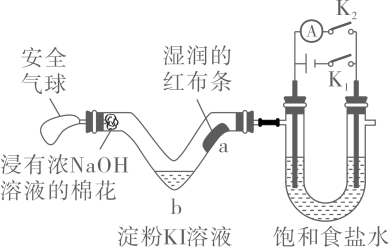 A、U型管两侧均有气泡冒出,分别是和 B、a处布条褪色,说明具有漂白性 C、b处出现蓝色,说明还原性: D、断开 , 立刻闭合 , 电流表发生偏转14. 化合物可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为 , X与M同周期,E在地壳中含量最多。下列说法正确的是( )A、元素电负性: B、氢化物沸点: C、第一电离能: D、和的空间结构均为三角锥形15. 催化剂Ⅰ和Ⅱ均能催化反应。反应历程(下图)中,M为中间产物。其它条件相同时,下列说法不正确的是( )
A、U型管两侧均有气泡冒出,分别是和 B、a处布条褪色,说明具有漂白性 C、b处出现蓝色,说明还原性: D、断开 , 立刻闭合 , 电流表发生偏转14. 化合物可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为 , X与M同周期,E在地壳中含量最多。下列说法正确的是( )A、元素电负性: B、氢化物沸点: C、第一电离能: D、和的空间结构均为三角锥形15. 催化剂Ⅰ和Ⅱ均能催化反应。反应历程(下图)中,M为中间产物。其它条件相同时,下列说法不正确的是( )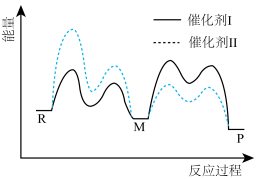 A、使用Ⅰ和Ⅱ,反应历程都分4步进行 B、反应达平衡时,升高温度,R的浓度增大 C、使用Ⅱ时,反应体系更快达到平衡 D、使用Ⅰ时,反应过程中M所能达到的最高浓度更大16. 用一种具有“卯榫”结构的双极膜组装电解池(下图),可实现大电流催化电解溶液制氨。工作时,在双极膜界面处被催化解离成和 , 有利于电解反应顺利进行。下列说法不正确的是( )
A、使用Ⅰ和Ⅱ,反应历程都分4步进行 B、反应达平衡时,升高温度,R的浓度增大 C、使用Ⅱ时,反应体系更快达到平衡 D、使用Ⅰ时,反应过程中M所能达到的最高浓度更大16. 用一种具有“卯榫”结构的双极膜组装电解池(下图),可实现大电流催化电解溶液制氨。工作时,在双极膜界面处被催化解离成和 , 有利于电解反应顺利进行。下列说法不正确的是( )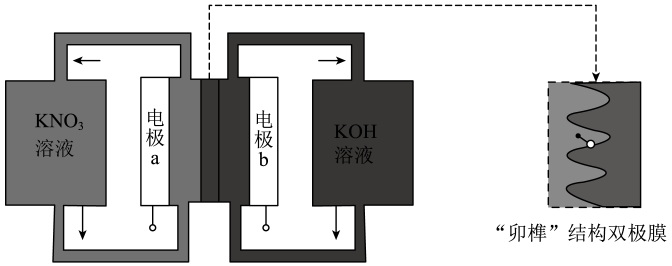 A、电解总反应: B、每生成 , 双极膜处有的解离 C、电解过程中,阳极室中的物质的量不因反应而改变 D、相比于平面结构双极膜,“卯榫”结构可提高氨生成速率
A、电解总反应: B、每生成 , 双极膜处有的解离 C、电解过程中,阳极室中的物质的量不因反应而改变 D、相比于平面结构双极膜,“卯榫”结构可提高氨生成速率二、实验题
-
17. 化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式计算获得。(1)、盐酸浓度的测定:移取待测液,加入指示剂,用溶液滴定至终点,消耗溶液。
①上述滴定操作用到的仪器有。
A.
 B.
B. C.
C. D.
D.
②该盐酸浓度为。
(2)、热量的测定:取上述溶液和盐酸各进行反应,测得反应前后体系的温度值()分别为 , 则该过程放出的热量为(c和分别取和 , 忽略水以外各物质吸收的热量,下同)。(3)、借鉴(2)的方法,甲同学测量放热反应的焓变(忽略温度对焓变的影响,下同)。实验结果见下表。序号
反应试剂
体系温度/
反应前
反应后
i
溶液
粉
a
b
ii
粉
a
c
①温度:bc(填“>”“<”或“=”)。
②(选择表中一组数据计算)。结果表明,该方法可行。
(4)、乙同学也借鉴(2)的方法,测量反应的焓变。查阅资料:配制溶液时需加入酸。加酸的目的是。
提出猜想:粉与溶液混合,在反应A进行的过程中,可能存在粉和酸的反应。
验证猜想:用试纸测得溶液的不大于1;向少量溶液中加入粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和(用离子方程式表示)。
实验小结:猜想成立,不能直接测反应A的焓变。
教师指导:鉴于以上问题,特别是气体生成带来的干扰,需要设计出实验过程中无气体生成的实验方案。
优化设计:乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案为。
(5)、化学能可转化为热能,写出其在生产或生活中的一种应用。三、工业流程题
-
18. 均是重要的战略性金属。从处理后的矿石硝酸浸取液(含)中,利用氨浸工艺可提取 , 并获得高附加值化工产品。工艺流程如下:
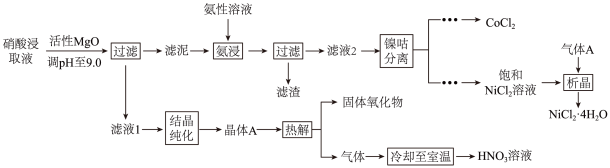
已知:氨性溶液由、和配制。常温下,与形成可溶于水的配离子:;易被空气氧化为;部分氢氧化物的如下表。
氢氧化物
回答下列问题:
(1)、活性可与水反应,化学方程式为。(2)、常温下,的氨性溶液中, (填“>”“<”或“=”)。(3)、“氨浸”时,由转化为的离子方程式为。(4)、会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了的明锐衍射峰。①属于(填“晶体”或“非晶体”)。
②提高了的浸取速率,其原因是。
(5)、①“析晶”过程中通入的酸性气体A为。②由可制备晶体,其立方晶胞如图。与O最小间距大于与O最小间距,x、y为整数,则在晶胞中的位置为;晶体中一个周围与其最近的O的个数为。
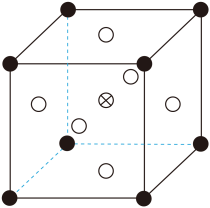 (6)、①“结晶纯化”过程中,没有引入新物质。晶体A含6个结晶水,则所得溶液中与的比值,理论上最高为。
(6)、①“结晶纯化”过程中,没有引入新物质。晶体A含6个结晶水,则所得溶液中与的比值,理论上最高为。②“热解”对于从矿石提取工艺的意义,在于可重复利用和(填化学式)。
四、原理综合题
-
19. 配合物广泛存在于自然界,且在生产和生活中都发挥着重要作用。(1)、某有机物能与形成橙红色的配离子 , 该配离子可被氧化成淡蓝色的配离子。
①基态的电子轨道表示式为。
②完成反应的离子方程式:
(2)、某研究小组对(1)中②的反应进行了研究。用浓度分别为的溶液进行了三组实验,得到随时间t的变化曲线如图。
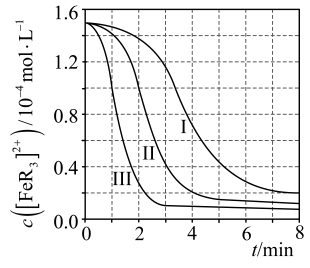
①时,在内,的平均消耗速率=。
②下列有关说法中,正确的有。
A.平衡后加水稀释,增大
B.平衡转化率:
C.三组实验中,反应速率都随反应进程一直减小
D.体系由橙红色转变为淡蓝色所需时间:
(3)、R的衍生物L可用于分离稀土。溶液中某稀土离子(用M表示)与L存在平衡:研究组配制了L起始浓度与L起始浓度比不同的系列溶液,反应平衡后测定其核磁共振氢谱。配体L上的某个特征H在三个物种中的化学位移不同,该特征H对应吸收峰的相对峰面积S(体系中所有特征H的总峰面积计为1)如下表。
0
1.00
0
0
a
x
0.64
b
0.40
0.60
【注】核磁共振氢谱中相对峰面积S之比等于吸收峰对应H的原子数目之比;“”表示未检测到。
①时, 。
②时,平衡浓度比。
(4)、研究组用吸收光谱法研究了(3)中M与L反应体系。当时,测得平衡时各物种随的变化曲线如图。时,计算M的平衡转化率(写出计算过程,结果保留两位有效数字)。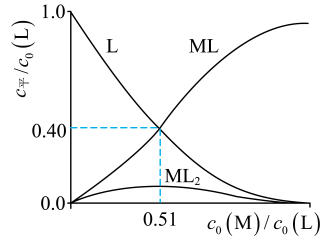
五、有机推断题
-
20. 室温下可见光催化合成技术,对于人工模仿自然界、发展有机合成新方法意义重大。一种基于、碘代烃类等,合成化合物ⅶ的路线如下(加料顺序、反应条件略):
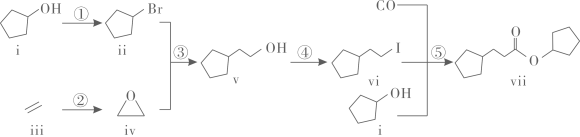 (1)、化合物i的分子式为。化合物x为i的同分异构体,且在核磁共振氢谱上只有2组峰。x的结构简式为(写一种),其名称为。(2)、反应②中,化合物ⅲ与无色无味气体y反应,生成化合物ⅳ,原子利用率为。y为。(3)、根据化合物V的结构特征,分析预测其可能的化学性质,完成下表。
(1)、化合物i的分子式为。化合物x为i的同分异构体,且在核磁共振氢谱上只有2组峰。x的结构简式为(写一种),其名称为。(2)、反应②中,化合物ⅲ与无色无味气体y反应,生成化合物ⅳ,原子利用率为。y为。(3)、根据化合物V的结构特征,分析预测其可能的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
反应类型
a
消去反应
b
氧化反应(生成有机产物)
(4)、关于反应⑤的说法中,不正确的有____。A、反应过程中,有键和键断裂 B、反应过程中,有双键和单键形成 C、反应物i中,氧原子采取杂化,并且存在手性碳原子 D、属于极性分子,分子中存在由p轨道“头碰头”形成的键(5)、以苯、乙烯和为含碳原料,利用反应③和⑤的原理,合成化合物ⅷ。
基于你设计的合成路线,回答下列问题:
(a)最后一步反应中,有机反应物为(写结构简式)。
(b)相关步骤涉及到烯烃制醇反应,其化学方程式为。
(c)从苯出发,第一步的化学方程式为(注明反应条件)。
-
-
-