广东省广州市三校2022-2023学年高二下学期化学期中试卷
试卷更新日期:2023-07-07 类型:期中考试
一、单选题
-
1. 生活中的化学无处不在,下列关于生活中的化学描述错误的是( )A、可以用光谱分析的方法来确定太阳的组成元素是否含氦 B、壁虎在天花板上爬行自如是因为壁虎的脚与墙体之间有范德华力 C、溴和碘单质易溶于四氯化碳难溶于水,因为溴、碘、四氯化碳都是非极性分子 D、水的热稳定性较强是因为水中含有大量的氢键2. “宏、微、符”三重表征是重要的化学学科素养,工业合成尿素的反应:
CO2+2NH3=H2O+CO(NH2)2 , 中,下列相关微粒的化学用语表述正确的是( )
A、中子数为9的氮原子: B、NH3分子空间结构:平面三角形 C、CO(NH2)2的结构简式: D、NH3的电子式:
D、NH3的电子式: 3. 下列物质发生所述变化时,所克服的微粒间作用力,属于同类型的是( )A、干冰和碘的升华 B、NaBr和HI分别在水中电离 C、和CaO的熔化 D、将氯化氢和乙醇分别加入水中4. 下列物质中,既有离子键,又有非极性共价键的化合物是( )A、CaO2 B、H2O2 C、NaOH D、MgCl25. 下列基态原子的最外层电子排布式表示的元素,不一定属于主族元素的是A、 B、 C、 D、6. 利用原子结构及元素周期律表相关知识得到的以下结论中不正确的是( )A、第IA族元素的原子半径: B、基态N原子的轨道表示式:
3. 下列物质发生所述变化时,所克服的微粒间作用力,属于同类型的是( )A、干冰和碘的升华 B、NaBr和HI分别在水中电离 C、和CaO的熔化 D、将氯化氢和乙醇分别加入水中4. 下列物质中,既有离子键,又有非极性共价键的化合物是( )A、CaO2 B、H2O2 C、NaOH D、MgCl25. 下列基态原子的最外层电子排布式表示的元素,不一定属于主族元素的是A、 B、 C、 D、6. 利用原子结构及元素周期律表相关知识得到的以下结论中不正确的是( )A、第IA族元素的原子半径: B、基态N原子的轨道表示式: C、酸性:
D、电负性:
7. 向盛有硫酸铜溶液的试管中加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色透明溶液。下列对此现象的相关说法不正确的是( )A、沉淀溶解后,生成深蓝色的配离子为[Cu(NH3)4]2+ B、向反应后的溶液中加入乙醇,有沉淀析出 C、在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3提供孤电子对 D、反应前后,Cu2+浓度不变8. 化学学习中常用类推方法,下列类推正确的是( )A、为直线形分子,也为直线形分子 B、中存在π键,则中也存在π键 C、的VSEPR模型为四面体,的VSEPR模型也为四面体 D、为共价化合物,则也为共价化合物9. 从微粒结构角度分析,下列说法正确的是( )A、I的空间构型为V形,中心原子的杂化形式为sp3 B、ZnCO3中,阴离子空间构型为平面三角形,C原子的杂化形式为sp3 C、根据价层电子对互斥理论,H2S、SO2、SO3三种分子中,中心原子价电子对数相等 D、三氧化硫有单分子气体和三聚分子固体(
C、酸性:
D、电负性:
7. 向盛有硫酸铜溶液的试管中加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色透明溶液。下列对此现象的相关说法不正确的是( )A、沉淀溶解后,生成深蓝色的配离子为[Cu(NH3)4]2+ B、向反应后的溶液中加入乙醇,有沉淀析出 C、在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3提供孤电子对 D、反应前后,Cu2+浓度不变8. 化学学习中常用类推方法,下列类推正确的是( )A、为直线形分子,也为直线形分子 B、中存在π键,则中也存在π键 C、的VSEPR模型为四面体,的VSEPR模型也为四面体 D、为共价化合物,则也为共价化合物9. 从微粒结构角度分析,下列说法正确的是( )A、I的空间构型为V形,中心原子的杂化形式为sp3 B、ZnCO3中,阴离子空间构型为平面三角形,C原子的杂化形式为sp3 C、根据价层电子对互斥理论,H2S、SO2、SO3三种分子中,中心原子价电子对数相等 D、三氧化硫有单分子气体和三聚分子固体( )两种存在形式,两种形式中S原子的杂化轨道类型相同
10. 是橙黄色液体。少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于的说法正确的是( )
)两种存在形式,两种形式中S原子的杂化轨道类型相同
10. 是橙黄色液体。少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于的说法正确的是( ) A、该分子为非极性分子 B、与水反应的化学方程式可能为: C、该分子中S-Cl键的键能小于S-S键的键能 D、与结构相似,熔、沸点:11. 下列有关物质性质、结构的表述均正确,且存在因果关系的是
A、该分子为非极性分子 B、与水反应的化学方程式可能为: C、该分子中S-Cl键的键能小于S-S键的键能 D、与结构相似,熔、沸点:11. 下列有关物质性质、结构的表述均正确,且存在因果关系的是
( )选项
表述1
表述2
A
在水中,NaCl的溶解度比的溶解度大
NaCl晶体中与间的作用力大于碘晶体中分子间的作用力
B
向稀的氯化铜溶液中加入适量氯化钠固体,溶液由蓝色变绿色
水合铜离子和氯离子形成了新的配合物
C
在形成化合物时,同一主族元素的化合价都相同
同一主族元素原子的最外层电子数相同
D
、溶于水后均不导电
、均属于共价化合物
A、A B、B C、C D、D12. 由同周期元素原子W、X、Y、Z构成的一种阴离子(如图),Y的最外层电子数等于X的核外电子总数,四种原子最外层电子数之和为20。下列说法正确的是( )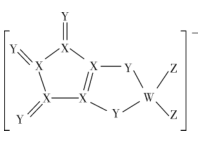 A、W、X、Y、Z第一电离能由大到小依次是:Z>Y>X>W B、Y形成的简单离子的半径比Z形成的简单离子的半径小 C、W和X的最高价氧化物对应水化物的酸性:W>X D、W、Z形成的化合物分子中各原子均满足8电子稳定结构13. 我国科学家用激光将置于铁室中石墨靶上的碳原子炸松,再用射频电火花喷射氮气,获得超硬新材料β-氮化碳薄膜,结构如图,下列有关β-氮化碳的说法错误的是( )
A、W、X、Y、Z第一电离能由大到小依次是:Z>Y>X>W B、Y形成的简单离子的半径比Z形成的简单离子的半径小 C、W和X的最高价氧化物对应水化物的酸性:W>X D、W、Z形成的化合物分子中各原子均满足8电子稳定结构13. 我国科学家用激光将置于铁室中石墨靶上的碳原子炸松,再用射频电火花喷射氮气,获得超硬新材料β-氮化碳薄膜,结构如图,下列有关β-氮化碳的说法错误的是( ) A、碳原子采取sp3杂化、氮原子采取sp2杂化 B、氮化碳属于共价晶体 C、氮化碳的化学式为C3N4 D、氮化碳硬度超过金刚石晶体14. La和Ni的合金是目前使用最广泛的储氢材料。某La-Ni合金(晶胞为平行六面体)由图甲、图乙两个原子层交替紧密堆积而成,图丙是该合金的晶胞结构:
A、碳原子采取sp3杂化、氮原子采取sp2杂化 B、氮化碳属于共价晶体 C、氮化碳的化学式为C3N4 D、氮化碳硬度超过金刚石晶体14. La和Ni的合金是目前使用最广泛的储氢材料。某La-Ni合金(晶胞为平行六面体)由图甲、图乙两个原子层交替紧密堆积而成,图丙是该合金的晶胞结构:
下列说法错误的是( )
A、该晶体可表示为 B、该晶体中1个La原子与18个Ni原子配位 C、该晶体的一个晶胞中Ni原子数为12 D、通过晶体X射线衍射实验可确定该晶组成的结构15. 下列物质所属的类别及其所含官能团的对应关系不正确的是 ( )A
B
C
D
物质


类别
烯烃
醛类
羧酸
醇类
官能团
 A、A B、B C、C D、D16. 分子式为的某烃,苯环上有一个取代基,其与足量氢气加成的产物的一氯代物共有( )A、6种 B、11种 C、12种 D、13种
A、A B、B C、C D、D16. 分子式为的某烃,苯环上有一个取代基,其与足量氢气加成的产物的一氯代物共有( )A、6种 B、11种 C、12种 D、13种二、有机推断题
-
17. 某有机化合物A经李比希法测得其中含碳元素为70.6%、含氢元素为5.9%,其余为氧元素。现用下列方法测定该有机化合物的相对分子质量和确定分子结构。
方法一:用质谱法分析得知A的质谱图如图所示。

方法二:核磁共振仪测出A的核磁共振氢谱如图所示

方法三:利用红外光谱仪测得A分子的红外光谱,如图所示。

已知:A分子中苯环上只有一个取代基,试回答下列问题。
(1)、A的相对分子质量是。其有种化学环境不同的氢原子。(2)、A的分子式为。(3)、该有机物中含有的官能团是。(4)、A的分子中只含一个甲基的直接依据是(填字母)。a.A的相对分子质量 b.A的分子式
c.A的核磁共振氢谱图 d.A分子的红外光谱图
(5)、A的结构简式为。(6)、酚酞是一种常见指示剂,结构如下图所示,该分子的分子式为 , 分子中最多有个原子共平面。
三、元素或物质推断题
-
18. 已知A、B、C、D、E、F是原子序数依次增大的前四周期元素。其中A是宇宙中含量最多的元素;B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;C元素原子的价层电子排布是;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E和D的最高能层数相同,其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。(1)、请用元素符号完成下列空白:
①C元素基态原子核外有种运动状态不同的电子,其核外电子的空间运动状态有种。
②A、B、C三种元素的电负性由大到小的顺序是:。
③B、C、D、E四种元素的第一电离能由大到小的顺序是:。
(2)、下表是A~F元素中某种元素的部分电离能,由此可判断该元素是(填元素名称)。元素
电离能/(kJ·mol-1)
某种元素
578
1817
2745
11575
14830
(3)、F元素位于周期表的区,该元素的价层电子排布图为。四、结构与性质
-
19. 目前新能源汽车电池是磷酸铁锂()和三元锂电池(正极含有Ni、Co、Mn三种元素)。回答下列问题:(1)、中阴离子的立体构型名称是。(2)、检验的方法:加入丁二酮肟试剂立即生成鲜红色的二丁二酮肟合镍(Ⅱ)螯合物,方程式如下:

①丁二酮肟熔点比丁二酮(
 )高很多的原因是。
)高很多的原因是。②二丁二酮肟合镍(Ⅱ)螯合物中N原子的杂化类型是 , 该物质中存在的作用力有:(填正确答案标号)。
A.离子键 B.配位键 C.极性共价键 D.非极性共价键 E.氢键
20. 回答下列问题:(1)、画出基态离子的M层电子排布式。(2)、下列状态的钙中,电离最外层一个电子所需能量最大的是____(填标号);A、 B、
B、 C、
C、 D、
D、 (3)、实验室常用检验 , 中的配位数为 , HCN中碳原子的杂化轨道类型为杂化。(4)、已知的熔点(1000℃)显著高于的熔点(306℃),原因是。(5)、铁和氨在640℃可发生置换反应,产物之一的立方晶胞结构如图甲所示,写出该反应的化学方程式:。
(3)、实验室常用检验 , 中的配位数为 , HCN中碳原子的杂化轨道类型为杂化。(4)、已知的熔点(1000℃)显著高于的熔点(306℃),原因是。(5)、铁和氨在640℃可发生置换反应,产物之一的立方晶胞结构如图甲所示,写出该反应的化学方程式:。 (6)、在一定条件下铁形成的晶体的基本结构单元如图乙和图丙所示,则图乙和图丙的结构中铁原子的配位数之比为 , 图乙中铁原子沿着晶胞体对角线相切,图丙中铁原子沿着晶胞面对角线相切。若两种晶体中铁原子半径相同,则两种铁晶体中密度较高的是。(填“图乙”或“图丙”)
(6)、在一定条件下铁形成的晶体的基本结构单元如图乙和图丙所示,则图乙和图丙的结构中铁原子的配位数之比为 , 图乙中铁原子沿着晶胞体对角线相切,图丙中铁原子沿着晶胞面对角线相切。若两种晶体中铁原子半径相同,则两种铁晶体中密度较高的是。(填“图乙”或“图丙”) (7)、磷化硼为立方晶胞,该晶胞中原子的分数坐标为:
(7)、磷化硼为立方晶胞,该晶胞中原子的分数坐标为:B:(0,0,0);( , , 0);( , 0,);(0, , )
P:( , , );( , , );( , , );( , , )
请在图中画出磷化硼晶胞的俯视图

-
-