吉林省普通高中友好学校联合体2022-2023学年高二下学期化学期中联考试卷
试卷更新日期:2023-07-07 类型:期中考试
一、单选题
-
1. 下列各能层中不包含p能级的是( )A、K B、L C、M D、N2. 下列关于化学键的说法不正确的是( )A、乙烯中C=C键的键能小于乙烷中C﹣C键的键能的2倍 B、σ键可以绕键轴旋转,π键不能绕键轴旋转 C、在气体单质中,一定有σ键,可能有π键 D、s﹣pσ键和p﹣pσ键电子云都是轴对称3. 下列现象不能用“相似相溶”规律解释的是( )A、氯化氢易溶于水 B、氯气易溶于溶液 C、碘易溶于 D、酒精易溶于水4. 下列各种物质的晶体中,化学键类型和晶体类型均完全相同的是( )A、NH4Cl和[Cu(NH3)4]SO4 B、H2O和NaOH C、CS2和SiC D、MgCl2和Na2O25. 往CuSO4溶液中加入过量的NH3•H2O,直到生成的沉淀恰好溶解为止,得到深蓝色溶液,再加入乙醇后,析出深蓝色晶体。下列分析不正确的是( )A、析出的深蓝色晶体化学式为[Cu(NH3)4]SO4•H2O B、加乙醇的作用是减小“溶剂”的极性,降低溶质的溶解度 C、加入氨水的过程中Cu2+的浓度不断减小 D、配离子[Cu(H2O)4]2+稳定性大于[Cu(NH3)4]2+6. 下列轨道表示式所表示的元素原子中,能量处于最低状态的是( )A、
 B、
B、 C、
C、 D、
D、 7. 下列关于物质特殊聚集状态结构的叙述中,错误的是( )A、等离子体的基本构成粒子只有阴、阳离子 B、氧化镁晶体中离子键的百分数为50%,氧化镁晶体是一种过渡晶体 C、液晶具有液体的流动性,在某些物理性质方面具有类似晶体的各向异性 D、石墨晶体属于混合晶体8. 下列比较不正确的是( )A、键的极性: B、热稳定性: C、键角: D、酸性:9. 氨基酸是构成人体必备蛋白质的基础,某氨基酸的结构简式如图所示。下列有关说法正确的是( )
7. 下列关于物质特殊聚集状态结构的叙述中,错误的是( )A、等离子体的基本构成粒子只有阴、阳离子 B、氧化镁晶体中离子键的百分数为50%,氧化镁晶体是一种过渡晶体 C、液晶具有液体的流动性,在某些物理性质方面具有类似晶体的各向异性 D、石墨晶体属于混合晶体8. 下列比较不正确的是( )A、键的极性: B、热稳定性: C、键角: D、酸性:9. 氨基酸是构成人体必备蛋白质的基础,某氨基酸的结构简式如图所示。下列有关说法正确的是( ) A、第一电离能:O>N>C>H B、基态氧原子的电子有8种空间运动状态 C、键的稳定性大小:N-H>O-H>F-H D、该分子中的氧原子均满足8电子稳定结构10. 下列原子的核外电子排布式违反了泡利原理的是( )A、基态硅原子的核外电子排布式:1s22s22p63s13p3 B、基态碳原子的核外电子排布式:1s22s22p2 C、基态钪原子的核外电子排布式:1s22s22p63s23p64s3 D、基态铬原子的核外电子排布式:1s22s22p63s23p63d44s211. 分子式为C7H16 , 主链上为五个碳原子的有机物共有( )A、2种 B、3种 C、5种 D、7种12. 下列化合物中含有手性碳原子的是( )A、
A、第一电离能:O>N>C>H B、基态氧原子的电子有8种空间运动状态 C、键的稳定性大小:N-H>O-H>F-H D、该分子中的氧原子均满足8电子稳定结构10. 下列原子的核外电子排布式违反了泡利原理的是( )A、基态硅原子的核外电子排布式:1s22s22p63s13p3 B、基态碳原子的核外电子排布式:1s22s22p2 C、基态钪原子的核外电子排布式:1s22s22p63s23p64s3 D、基态铬原子的核外电子排布式:1s22s22p63s23p63d44s211. 分子式为C7H16 , 主链上为五个碳原子的有机物共有( )A、2种 B、3种 C、5种 D、7种12. 下列化合物中含有手性碳原子的是( )A、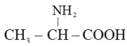 B、
B、 C、
D、
13. 1H核磁共振谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振图中坐标的位置(化学位移,符号为δ)也就不同。现有一物质的1H核磁共振谱如图所示:
C、
D、
13. 1H核磁共振谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振图中坐标的位置(化学位移,符号为δ)也就不同。现有一物质的1H核磁共振谱如图所示:
则该物质可能是下列中的( )
A、CH3CH2CH3 B、CH3CH2CH2OH C、CH3CH2CH2CH3 D、CH3CH2CHO14. 下列说法正确的是( )A、富勒烯和碳纳米管互为同素异形体 B、与互为同位素 C、和一定互为同系物 D、异戊烷和2-甲基丁烷互为同分异构体15. 下列有关同分异构体与同系物说法正确的是( )A、组成元素相同,各元素质量分数也相同的两种化合物一定互为同分异构体 B、相对分子质量相同但结构不同的化合物一定互为同分异构体 C、相差一个或若干个原子团的有机化合物一定互为同系物 D、符合通式的两种烃不一定互为同系物16. 某元素原子的最外层电子数为2,价层电子数为5,并且是同族中原子序数最小的元素,关于该元素的叙述不正确的是( )A、该元素为过渡元素 B、该元素处于元素周期表中第四周期第IIA族 C、该元素位于元素周期表的d区 D、该元素基态原子的电子排布式为17. 在水溶液中可与发生反应生成和 , 设为阿伏加德罗常数的值,下列说法错误的是A、分子中,碳原子轨道的杂化类型是 , 分子的空间构型为平面三角形 B、1mol分子中含有σ键的数目为 C、分子中碳原子轨道的杂化类型只有 D、中与的C原子形成配位键,结构可表示为 18. 一种烃的结构式可以表示为如图,命名该化合物时,主链上的碳原子数是( )
18. 一种烃的结构式可以表示为如图,命名该化合物时,主链上的碳原子数是( )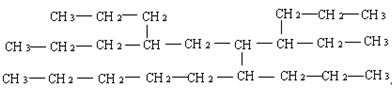 A、10 B、11 C、12 D、1319. 下列关于物质的结构或性质及解释均正确的是( )
A、10 B、11 C、12 D、1319. 下列关于物质的结构或性质及解释均正确的是( )选项
物质的结构或性质
解释
A
键角:H2O>NH3
水分子中O上孤电子对数比氨分子中N上的多
B
热稳定性:NH3>PH3
NH3分子间氢键强于PH3分子间作用力
C
熔点:晶体硅>碳化硅
Si-Si的键能大于C-Si的键能
D
酸性:
烃基(R-)越长推电子效应越大,使羧基中羟基的极性越小,羧酸的酸性越弱
A、A B、B C、C D、D20. 磷锡青铜合金广泛用于仪器仪表中的耐磨零件和抗磁元件等。其晶胞结构如图所示。已知晶胞参数为a pm,下列说法不正确的是( ) A、磷锡青铜的化学式为 B、该晶胞中与Cu等距离且最近的Cu有4个 C、三种元素Cu、Sn、P在元素周期表中分别处于ds区、p区、p区 D、Sn和P原子间的最短距离为
A、磷锡青铜的化学式为 B、该晶胞中与Cu等距离且最近的Cu有4个 C、三种元素Cu、Sn、P在元素周期表中分别处于ds区、p区、p区 D、Sn和P原子间的最短距离为二、结构与性质
-
21. 过渡金属元素铬(Cr)是不锈钢的重要成分。回答下列问题:(1)、对于基态Cr原子,下列叙述正确的是____(填标号)。A、轨道处于半充满时体系总能量低,核外电子排布应为 B、4s轨道上电子能量比3d高,且总是在比3d轨道上电子离核更远的地方运动 C、电负性比钾高,原子对键合电子的吸引力比钾大(2)、三价铬离子能形成多种配位化合物。中提供电子对形成配位键的原子是 , 中心离子的配位数为。(3)、中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如图所示。

PH3中P的杂化类型是。NH3的沸点比PH3的(填高,低或无法确定)
22. 回答下列问题。(1)、26号元素价层电子排布图为;L原子核外电子占有9个轨道,而且有三个未成对电子,L是元素。(2)、硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。基态硒原子的价层电子排布式为。(3)、①Cu元素基态原子的电子排布式为。②下列说法正确的是(填字母)。
A.第一电离能:As>Ga B.电负性:As>Ga C.原子半径:As>Ga
③在第二周期中,第一电离能位于硼元素与氮元素之间的元素有种。
三、有机推断题
-
23. 为了测定某有机物A的结构,做如下实验:
①将2.3g该有机物完全燃烧,生成0.1molCO2和2.7g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;

③用核磁共振仪处理该化合物,得到如图所示图谱,图中三个峰的面积之比是1∶2∶3。

试回答下列问题:
(1)、有机物A的相对分子质量是。(2)、求该有机物A的实验式。(3)、则A的分子式(4)、由如图可知,该有机物A中含有种不同类型的氢原子,其个数之比是。(5)、写出有机物A可能的结构式四、填空题
-
24. 在下列有机物中①CH3CH2CH3;②CH3-CH=CH2;③CH3-C≡CH;④
 ;⑤
;⑤ ;⑥
;⑥ ;⑦
;⑦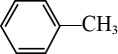 ;⑧
;⑧ ;⑨
;⑨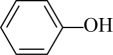 ,⑩
,⑩ (1)、属于芳香烃的是 , 属于醇类的是 , 互为同系物的是、。互为同分异构体的是。(填写序号)(2)、写出⑤的系统命名。(3)、写出⑥的一种同分异构体的结构简式。(4)、⑩中含有的官能团名称为。
(1)、属于芳香烃的是 , 属于醇类的是 , 互为同系物的是、。互为同分异构体的是。(填写序号)(2)、写出⑤的系统命名。(3)、写出⑥的一种同分异构体的结构简式。(4)、⑩中含有的官能团名称为。
-