河南省安阳市新乡鹤壁2022-2023学年高二下学期化学5月份联考试题
试卷更新日期:2023-07-07 类型:月考试卷
一、单选题
-
1. 下表物质中所含官能团的名称命名错误的是( )
选项
物质
官能团的名称
A

醚键、氨基
B

酯基、羧基
C
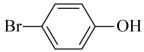
碳溴键、羟基
D

碳碳双键、醛基
A、A B、B C、C D、D2. 下列有机物的命名正确的是( )A、2-乙基戊烷 B、2,3-二乙基-4-甲基己烷 C、2,2,3-三甲基丁烷 D、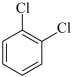 (对二氯苯)
3. 下列实验中,所采取的分离或提纯方法与对应原理都正确的是( )
(对二氯苯)
3. 下列实验中,所采取的分离或提纯方法与对应原理都正确的是( )选项
实验目的
分离或提纯方法
原理
A
分离食用油和汽油
分液
食用油和汽油的密度不同
B
分离溶于水中的溴
乙醇萃取
溴在乙醇中的溶解度较大
C
除去乙烷中的乙烯
通过酸性KMnO4溶液洗气
乙烯与酸性KMnO4溶液反应
D
除去碘中的NaCl
加热、升华
NaCl的熔点高,碘易升华
A、A B、B C、C D、D4. 进行一溴取代反应后,只能生成四种沸点不同的有机产物的烷烃是A、 B、 C、 D、5. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、1mol[Cu(NH3)4]2+中σ键的数目为12NA B、23gCH3CH2OH中为sp3杂化的原子数为NA C、0.5molSF6中S的价层电子对数为3NA D、甲烷酸性燃料电池中正极有1mol气体反应时转移的电子数目2NA6. 分子式为C5H11Br的烃,分子中含有3个甲基的同分异构体共有(不考虑立体异构)( )A、3种 B、2种 C、5种 D、4种7. ag某常见有机物X在足量的氧气中充分燃烧,生成和 , 下列说法正确的是( )A、X不可能是甲烷 B、若X含有三种元素,则a可能为3.2 C、X完全燃烧时,消耗的 D、X最多存在两种同分异构体8. 下列实验操作所观察到的实验现象正确且能得出相应实验结论的是( )选项
实验操作
实验现象
实验结论
A
用精密pH试纸分别测定相同浓度NaClO和CH3COONa溶液的pH
pH:
酸性强弱:
B
将相同大小的铜片、铝片用导线连接,平行放入浓硝酸中
铜片不断溶解
活泼性:Al<Cu
C
取5 mL 0.1 mol/L KI溶液于试管中,加入1 mL 0.1 mol/L 溶液,充分反应后滴入5滴15% KSCN溶液
溶液变血红色
KI与的反应有一定限度
D
向盛有2 mL、0.1 mol/L NaOH溶液的试管中滴加4~5滴0.1 mol/L 溶液,再向其中滴加0.1 mol/L 溶液
先生成白色沉淀,后生成蓝色沉淀
说明:
A、A B、B C、C D、D9. 利用超分子可以对一些物质进行分离,例如利用杯酚(结构如图1所示,用“ ”表示)分离C60和C70的过程如图2所示。下列说法不正确的是( )
”表示)分离C60和C70的过程如图2所示。下列说法不正确的是( ) A、 , 互为同素异形体 B、该流程体现了超分子具有“分子识别”的特征 C、与结构相似,由于C—C键的键长小于Si—Si键,所以的熔、沸点低于 D、杯酚中所有原子不可能位于同一平面10. 水溶液锌电池(图1)的电极材料是研究热点之一,一种在晶体MnO中嵌入的电极材料充放电过程的原理如图2所示,嵌入的位于晶胞的面心。下列叙述中不正确的是( )
A、 , 互为同素异形体 B、该流程体现了超分子具有“分子识别”的特征 C、与结构相似,由于C—C键的键长小于Si—Si键,所以的熔、沸点低于 D、杯酚中所有原子不可能位于同一平面10. 水溶液锌电池(图1)的电极材料是研究热点之一,一种在晶体MnO中嵌入的电极材料充放电过程的原理如图2所示,嵌入的位于晶胞的面心。下列叙述中不正确的是( )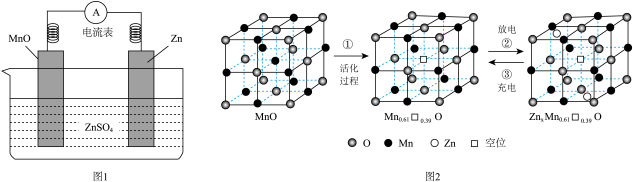
已知:晶体中某结点上的原子空缺了,则称为空位。
A、放电时,负极电极反应式为 B、放电时,MnO电极上电势比Zn电极上电势高 C、活化过程MnO的价态发生变化 D、当1 mol □转化为1 mol □时,转移的电子数为0.61 mol11. 氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应得到BF3和BN,如图所示。下列叙述正确的是( )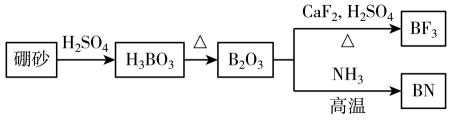 A、硼酸具有片层状结构,层与层之间、H3BO3单元间都仅以范德华力连接 B、NH3与BF3都是由极性键构成的极性分子 C、与HF反应后再用氨气中和得到 , 1 mol含有配位键的数目为 D、立方氮化硼结构与金刚石相似,立方氮化硼晶胞中每个氮原子周围有4个硼原子12. 甲胺铅碘[]是新型太阳能电池的敏化剂,已知[]的摩尔质量为 , 其晶胞结构如图所示。下列有关说法不正确的是( )
A、硼酸具有片层状结构,层与层之间、H3BO3单元间都仅以范德华力连接 B、NH3与BF3都是由极性键构成的极性分子 C、与HF反应后再用氨气中和得到 , 1 mol含有配位键的数目为 D、立方氮化硼结构与金刚石相似,立方氮化硼晶胞中每个氮原子周围有4个硼原子12. 甲胺铅碘[]是新型太阳能电池的敏化剂,已知[]的摩尔质量为 , 其晶胞结构如图所示。下列有关说法不正确的是( )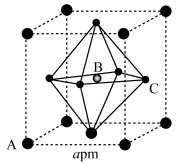 A、若B代表 , 则C代表 B、该晶胞沿体对角线方向的投影图为
A、若B代表 , 则C代表 B、该晶胞沿体对角线方向的投影图为 C、距离A最近且等距离的C有8个
D、为阿伏加德罗常数的值,则该晶体的密度为
13. 基于硫化学的金属硫电池有望替代当前锂离子电池技术,满足人类社会快速增长的能源需求,该电池的结构及原理如图所示。
C、距离A最近且等距离的C有8个
D、为阿伏加德罗常数的值,则该晶体的密度为
13. 基于硫化学的金属硫电池有望替代当前锂离子电池技术,满足人类社会快速增长的能源需求,该电池的结构及原理如图所示。
下列有关叙述正确的是( )
A、该电池可采用含的水溶液或有机物为电解质溶液 B、放电时,电子的移动方向:电极a→电极b→隔膜→电极a C、充电时,阳极区可能发生的反应有 D、充电时。电路中转移时,阴极质量减重78g14. 室温下,向20 mL 0.05 mol/L的H2X溶液中逐滴加入0.1 mol/L的NaOH溶液,溶液pH随着NaOH溶液体积变化的关系如图所示。下列叙述错误的是( )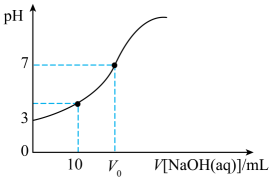 A、 mL时,溶液中 B、随着NaOH溶液的不断加入,水的电离程度先增大后减小 C、室温下,的电离常数 D、时, mL,溶液中
A、 mL时,溶液中 B、随着NaOH溶液的不断加入,水的电离程度先增大后减小 C、室温下,的电离常数 D、时, mL,溶液中二、有机推断题
-
15. 某有机物M只含C、H、O三种元素中的两种或三种,某化学兴趣小组从粗品中分离提纯有机物M,然后借助现代科学仪器测定有机物M的分子组成和结构,具体实验过程如下:(1)、步骤一:将粗品用蒸馏法进行纯化。
如图1所示,仪器a的名称是 , 图中虚线框内应选用右侧的(填“仪器x”或“仪器y”)。 (2)、步骤二:确定M的分子式和结构简式。
(2)、步骤二:确定M的分子式和结构简式。使用现代分析仪器对有机物M的分子结构进行测定,相关结果如下:
①根据图2,M的相对分子质量为。

②根据图3,推测M可能所属的有机化合物类别和其分子式分别为、。

③根据以上结果和图4(两个峰的面积比为2∶3),推测M的结构简式为。M的同分异构体有种,写出两种能与钠反应的结构简式:。

三、结构与性质
-
16. 科学研究发现甲醇(CH3OH)和羰基硫(OCS)是火星上存在的有机物。回答下列问题:(1)、 CH3OH中O的杂化类型为 , 16 g CH3OH中含有mol σ键。(2)、常用于酯交换等有机合成,下列各种Li原子电子排布图(轨道表示式)表示的状态中能量最高和最低的分别为、 (填字母)。
A.
 B.
B.
C.
 D.
D.
与具有相同的电子结构,小于 , 原因是。
(3)、分子中的键角为 , 该分子属于(填“极性”或“非极性”)分子;OCS分子中键长:C=O(填“>”或“<”,下同)C=S,键能:C=OC=S。17. 铁、钴均为第四周期第Ⅷ族元素,它们的单质及其化合物均具有广泛用途。(1)、基态中未成对电子数为;Fe和Co的第三电离能:(填“>”“<”或“=”)。(2)、化学上可用EDTA测定和的含量。EDTA的结构简式如图所示:
①EDTA中电负性最大的元素是(填元素符号),其中C原子的杂化轨道类型为。
②EDTA分子中不存在的化学键有(填选项字母)。
a.离子键 b.共价键 c.σ键 d.π键 e.配位键
(3)、将1 mol 溶于水中,加入足量溶液生成1 mol AgCl沉淀。则中配离子的化学式为。已知孤电子对与成键电子对的排斥作用大于成键电子对与成键电子对的排斥作用,则分子与形成配合物后,H-N-H键角(填“变大”“变小”或“不变”)。(4)、一种铁氮化合物具有高磁导率,其结构如图所示。已知晶体的密度为 , 阿伏加德罗常数的值为。
①该铁氮化合物的化学式为。
②一个晶胞内Fe(Ⅱ)构成的一个正八面体的体积为cm。
四、工业流程题
-
18. 大力推广磷酸亚铁锂电池新能源汽车对实现“碳达峰”和“碳中和”具有重要意义。电极材料以硫铁矿(主要成分FeS2 , 含少量Al2O3、SiO2和Fe2O3)为原料制备,工业流程如图所示。回答下列问题:
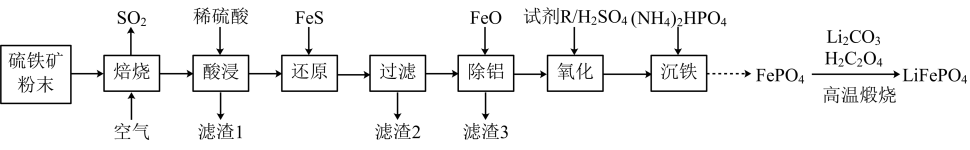 (1)、SO2分子的空间结构名称为 , 试剂R是一种绿色氧化剂,其中心原子杂化方式是。(2)、从平衡的角度解释加FeO除铝的原因(结合离子方程式说明)。(3)、若“沉铁”时溶液中c(PO)=1.0×10-4mol•L-1 , 则“沉铁”时pH不能高于 , [已知:常温下,Ksp(FePO4)=5.0×10-16、Ksp[Fe(OH)3]=4×10-38、lg2=0.3,溶液体积变化忽略不计]。(4)、流程中在高温煅烧条件下,由FePO4制备LiFePO4的化学方程式为。(5)、磷酸亚铁锂(LiFePO4)的晶胞结构如图所示:
(1)、SO2分子的空间结构名称为 , 试剂R是一种绿色氧化剂,其中心原子杂化方式是。(2)、从平衡的角度解释加FeO除铝的原因(结合离子方程式说明)。(3)、若“沉铁”时溶液中c(PO)=1.0×10-4mol•L-1 , 则“沉铁”时pH不能高于 , [已知:常温下,Ksp(FePO4)=5.0×10-16、Ksp[Fe(OH)3]=4×10-38、lg2=0.3,溶液体积变化忽略不计]。(4)、流程中在高温煅烧条件下,由FePO4制备LiFePO4的化学方程式为。(5)、磷酸亚铁锂(LiFePO4)的晶胞结构如图所示:
长方体晶胞的长和宽均为apm,高为bpm,NA为阿伏加德罗常数的值,晶体的密度为g•cm-3。
五、原理综合题
-
19. 氮的氧化物是造成大气污染的主要成分之一,降低氮氧化物的排放可改善大气质量。(1)、已知:N2(g)+O2(g)=2NO(g) △H1=+181kJ•mol-1
2C(s)+O2(g)=2CO(g) △H2=-221kJ•mol-1
2NO(g)+2CO(g)N2(g)+2CO2(g) △H3=-747kJ•mol-1
碳完全燃烧时的热化学方程式为。
(2)、向密闭反应器中按n(NO):n(CO)=1:1投料,发生(1)中的反应③。不同温度下,反应达到平衡时,NO的平衡转化率随压强的变化曲线如图所示。
①曲线a、b对应温度较低的是(填“曲线a”或“曲线b”)。
②M点时混合气体的平均相对分子质量为(结果保留两位小数)。
(3)、一定温度下,向恒容密闭容器中通入1molNO、1molCO,发生(1)中的反应③。测得容器中混合气体的压强(p)随时间(t)的变化关系如表所示。t/min
0
1
2
3
4
5
p/kPa
200
185
173
165
160
160
①反应开始到刚达平衡状态的时间段内,v(CO)=kPa·min-1 , 该反应条件下的平衡常数Kp=(kPa)-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。该反应中正反应速率v正=k正·p2(NO)·p2(CO),逆反应速率v逆=k逆·p(N2)·p2(CO2),则该温度下,该反应的k正 (填“>”“<”或“=”)k逆。
②能判断反应已达到化学平衡状态的是(填字母序号)。
A.N2和CO2的浓度比保持不变 B.容器中熵值保持不变
C.2v正(NO)=v逆(N2) D.气体的密度保持不变
(4)、工业上利用电化学方法处理NO的原理如图所示。正极的电极反应式为。
-
-