吉林省长春新区2021-2022 学年度下学期九年级阶段性诊断练习
试卷更新日期:2023-07-07 类型:月考试卷
一、选择题(每小题只有一个选项符合题意。每小题1分,共10分)
-
1. 空气中含量虽少,但可制成多种用途的电光源是( )A、氮气 B、氧气 C、稀有气体 D、二氧化碳2. 赏中华诗词、寻文化基因、品生活之美。《醉翁亭记》中主要体现化学变化的是( )A、日出而林霏开 B、水落而石出 C、泉香而酒洌 D、酿泉为酒3. 全国生态环境保护大会要求“坚决打好污染防治攻坚战”。下列做法符合环保要求的是( )
A、野外焚烧垃圾 B、回收废弃塑料 C、任意排放污水 D、随意丢弃电池4. 施肥是农业增产的重要手段,下列化肥中,属于复合肥的是()A、NH4HCO3 B、Ca(H2PO4)3 C、K2SO4 D、(NH4)2HPO45. 运动型功能饮料含有下列营养素,其中主要用于补充能量的是( )A、葡萄糖 B、维生素 C、水 D、无机盐6. 下图所示实验操作正确的是( )A、 稀释浓硫酸
B、
稀释浓硫酸
B、 倾倒液体
C、
倾倒液体
C、 读取液体体积
D、
读取液体体积
D、 点燃酒精灯
7. 多角度看问题有利于我们在零身学习中赢得未来。甲酸(HCOOH)具有清洁制氢的巨大潜力,其反应的微观示意图如下,下列说法不正确的是( )
点燃酒精灯
7. 多角度看问题有利于我们在零身学习中赢得未来。甲酸(HCOOH)具有清洁制氢的巨大潜力,其反应的微观示意图如下,下列说法不正确的是( )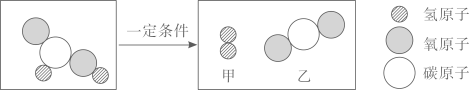 A、从反应类型看:该反应属于分解反应 B、从微观构成看:三种物质均由分子构成 C、从物质分类看:只有物质乙属于氧化物 D、从表示方法看:反应的化学方程式为HCOOH=H2+H2O8. 北宋沈括在《梦溪笔谈》中记载了用“苦泉水”制取铜的方法,其主要生产流程如图所示。下列解释合理的是( )
A、从反应类型看:该反应属于分解反应 B、从微观构成看:三种物质均由分子构成 C、从物质分类看:只有物质乙属于氧化物 D、从表示方法看:反应的化学方程式为HCOOH=H2+H2O8. 北宋沈括在《梦溪笔谈》中记载了用“苦泉水”制取铜的方法,其主要生产流程如图所示。下列解释合理的是( )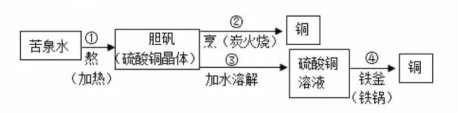 A、①通过蒸发溶剂可获得晶体 B、②是通过复分解反应获得铜 C、③所得硫酸铜溶液定是饱和的 D、④说明铁元素变成了铜元素9. 下列实验中,实验原理和主要操作方法都符合实验目的的是( )
A、①通过蒸发溶剂可获得晶体 B、②是通过复分解反应获得铜 C、③所得硫酸铜溶液定是饱和的 D、④说明铁元素变成了铜元素9. 下列实验中,实验原理和主要操作方法都符合实验目的的是( )实验目的
实验原理
主要操作方法
A
除去粗盐中的泥沙
各成分的溶解性差异
蒸发
B
除去CO2中的CO
可燃性差异
点燃
C
鉴别稀盐酸和稀硫酸
酸根离子的化学性质差异
加碳酸钠溶液,观察产生气泡的快慢
D
除去FeSO4溶液中的CuSO4
金属活动性差异
加过量铁粉,充分反应后过滤
A、A B、B C、C D、D10. 人类常利用化学反应得到所需要的物质。如图是X、Y、Z、W四种物质的转化关系(都能通过一步反应实现),则X、Y、Z、W依次可能是( )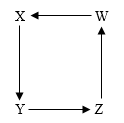 A、C、CO、CO2、H2CO3 B、HCl、NaCl、Na2CO3、NaOH C、CaO、Ca(OH)2、CaCl2、CaCO3 D、Cu、CuO、Cu(OH)2、CuSO4
A、C、CO、CO2、H2CO3 B、HCl、NaCl、Na2CO3、NaOH C、CaO、Ca(OH)2、CaCl2、CaCO3 D、Cu、CuO、Cu(OH)2、CuSO4二、非选择题(每空1分,共40分)
-
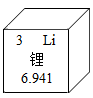
11. 用化学用语回答下列问题。(1)、氢元素的符号;(2)、氢气的化学式;(3)、氢离子。12. 锂是密度最小的金属,广泛应用于电池、贮氢等领域,锂在化合物中通常显+1价。依据下图回答问题:
 (1)、锂的相对原子质量为;(2)、锂属于(选填“金属”、“非金属”或“稀有气体”)元素;(3)、写出氯化锂的化学式。13. 回答下列与水有关的问题:(1)、在过滤、吸附、蒸馏三种操作中,能将硬水转化成纯净水的是;(2)、通过电解水实验并验证其生成物,可以证明水是由两种元素组成的;(3)、H2O和H2O2元素组成相同,但化学性质不同,其原因是它们的不同。14. 截止2021年10月,长春轨道交通运营线路共有5条,运营里程104.53千米。(1)、乘坐地铁时,不要在车厢内食用榴莲、臭豆腐等有异味的食物,请从分子的角度解释原因;(2)、地铁站台两侧铁护栏器件喷涂油漆,目的是防止Fe与发生反应而生锈;(3)、铝和氧化铁高温条件下的置换反应会释放出大量的热,在地铁施工中用来焊接钢轨缝隙,试写出该反应的化学方程式。15. 下图是某同学设计的实验室制取氧气(的发生和收集装置。请完成下列问题。
(1)、锂的相对原子质量为;(2)、锂属于(选填“金属”、“非金属”或“稀有气体”)元素;(3)、写出氯化锂的化学式。13. 回答下列与水有关的问题:(1)、在过滤、吸附、蒸馏三种操作中,能将硬水转化成纯净水的是;(2)、通过电解水实验并验证其生成物,可以证明水是由两种元素组成的;(3)、H2O和H2O2元素组成相同,但化学性质不同,其原因是它们的不同。14. 截止2021年10月,长春轨道交通运营线路共有5条,运营里程104.53千米。(1)、乘坐地铁时,不要在车厢内食用榴莲、臭豆腐等有异味的食物,请从分子的角度解释原因;(2)、地铁站台两侧铁护栏器件喷涂油漆,目的是防止Fe与发生反应而生锈;(3)、铝和氧化铁高温条件下的置换反应会释放出大量的热,在地铁施工中用来焊接钢轨缝隙,试写出该反应的化学方程式。15. 下图是某同学设计的实验室制取氧气(的发生和收集装置。请完成下列问题。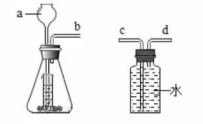 (1)、写出图中a仪器的名称:;(2)、锥形瓶底部应放入的药品是 , 该装置的优点是。(3)、发生和收集装置的连接方法是b接(填“c"或“d")。16. 根据图所示的NaCl和KNO3溶解度曲线,回答下列问题。
(1)、写出图中a仪器的名称:;(2)、锥形瓶底部应放入的药品是 , 该装置的优点是。(3)、发生和收集装置的连接方法是b接(填“c"或“d")。16. 根据图所示的NaCl和KNO3溶解度曲线,回答下列问题。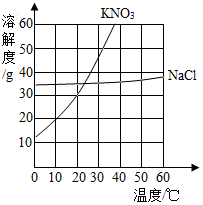 (1)、两种盐比较,溶解度受温度影响变化大的是;(2)、30℃时,将NaCl、KNO3各40g加入到100g水中,充分搅拌后过滤,能 得到饱和溶液的是;(3)、将氯化钠的饱和溶液转化为不饱和溶液,通常采用的方法是。17. 我国科学家研究出碳化钼(Mo2C)负载金原子组成的高效吸附催化体系,使水煤气中的CO和H2O在120℃下发生反应,其微观模型如下图。回答该反 应过程中的相关问题。
(1)、两种盐比较,溶解度受温度影响变化大的是;(2)、30℃时,将NaCl、KNO3各40g加入到100g水中,充分搅拌后过滤,能 得到饱和溶液的是;(3)、将氯化钠的饱和溶液转化为不饱和溶液,通常采用的方法是。17. 我国科学家研究出碳化钼(Mo2C)负载金原子组成的高效吸附催化体系,使水煤气中的CO和H2O在120℃下发生反应,其微观模型如下图。回答该反 应过程中的相关问题。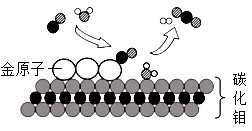 (1)、构成催化剂的各原子(填“有”或“没有”)变化;(2)、金原子对(填“CO”或“H2O”)起吸附催化作用;(3)、反应的化学方程式为;(4)、催化反应体系除钼外还涉及种元素。18. 某化学兴趣小组用如图装置测定空气中氧气的含量。
(1)、构成催化剂的各原子(填“有”或“没有”)变化;(2)、金原子对(填“CO”或“H2O”)起吸附催化作用;(3)、反应的化学方程式为;(4)、催化反应体系除钼外还涉及种元素。18. 某化学兴趣小组用如图装置测定空气中氧气的含量。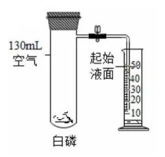
[实验步骤]
(1)、实验前,先检查装置的性,然后夹紧止水夹,导气管一端放入盛有50mL水的量筒中;(2)、将装有白磷的试管浸入热水中,使白磷燃烧;待装置冷却至室温后打开止水夹,观察到量筒中的水回流至试管中,停止回流后,取出宇气管像取剩余水的体积。
设空气中氧气体积分数为20%,量筒中剩余的水的体积理论为mL,实际发现量筒中剩余的水比理论估大很多,可能的原因是。
19. 某同学对自热食品发热包进行了如下探究。[查阅资料] Ⅰ.标签信息如图;
食品专用发热包
禁止食用主要成分:生石灰、碳酸钠、铝粒
储存条件:存放于阴凉、干燥处。
使用方法:撕去塑料袋后,放入适量冷水中。
注意事项:
①请勿湿手接触发热包
②使用过程中,禁止使用热水。小心高温烫伤,注意通风并远离明火。
③使用前后,如有发现破袋污染食品,请勿食用。
④如有发热包内物质误入口、眼、鼻,请立即使用清水冲洗、催吐或医院就医。
⑤未成年人请勿独自使用。
XXXX科技有限责任公司
Ⅱ.铝遇强碱溶液生成氢气;
[进行实验1]取出发热包按说明使用,观察到剧烈反应,有气泡,放出大量的热,同时发热包内固体物质变硬、结块。
[分析与解释]
(1)、放热的主要反应为:氧化钙与水化合生成氢氧化钙,其化学反应方程式为①;(2)、氢氧化钙跟碳酸钠反应后溶液碱性增强的原因是②;(3)、远离明火的原因是生成了③ (填气体化学式);(4)、[提出问题]使用后的发热包中结块固体是否含有碳酸盐、Al粉?[分析与设计]取结块固体加入过量稀盐酸,通过分析产生的气体成分,可以判断碳酸盐、铝粉是否存在。
[猜想与假设]猜想Ⅰ:气体是H2 , 判断结块固体中只有④存在;
猜想Ⅱ:气体是⑤ , 判断结块固体中只有碳酸盐存在;
猜想Ⅲ:气体中含有H2和CO2 , 判断结块固体中碳酸盐和Al粉都存在。
(5)、[进行实验2]按图示装置实验
甲装置中出现⑥的实验现象,同时丁装置中黑色的粉末逐渐变为红色,试管口有水珠产生,证明猜想Ⅲ正确。若甲、乙装置交换位置⑦ (填“能”或“不能”)确定气体中含有CO2。
(6)、[总结与反思]通过以上探究,小致做出如下反思:a.发热包应密封防潮保存
b.能与水混合放出热量的物质均可做发热包的发热材料
c.使用后的发热包应包好按照垃圾分类投放专
你认为其中正确的是⑧。
20. 调味精盐为改善口味常加入适量的食用硫酸镁。小致欲测定某精盐中硫酸镁的质量分数,进行了如下实验(忽略其它杂质[实验过程]称量40.0g精盐溶于适量的水配得溶液,非等速滴加10%的氢氧化钠溶液,观察沉淀变化情况,同时用pH计监测溶液酸碱度,绘制了溶液pH随时间变化图像。过滤洗涤。干燥后测得生成沉淀的质量为1.74g。
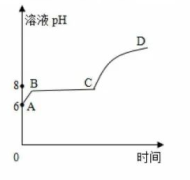
[数据分析]
(1)、该精盐溶液呈酸性的判断依据是 , 已知NaCl、Na2SO4溶液呈中性,你判断该溶液呈酸性是由精盐中离子溶于水造成的;(2)、你判断Mg(OH)2沉淀生成对应着图像的段(填字母序号);a.A-B
b.B-C
c.C-D
d.B-D
(3)、请补全求精盐中硫酸镁的质量分数的计算过程。解:设硫酸镁质量为x,
MgSO4+2NaOH=
Mg(OH)2↓+Na2SO4
写出相关量
58
x
1.74g
列出比例式②
求解 x=3.6g
答:硫酸镁的质量分数为。