四川省成都市青羊区2023年中考二模化学试题
试卷更新日期:2023-07-03 类型:中考模拟
一、单选题
-
1. 三星堆遗址出土了大量精美青铜器,青铜是金属冶炼史上最早出现的合金,与纯铜相比,其强度高、熔点低、铸造性好、耐磨、耐腐蚀。其中属于青铜化学性质的是( )A、强度高 B、耐腐蚀 C、耐磨 D、熔点低2. 让“绿色大运”成为成都大运会闪亮的底色。下列行为不符合该理念的是( )A、倡导绿色出行,大力发展公共交通 B、倡导低碳办公,尽量使用自然光源 C、倡导清洁能源,禁止使用化石燃料 D、倡导垃圾分类,综合利用生活资源3. 化学与人体健康息息相关。下列说法正确的是( )A、合理添加食品添加剂,可改善食品的品质 B、为增强身体免疫力,只吃肉类不吃蔬菜 C、奶茶具有良好口感,可取代水长期饮用 D、霉变大米含有黄曲霉素,煮熟仍可食用4. 合理使用化肥有利于提高农作物产量。下列化肥中,从外观即可与其他化肥相区别的是( )A、氯化铵 B、硫酸钾 C、尿素 D、磷矿粉5. 分类法在日常生活和科学研究中具有广泛的运用。下列物质中,属于氧化物的是( )A、Fe3O4 B、O2 C、K2MnO4 D、H2SO46. 北京大学生命科学学院蒋争凡教授研究组发现,锰离子是细胞内天然免疫激活剂和警报素。在元素周期表中锰元素的某些信息如图所示,下列有关锰的说法不正确的是( )
 A、属于金属元素 B、原子核内有25个质子 C、中子数为25 D、相对原子质量为54.947. “宏微结合”认识物质是化学学科独特的视角。对下列事实的微观解释正确的是( )A、金刚石和石墨的物理性质差异大一一构成物质的碳原子结构不同 B、夏天汽车轮胎爆炸一一受热时轮胎内气体分子体积变大 C、化学反应前后各物质总质量不变一一反应前后原子种类、数目、质量不变 D、氯化钠溶液能导电一一氯化钠溶液中存在可自由移动的电子8. 生物体中含有多种氨基酸(结构如图所示)。下列有关叙述正确的( )
A、属于金属元素 B、原子核内有25个质子 C、中子数为25 D、相对原子质量为54.947. “宏微结合”认识物质是化学学科独特的视角。对下列事实的微观解释正确的是( )A、金刚石和石墨的物理性质差异大一一构成物质的碳原子结构不同 B、夏天汽车轮胎爆炸一一受热时轮胎内气体分子体积变大 C、化学反应前后各物质总质量不变一一反应前后原子种类、数目、质量不变 D、氯化钠溶液能导电一一氯化钠溶液中存在可自由移动的电子8. 生物体中含有多种氨基酸(结构如图所示)。下列有关叙述正确的( )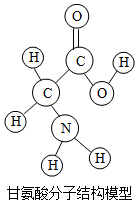 A、甘氨酸是有机高分子化合物 B、一个甘氨酸分子中含有10个原子 C、甘氨酸是由碳、氢、氧、氮四种原子构成的 D、甘氨酸中碳元素与氧元素的质量比为1:19. 劳动创造美好生活。下列劳动项目与所依据的化学知识不相符的是( )
A、甘氨酸是有机高分子化合物 B、一个甘氨酸分子中含有10个原子 C、甘氨酸是由碳、氢、氧、氮四种原子构成的 D、甘氨酸中碳元素与氧元素的质量比为1:19. 劳动创造美好生活。下列劳动项目与所依据的化学知识不相符的是( )选项
劳动项目
化学知识
A.
用炉具清洁剂去除油污
氢氧化钠可与油脂反应
B.
用活性炭除去水中的异味
活性炭具有很强的吸附性
C.
用食醋除铁锅上的锈迹
醋酸能与氧化铁反应
D.
做馒头时加入小苏打
小苏打的化学式为Na2CO3
A、A B、B C、C D、D10. 图1所示是初中化学重要实验,图2是该实验的化学反应微观示意图。请根据图示结合所学判断,下列选项正确的是( )
 A、图1中试管a收集的物质可以用
A、图1中试管a收集的物质可以用 表示,试管b收集的物质可以用
表示,试管b收集的物质可以用 表示
B、图2中该反应粒子运动及变化的正确顺序是④①③②
C、定量分析该反应:产生的
表示
B、图2中该反应粒子运动及变化的正确顺序是④①③②
C、定量分析该反应:产生的 与
与 质量之比为8:1
D、用化学方程式表示该反应:
11. 下图是初中化学进行“气体制取与收集”实验的装置图,请根据所学知识选择正确的说法是( )
质量之比为8:1
D、用化学方程式表示该反应:
11. 下图是初中化学进行“气体制取与收集”实验的装置图,请根据所学知识选择正确的说法是( ) A、装置1可以用作高锰酸钾制氧气的发生装置 B、装置2用于实验室制取二氧化碳可以实现“即开即停” C、装置3可以收集到比较纯净的氧气 D、装置4可以检验收集的气体是否是二氧化碳12. “对比实验”是化学学科的重要探究方法。下列对比实验的设计能实现相应探究目的是( )
A、装置1可以用作高锰酸钾制氧气的发生装置 B、装置2用于实验室制取二氧化碳可以实现“即开即停” C、装置3可以收集到比较纯净的氧气 D、装置4可以检验收集的气体是否是二氧化碳12. “对比实验”是化学学科的重要探究方法。下列对比实验的设计能实现相应探究目的是( )实验设计




实验目的
探究不同溶剂中物质溶解性强弱
探究金属活动性强弱
探究铁钉生锈的条件
探究CO2与水发生反应
选项
A
B
C
D
A、A B、B C、C D、D13. 如图中,甲、乙是已学过的常见物质。甲发生一步反应转化为乙有①、②两种途径,乙经过途径③发生一步反应可转化为甲。下列说法错误的是( ) A、若甲是Fe3O4 , 则乙可以是Fe B、若甲是O2 , 则乙可以是CO2 C、若乙是水,则甲可以是氢气 D、若甲是一氧化碳,则反应①和③的基本反应类型不同14. 为除去下列各物质中混有的少量杂质,采用的相应除杂方案正确的是( )
A、若甲是Fe3O4 , 则乙可以是Fe B、若甲是O2 , 则乙可以是CO2 C、若乙是水,则甲可以是氢气 D、若甲是一氧化碳,则反应①和③的基本反应类型不同14. 为除去下列各物质中混有的少量杂质,采用的相应除杂方案正确的是( )选项
物质
杂质
除杂方案
A
氧化钙
碳酸钙
加水溶解、过滤
B
银粉
锌粉
加过量稀盐酸、过滤、洗涤、干燥
C
二氧化碳
氯化氢气体
通入足量氢氧化钠溶液、干燥
D
稀盐酸
硫酸溶液
加入过量的氯化钡溶液、过滤
A、A B、B C、C D、D15. 图I为甲、乙、丙三种固体的溶解度曲线。某同学按图Ⅱ所示进行实验,得到相应温度下的A、B、C三种溶液,下列说法正确的是( )

A.A、B、C三种溶液中,
A、C是不饱和溶液,B是饱和溶液 B、t1℃时,甲、乙、丙三种溶液中,丙溶液的溶质质量分数最大 C、t2℃时,等质量甲、丙的饱和溶液,丙中所含溶剂质量较少 D、将t3℃时甲、乙、丙的饱和溶液降温至t1℃,甲析出晶体最多二、填空题
-
16. 航空航天科学研究涉及许多化学知识,以下为航天员的太空生活和太空实验,请回答下列问题。(1)、舱内生活。
①航天员每天的食品都要经过科学的计算和设计,以保持航天员营养均衡。鱼肉为航天员提供的主要营养素是(填字母序号,下同);
a.糖类 b.维生素 c.蛋白质
②长期驻留空间实验室会导致航天员肌肉萎缩、骨钙丢失,可在航天食品中添加来预防骨质疏松;
a.C12H22O14Ca b.FeC6H6O7 c.KIO3
③铁酸镍(化学式NiFe2O4)可将航天员呼出的废气转化为航天员需要的气体,NiFe2O4中若铁元素的化合价是+3价,则镍(Ni)元素的化合价是。
(2)、天宫课堂。①“天宫第一课”中有学生现场提问,O2与CO2是如何循环的?叶光富航天员解释说,O2是通过电解水的方法获得。航天员排入舱内的CO2通常是采用氢氧化锂(化学式为LiOH,化学性质与NaOH相似)吸收的。写出LiOH吸收CO2的化学方程式。
②“天宫第二课”中,王亚平老师将油和水混合振荡,得到了不分层的油水混合物,叶光富老师根据转动形成向心力,又实现了油和水的分离。请判断王亚平老师得到的不分层的油水混合物(填“是”或“不是”)溶液;生活中可用洗涤剂去油污,其原理是洗涤剂可以(填“溶解”或者“乳化”)油污。
(3)、出舱任务。①舱外航天服硬体部分采用铝合金和不锈钢材料,软体部分采用聚氨酯涂层的纺织材料。外衣表面的铝合金硬度与纯铝相比更(填“大”或“小”),使用的聚氨酯涂层属于(填字母代号);
a.无机非金属材料 b.合成材料 c.复合材料
②铝具有良好的抗腐蚀性能,其原因是。
三、综合应用题
-
17. 我国力争在2060年前实现“碳中和”(二氧化碳的排放与吸收平衡,实现“零排放”),保护环境。实现“碳中和”的部分措施如下:(1)、“碳减排”:使用氢能源能有效减少CO2的排放。我国科学家研究的一种储氢、释氢材料为AlH3 , 其中释放氢能原理是利用AlH3与H2O发生反应生成氢氧化铝和氢气,其反应的化学方程式为。(2)、“碳捕捉与封存”:将捕捉到CO2的制成干冰,干冰可用于人造云雾的原理是。(3)、“碳转化”:某大学化学团队开发出了镍基双金属催化剂,用来将二氧化碳和甲烷两种温室气体在一定条件下发生反应得到两种气体燃料( ),请根据化学方程式计算:132g二氧化碳转化生成氢气的质量。
四、实验题
-
18. I.某同学利用如图所示装置,设计探究燃烧条件的实验。
先用N2排尽装置中的空气,再将加装气球的具支试管放入盛有60℃热水的烧杯内,观察现象;然后将注射器内的H2O2溶液推入右边具支试管,继续观察现象。
 (1)、气球的作用是。(2)、右边具支试管内发生反应的化学方程式。(3)、通过该实验证明燃烧需要氧气的实验现象为。(4)、Ⅱ.稀盐酸与氢氧化钠溶液反应无明显现象,请根据下列图示回答问题。
(1)、气球的作用是。(2)、右边具支试管内发生反应的化学方程式。(3)、通过该实验证明燃烧需要氧气的实验现象为。(4)、Ⅱ.稀盐酸与氢氧化钠溶液反应无明显现象,请根据下列图示回答问题。


在以上实验过程中,酚酞溶液的作用是;B点对应溶液的溶质为;该反应的微观实质为。(5)、Ⅲ.用NaCl晶体配制50.0g16%的NaCl溶液,其操作如下图所示。

请回答下列问题
完成此实验正确的操作顺序是(填字母序号);a.溶解 b.把配好的溶液装入试剂瓶
c.称量和量取 d.计算
(6)、通过计算得出需氯化钠g,用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应(填字母序号)至天平平衡;a.增加适量氯化钠固体
b.减少适量氯化钠固体
c.移动游码
(7)、下列操作,会引起溶液中氯化钠的质量分数偏小的是。a.称量操作中用生锈的砝码
b.氯化钠晶体不纯
c.转移已配好的溶液时,有少量溶液溅出
五、流程题
-
19. I.某太阳能技术研究所利用太阳能聚光器获得高能量太阳能,设计了热化学循环反应两步制取H2 , 其流程如图所示
 (1)、反应I的基本反应类型为反应:。(2)、反应Ⅱ中涉及到化合价改变的元素有。(3)、Ⅱ.从海水中提取镁、制“碱”,都体现了人类改造物质的智慧。结合以下流程图(部分操作和条件已略去),回答相关问题:
(1)、反应I的基本反应类型为反应:。(2)、反应Ⅱ中涉及到化合价改变的元素有。(3)、Ⅱ.从海水中提取镁、制“碱”,都体现了人类改造物质的智慧。结合以下流程图(部分操作和条件已略去),回答相关问题:

【查阅资料】常温下,几种物质在水中的溶解度(单位:g)
粗盐中含有氯化镁、硫酸钠、氯化钙等可溶性杂质,通过步骤I加入三种溶液充分反应后过滤,再加入适量稀盐酸进行除杂。步骤I加入下列三种溶液的先后顺序为(填字母序号);NaCl NH4Cl NaHCO3 36.0 37.2 9.6 a.稍过量的Na2CO3溶液b.稍过量的BaCl2溶液
c.稍过量的NaOH溶液
(4)、母液中有MgCl2 , 却经历了步骤IV、V的转化过程,其目的是。(5)、步骤Ⅱ的反应方程式为 ,该过程有NaHCO3晶体析出,而没有氯化钠和氯化铵析出的原因是 , 该过程得到的副产品属于肥;(6)、步骤V反应的化学方程式为 , 基本反应类型是反应;(7)、由CaO制得石灰乳的化学方程式为 , 步骤IV用石灰乳而不用石灰水的原因是。六、科学探究题
-
20. 过氧化钙(CaO2)一种缓释型增氧剂,可用于鱼塘增氧、农作物栽培、污水处理等方面。
【查阅资料】过氧化钙在与水反应缓慢释氧时,另一种生成物可吸收CO2;
I.过氧化钙性质的研究
(1)、取少量过氧化钙放入试管中,加足量水,产生气泡,将带火星的木条伸进试管中,观察到带火星的木条复燃,说明有生成;(2)、对实验(1)所得浑浊液,进行如下探究:取少量浑浊液于图1的瓶中,先开启二氧化碳传感器测装置内二氧化碳的体积分数,然后用注射器注入足量稀盐酸。观察到白色浑浊消失,二氧化碳含量随时间的变化如图2所示。
依据实验现象及曲线,分析二氧化碳含量变化的原因(用化学方程式表示);
(3)、检查图1装置气密性的方法为。(4)、Ⅱ.制备过氧化钙 【查阅资料】①过氧化氢受热易分解;②氨气极易溶于水,并与水反应,形成氨水。 以氨气、双氧水、氯化钙为原料,可制得CaO2·8H2O沉淀,反应装置如图3所示:


图3装置A加热熟石灰和硫酸铵制得氨气,氨气溶于水形成氨水,通过分液漏斗注入三颈烧瓶。相比直接向三颈烧瓶溶液中通入氨气,利用分液漏斗注入氨水的优点是。(5)、制取CaO2·8H2O的化学方程式为 , 则Y的化学式为;该反应温度不能过高的原因是:①防止氨水挥发,②。Ⅲ.测定过氧化钙样品纯度
【查阅资料】1.过氧化钙易与酸反应: ;21. 过氧化钙样品中其他杂质不与盐酸反应生成气体。该小组取样品2.0g,设计如图4所示装置,通过测定O2体积,计算样品中CaO2的质量分数。
(1)、相同条件下,(填“装置A”或“装置B”)能使测定结果更准确;原因是。(2)、具体实验步骤如下:a.连接装置并检查气密性;
b.称量样品的质量2.0g;
c.装药品,调节量气装置两边液面相平,读取量气管刻度为10mL;
d.向广口瓶内加入稀盐酸,充分反应;
e.冷却至室温;
f.再次调节量气装置两边液面相平,读取量气管刻度为234mL。
步骤f中将量气装置两边液面调平的原因是。
(3)、实验状况下,每32gO2体积为22.4L,依据实验计算得到样品中过氧化钙含量为;若其他操作均正确,下列因素可使测定结果偏小的是(填序号)。a.广口瓶中残留少量O2
b.烘干时温度过高,生成了部分CaO
c.稀盐酸的用量不足
d.步骤f中没有调节量气装置两边液面相平,直接读数
(4)、【反思】结合以上探究可知,保存过氧化钙的注意事项是。
-
-
-
-