【高考真题】2023年山东省高考真题化学试题
试卷更新日期:2023-06-29 类型:高考真卷
一、单选题
-
1. 下列之物具有典型的齐鲁文化特色,据其主要化学成分不能与其他三种归为一类的是A、泰山墨玉 B、龙山黑陶 C、齐国刀币 D、淄博琉璃2. 实验室中使用盐酸、硫酸和硝酸时,对应关系错误的是A、稀盐酸:配制溶液 B、稀硫酸:蔗糖和淀粉的水解 C、稀硝酸:清洗附有银镜的试管 D、浓硫酸和浓硝酸的混合溶液:苯的磺化3. 下列分子属于极性分子的是A、 B、 C、 D、4. 实验室安全至关重要,下列实验室事故处理方法错误的是A、眼睛溅进酸液,先用大量水冲洗,再用饱和碳酸钠溶液冲洗 B、皮肤溅上碱液,先用大量水冲洗,再用的硼酸溶液冲洗 C、电器起火,先切断电源,再用二氧化碳灭火器灭火 D、活泼金属燃烧起火,用灭火毯(石棉布)灭火5. 石墨与F2在450℃反应,石墨层间插入F得到层状结构化合物(CF)x , 该物质仍具润滑性,其单层局部结构如图所示。下列关于该化合物的说法正确的是
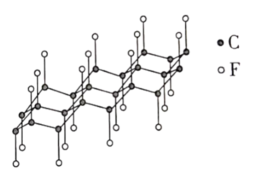 A、与石墨相比,(CF)x导电性增强 B、与石墨相比,(CF)x抗氧化性增强 C、(CF)x中的键长比短 D、1mol(CF)x中含有2xmol共价单键6. 鉴别浓度均为的、三种溶液,仅用下列一种方法不可行的是A、测定溶液 B、滴加酚酞试剂 C、滴加溶液 D、滴加饱和溶液7. 抗生素克拉维酸的结构简式如图所示,下列关于克拉维酸的说法错误的是
A、与石墨相比,(CF)x导电性增强 B、与石墨相比,(CF)x抗氧化性增强 C、(CF)x中的键长比短 D、1mol(CF)x中含有2xmol共价单键6. 鉴别浓度均为的、三种溶液,仅用下列一种方法不可行的是A、测定溶液 B、滴加酚酞试剂 C、滴加溶液 D、滴加饱和溶液7. 抗生素克拉维酸的结构简式如图所示,下列关于克拉维酸的说法错误的是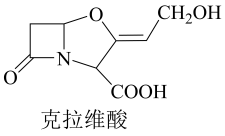 A、存在顺反异构 B、含有5种官能团 C、可形成分子内氢键和分子间氢键 D、1mol该物质最多可与1molNaOH反应8. 一定条件下,乙酸酐醇解反应可进行完全,利用此反应定量测定有机醇中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:
A、存在顺反异构 B、含有5种官能团 C、可形成分子内氢键和分子间氢键 D、1mol该物质最多可与1molNaOH反应8. 一定条件下,乙酸酐醇解反应可进行完全,利用此反应定量测定有机醇中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:①配制一定浓度的乙酸酐-苯溶液。
②量取一定体积乙酸酐-苯溶液置于锥形瓶中,加入样品,充分反应后,加适量水使剩余乙酸酐完全水解:。
③加指示剂并用甲醇标准溶液滴定至终点,消耗标准溶液。
④在相同条件下,量取相同体积的乙酸酐-苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用甲醇标准溶液滴定至终点,消耗标准溶液。对于上述实验,下列做法正确的是
A、进行容量瓶检漏时,倒置一次即可 B、滴入半滴标准溶液,锥形瓶中溶液变色,即可判定达滴定终点 C、滴定读数时,应单手持滴定管上端并保持其自然垂直 D、滴定读数时,应双手一上一下持滴定管9. 一定条件下,乙酸酐醇解反应可进行完全,利用此反应定量测定有机醇中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:①配制一定浓度的乙酸酐-苯溶液。
②量取一定体积乙酸酐-苯溶液置于锥形瓶中,加入样品,充分反应后,加适量水使剩余乙酸酐完全水解:。
③加指示剂并用甲醇标准溶液滴定至终点,消耗标准溶液。
④在相同条件下,量取相同体积的乙酸酐-苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用甲醇标准溶液滴定至终点,消耗标准溶液。样品中羟基含量(质量分数)计算正确的是
A、 B、 C、 D、10. 一定条件下,乙酸酐醇解反应可进行完全,利用此反应定量测定有机醇中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:①配制一定浓度的乙酸酐-苯溶液。
②量取一定体积乙酸酐-苯溶液置于锥形瓶中,加入样品,充分反应后,加适量水使剩余乙酸酐完全水解:。
③加指示剂并用甲醇标准溶液滴定至终点,消耗标准溶液。
④在相同条件下,量取相同体积的乙酸酐-苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用-甲醇标准溶液滴定至终点,消耗标准溶液。根据上述实验原理,下列说法正确的是
A、可以用乙酸代替乙酸酐进行上述实验 B、若因甲醇挥发造成标准溶液浓度发生变化,将导致测定结果偏小 C、步骤③滴定时,不慎将锥形瓶内溶液溅出,将导致测定结果偏小 D、步骤④中,若加水量不足,将导致测定结果偏大二、多选题
-
11. 利用热再生氨电池可实现电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加相同的电镀废液,向甲室加入足量氨水后电池开始工作。下列说法正确的是
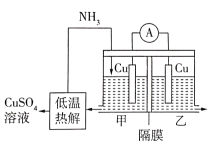 A、甲室电极为正极 B、隔膜为阳离子膜 C、电池总反应为: D、扩散到乙室将对电池电动势产生影响
A、甲室电极为正极 B、隔膜为阳离子膜 C、电池总反应为: D、扩散到乙室将对电池电动势产生影响三、单选题
-
12. 有机物的异构化反应如图所示,下列说法错误的是
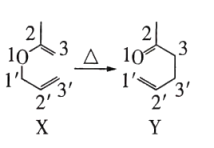 A、依据红外光谱可确证X、Y存在不同的官能团 B、除氢原子外,X中其他原子可能共平面 C、含醛基和碳碳双键且有手性碳原子的Y的同分异构体有4种(不考虑立体异构) D、类比上述反应,
A、依据红外光谱可确证X、Y存在不同的官能团 B、除氢原子外,X中其他原子可能共平面 C、含醛基和碳碳双键且有手性碳原子的Y的同分异构体有4种(不考虑立体异构) D、类比上述反应,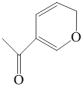 的异构化产物可发生银镜反应和加聚反应
的异构化产物可发生银镜反应和加聚反应
四、多选题
-
13. 一种制备的工艺路线如图所示,反应Ⅱ所得溶液在3~4之间,反应Ⅲ需及时补加以保持反应在条件下进行。常温下,的电离平衡常数。下列说法正确的是
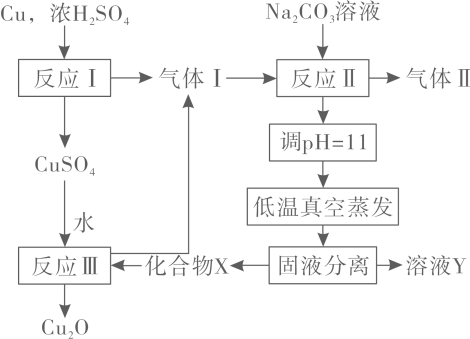 A、反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应 B、低温真空蒸发主要目的是防止被氧化 C、溶液Y可循环用于反应Ⅱ所在操作单元吸收气体Ⅰ D、若产量不变,参与反应Ⅲ的与物质的量之比增大时,需补加的量减少14. 一定条件下,化合物E和TFAA合成H的反应路径如下:
A、反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应 B、低温真空蒸发主要目的是防止被氧化 C、溶液Y可循环用于反应Ⅱ所在操作单元吸收气体Ⅰ D、若产量不变,参与反应Ⅲ的与物质的量之比增大时,需补加的量减少14. 一定条件下,化合物E和TFAA合成H的反应路径如下: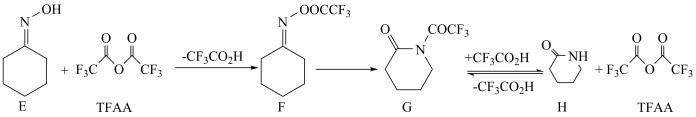
已知反应初始E的浓度为0.10mol∙L-1 , TFAA的浓度为0.08mol∙L-1 , 部分物种的浓度随时间的变化关系如图所示,忽略反应过程中的体积变化。下列说法正确的是
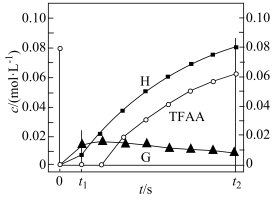 A、t1时刻,体系中有E存在 B、t2时刻,体系中无F存在 C、E和TFAA反应生成F的活化能很小 D、反应达平衡后,TFAA的浓度为0.08mol∙L-1
A、t1时刻,体系中有E存在 B、t2时刻,体系中无F存在 C、E和TFAA反应生成F的活化能很小 D、反应达平衡后,TFAA的浓度为0.08mol∙L-1五、单选题
-
15. 在含HgI2(g)的溶液中,一定c(I-)范围内,存在平衡关系:;;;; , 平衡常数依次为。已知、 , 、随的变化关系如图所示,下列说法错误的是
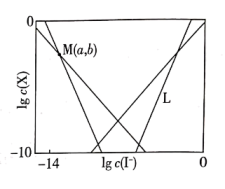 A、线表示的变化情况 B、随增大,先增大后减小 C、 D、溶液中I元素与元素的物质的量之比始终为
A、线表示的变化情况 B、随增大,先增大后减小 C、 D、溶液中I元素与元素的物质的量之比始终为六、结构与性质
-
16. 卤素可形成许多结构和性质特殊的化合物。回答下列问题:
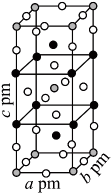 (1)、时,与冰反应生成利。常温常压下,为无色气体,固态的晶体类型为 , 水解反应的产物为(填化学式)。(2)、中心原子为 , 中心原子为 , 二者均为形结构,但中存在大键。中原子的轨道杂化方式;为键角键角(填“>”“ <”或“=”)。比较与中键的键长并说明原因。(3)、一定条件下,和反应生成和化合物。已知属于四方晶系,晶胞结构如图所示(晶胞参数),其中化合价为。上述反应的化学方程式为。若阿伏加德罗常数的值为 , 化合物的密度(用含的代数式表示)。
(1)、时,与冰反应生成利。常温常压下,为无色气体,固态的晶体类型为 , 水解反应的产物为(填化学式)。(2)、中心原子为 , 中心原子为 , 二者均为形结构,但中存在大键。中原子的轨道杂化方式;为键角键角(填“>”“ <”或“=”)。比较与中键的键长并说明原因。(3)、一定条件下,和反应生成和化合物。已知属于四方晶系,晶胞结构如图所示(晶胞参数),其中化合价为。上述反应的化学方程式为。若阿伏加德罗常数的值为 , 化合物的密度(用含的代数式表示)。七、工业流程题
-
17. 盐湖卤水(主要含、和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备的工艺流程如下:
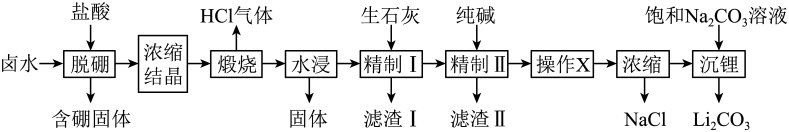
已知:常温下,。相关化合物的溶解度与温度的关系如图所示。

回答下列问题:
(1)、含硼固体中的在水中存在平衡:(常温下,);与溶液反应可制备硼砂。常温下,在硼砂溶液中,水解生成等物质的量浓度的和 , 该水解反应的离子方程式为 , 该溶液。(2)、滤渣Ⅰ的主要成分是(填化学式);精制Ⅰ后溶液中的浓度为 , 则常温下精制Ⅱ过程中浓度应控制在以下。若脱硼后直接进行精制Ⅰ,除无法回收外,还将增加的用量(填化学式)。(3)、精制Ⅱ的目的是;进行操作时应选择的试剂是 , 若不进行该操作而直接浓缩,将导致。八、实验题
-
18. 三氯甲硅烷是制取高纯硅的重要原料,常温下为无色液体,沸点为 , 熔点为 , 易水解。实验室根据反应 , 利用如下装置制备粗品(加热及夹持装置略)。回答下列问题:
 (1)、制备时进行操作:(ⅰ)……;(ⅱ)将盛有砫粉的瓷舟置于管式炉中;(ⅲ)通入 , 一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为;判断制备反应结束的实验现象是。图示装置存在的两处缺陷是。(2)、已知电负性在浓溶液中发生反应的化学方程式为。(3)、采用如下方法测定溶有少量的纯度。
(1)、制备时进行操作:(ⅰ)……;(ⅱ)将盛有砫粉的瓷舟置于管式炉中;(ⅲ)通入 , 一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为;判断制备反应结束的实验现象是。图示装置存在的两处缺陷是。(2)、已知电负性在浓溶液中发生反应的化学方程式为。(3)、采用如下方法测定溶有少量的纯度。样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:① , ②(填操作名称),③称量等操作,测得所得固体氧化物质量为 , 从下列仪器中选出①、②中需使用的仪器,依次为(填标号)。测得样品纯度为(用含、的代数式表示)。

九、有机推断题
-
19. 根据杀虫剂氟铃脲(G)的两条合成路线,回答下列问题。
已知:Ⅰ.R1NH2+OCNR2→

Ⅱ.

路线:
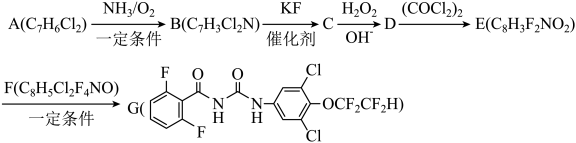 (1)、A的化学名称为(用系统命名法命名);的化学方程式为;D中含氧官能团的名称为;E的结构简式为。
(1)、A的化学名称为(用系统命名法命名);的化学方程式为;D中含氧官能团的名称为;E的结构简式为。路线二:
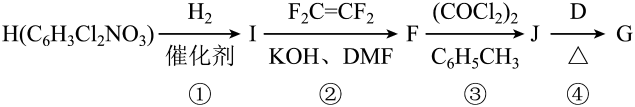 (2)、H中有种化学环境的氢,①~④属于加成反应的是(填序号);J中原子的轨道杂化方式有种。
(2)、H中有种化学环境的氢,①~④属于加成反应的是(填序号);J中原子的轨道杂化方式有种。十、原理综合题
-
20. 一定条件下,水气变换反应的中间产物是。为探究该反应过程,研究水溶液在密封石英管中的分子反应:
Ⅰ.
Ⅱ.
研究发现,在反应Ⅰ、Ⅱ中,仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
(1)、一定条件下,反应Ⅰ、Ⅱ的焓变分别为、 , 则该条件下水气变换反应的焓变(用含的代数式表示)。(2)、反应Ⅰ正反应速率方程为: , k为反应速率常数。温度下,电离平衡常数为 , 当平衡浓度为时,浓度为 , 此时反应Ⅰ应速率(用含和k的代数式表示)。(3)、温度下,在密封石英管内完全充满水溶液,使分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。时刻测得的浓度分别为 , 反应Ⅱ达平衡时,测得的浓度为。体系达平衡后(用含y的代数式表示,下同),反应Ⅱ的平衡常数为。
相同条件下,若反应起始时溶液中同时还含有盐酸,则图示点中,的浓度峰值点可能是(填标号)。与不同盐酸相比,达浓度峰值时,浓度(填“增大”“减小”或“不变”),的反应(填“增大”“减小”或“不变”)。
-
-
-
-
-
-
-