湖北省武汉市2023年中考化学真题
试卷更新日期:2023-06-28 类型:中考真卷
一、单选题
-
1. 《天工开物》被誉为“中国17世纪的工艺百科全书”,其中记载的下列工艺涉及化学变化的是A、纺纱织布 B、伐木制舟 C、烧制陶瓷 D、海水晒盐2. 实验操作应严谨规范。下列实验操作正确的是A、取用锌粒
 B、移走蒸发皿
B、移走蒸发皿 C、稀释浓硫酸
C、稀释浓硫酸 D、读取液体体积
D、读取液体体积 3. 某管道疏通剂标签上的部分文字如图所示。下列说法正确的是
3. 某管道疏通剂标签上的部分文字如图所示。下列说法正确的是 A、氢氧化钠中阴离子的符号为OH-2 B、氢氧化钠中含有一种金属元素 C、铝原子的结构示意图为
A、氢氧化钠中阴离子的符号为OH-2 B、氢氧化钠中含有一种金属元素 C、铝原子的结构示意图为 D、硝酸钠的化学式为NO3Na
4. 劳动创造美好生活。下列与劳动项目相关的解释错误的是
D、硝酸钠的化学式为NO3Na
4. 劳动创造美好生活。下列与劳动项目相关的解释错误的是选项
劳动项目
解释
A
在燃气灶上用铁锅炒菜
利用铁的导电性
B
用食醋洗涤热水瓶内的水垢
食醋具有酸性
C
给校园中的花草施用氯化钾
氯化钾属于钾肥
D
用干布擦净被雨水淋湿的自行车
防止铁生锈
A、A B、B C、C D、D5. 以CO2和H2为原料合成C2H4是综合利用二氧化碳、实现“碳中和”的研究热点。相关反应的微观示意图如下所示。
关于该反应,下列说法正滩的是
A、参加反成的甲和乙的质量比为11:1 B、生成丙和丁的分子个数比为1:2 C、反应物和生成物共涉及两种氧化物 D、反应前后元素的化合价都不变6. 对比实验是进行科学探究的重要方式。下图所示实验均用到了对比的方法。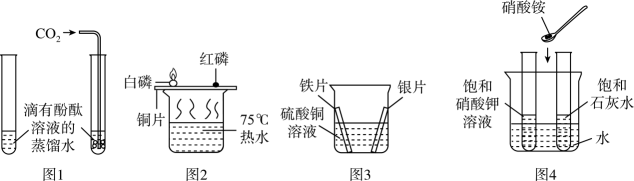
下列说法错误的是
A、图1实验能验证二氧化碳与水发生了反应 B、图2实验能说明红磷的着火点比白磷的高 C、图3实验能验证金属活动性顺序为Fe>Cu>Ag D、图4实验能说明硝酸铵固体溶于水会吸收热量7. 归纳整理是学习化学的重要方法。下图涉及的是初中化学常见物质及反应,甲、乙、丁中至少含有一种相同的元素。其中“→”表示一种物质通过一步反应可以转化为另一种物质,“一”表示相连两种物质可以反应。(反应条件、部分反应物、生成物已略去)
下列说法错误的是
A、若甲能使带火星木条复燃,则丁可能具有还原性 B、若丁可用于治疗胃酸过多,则甲可能是胃液中含有的酸 C、若乙、丙含有相同的金属元素,则丙、丁可以发生复分解反应 D、若丙、丁常温下都是黑色固体,则乙→CO2的反应可以为置换反应8. 化学兴趣小组探究酸碱盐的化学性质,进行如图1所示实验。实验后将甲、乙两支试管内的物质倒入烧杯,如图2所示,充分反应,静置,为探究烧杯内溶液的组成,取适量上层清液,向其中逐滴滴入质量分数为1.71%的氢氧化钡溶液,产生沉淀的质量与加入氢氧化钡溶液质量的变化关系如图3所示。
下列说法错误的是
A、图1充分反应静置后,乙试管内上层清液中一定含有两种酸 B、图2烧杯内可以观察到沉淀逐渐减少,最终只剩余白色沉淀 C、图2充分反应静置后,烧杯内上层清液中含有三种阳离子和两种阴离子 D、图3中加入30.0g氢氧化钡溶液时,生成沉淀的质量为0.797g二、填空题
-
9. 石墨、活性炭和木炭在生产生活中有着广泛的应用。

回答下列问题:
(1)、石墨的用途可以是____。A、用于制铅笔芯 B、用作电极 C、用于切割大理石(2)、活性炭作冰箱除味剂,是利用其(填“物理”或“化学”)性质。(3)、木炭可用作燃料。木炭完全燃烧的化学方程式为。10. 化学兴趣小组探究碳酸氢钠、氯化钾、氯化钠和氯化铵的溶解性时,查阅资料如下:表1物质在不同温度时的溶解度
温度/℃
0
10
20
30
溶解度/g
NaHCO3
6.9
8.2
9.6
11.1
KCl
27.6
31.0
34.0
37.0
NaCl
35.7
35.8
36.0
36.3
NH4Cl
29.4
33.3
37.2
41.4
表2溶解度的相对大小(20℃)
溶解度/g
一般称为
<0.01
难溶
0.01~1
微溶
1~10
可溶
>10
易溶
回答下列问题:
(1)、10℃时,NaCl的溶解度为。(2)、根据20℃时上述四种物质的溶解度,判断其中属于“可溶”的物质是。(3)、将30℃时上述四种物质的饱和溶液各ag分别降温到0℃,析出同体质量最大的物质是。(4)、20℃时,将氯化钠和氯化铵各mg分别放入两只烧杯中,再分别加入ng水,充分搅拌。下列说法正确的是____。(填标号)A、若两只烧杯中均无固体剩余,则所得氯化铵溶液一定是不饱和溶液 B、若两只烧杯中均有固体剩余,则所得溶液中溶质的质量分数:氯化铵>氯化钠 C、若m≤0.36,则所得溶液中溶质的质量分数:氯化铵=氯化钠 D、若所得溶液中只有一种是饱和溶液,则0.36n≤m≤0.372n三、流程题
-
11. 硫酸锌可制备各种含锌材料,在防腐、医学上有很多应用。菱锌矿的主要成分是ZnCO3 , 还含有少量的二氧化硅和氧化铁。以菱锌和为原料制备ZnSO4·7H2O的工艺流程如下图所示。(二氧化硅难溶于水,也不与稀硫酸反应)

回答下列问题:
(1)、菱锌矿属于(填“纯净物”或“混合物”)。(2)、“酸浸”中观察到的现象是。(3)、滤液1中含有的阳离子是。(填离子符号)(4)、“转化”中加入足量锌粉,反应的化学方程式有:和(写一个即可)。(5)、下列说法正确的是____(填标号)。A、“粉碎”是为了使菱锌矿在“酸浸”中与稀硫酸充分反应 B、在“转化”中加入锌粉,若无气泡冒出,说明锌粉已足量 C、滤渣甲、滤渣乙均能与稀硫酸反应产生气体 D、滤液2的质量一定比滤液1的质量大四、科学探究题
-
12. 分类回收塑料制品是环境保护的重要研究课题。化学兴趣小组利用过氧化氢溶液取氧气,并用燃烧法探究塑料的组成。
I、设计氧气的发生装图
 (1)、I、设计氧气的发生装图
(1)、I、设计氧气的发生装图
图1中仪器X的名称为(填“集气瓶”或“锥形瓶”)。 (2)、图2中铂丝可催化过氧化氢分解产生氧气。实验过程中,若观察到安全管内液面上升,说明装置内压强过大,此时可以采取的安全措施是。(3)、Ⅱ、探究某塑料的组成
(2)、图2中铂丝可催化过氧化氢分解产生氧气。实验过程中,若观察到安全管内液面上升,说明装置内压强过大,此时可以采取的安全措施是。(3)、Ⅱ、探究某塑料的组成某塑料含有碳、氢元素,可能还含有氧和氯元素中的一种或两种。该塑料充分燃烧除生成二氧化碳和水蒸气外,还可能生成氯化氢气体。取mg该塑料样品与足量干燥的氧气充分反应,用图3所示装置吸收生成的气体。实验过程中,观察到装置乙溶液中产生白色沉淀。当气体被充分吸收后,测得装置甲、乙、丙的质量在反应前后分别增加m1g、m2g和m3g。(无水氯化钙可作干燥剂,装置气密性良好,装置甲、乙、丙、丁中试剂均足量)
装置乙溶液中产生白色沉淀,说明该塑料含有氯元素。产生白色沉淀的化学方程式为。 (4)、该塑料样品中氢元素的质量为(用代数式表示)。(5)、关于该实验,下列说法正确的是____。(填标号)A、该塑料中碳原子与氯原子的个数比为73m3:88m2 B、若 , 则该塑料不含氧元素 C、若将装置乙与丙互换,也能够达到实验目的 D、若去除装置丁,则对测定氢元素的质量无影响
(4)、该塑料样品中氢元素的质量为(用代数式表示)。(5)、关于该实验,下列说法正确的是____。(填标号)A、该塑料中碳原子与氯原子的个数比为73m3:88m2 B、若 , 则该塑料不含氧元素 C、若将装置乙与丙互换,也能够达到实验目的 D、若去除装置丁,则对测定氢元素的质量无影响五、计算题
-
13. 实验室有一瓶未知浓度的盐酸。为测定该盐酸中溶质的质量分数,化学兴趣小组向25.0g盐酸样品中逐滴滴入质量分数为20.0%的氢氧化钠溶液,所得溶液温度与加入氢氧化钠溶液质量的变化关系如图所示。

回答下列问题:
(1)、氢氧化钠与盐酸反应(填“放出”或“吸收”)热量。(2)、计算该盐酸中溶质的质量分数(精确到0.1%)。
-
-