广东省广州市2023年初中学业水平考试化学试题
试卷更新日期:2023-06-27 类型:中考真卷
一、选择题:本题包括14小题,每小题3分,共42分。每小题给出的四个选项中,只有一项最符合题意。错选、不选、多选或涂改不清的,均不给分。
-
1. 广府文化独具特色,如广彩、广绣、扒龙舟、广东剪纸等。下列说法正确的是A、烧制陶瓷的主要原料黏土是混合物 B、制作广绣的蚕丝属于有机合成材料 C、龙舟表面所涂的红色颜料是氧化铜 D、将彩纸剪成精美的图案是化学变化2. 推进绿美广东生态建设从我做起。下列做法不利于生态保护的是A、减少使用一次性塑料用品 B、将生活垃圾集中露天焚烧 C、从废旧汽车蓄电池中回收金属铅 D、研发和使用更加低毒高效的农药3. 生机勃勃的地球离不开空气,下列关于空气的说法不正确的是A、稀有气体可用于霓虹灯的制作 B、CO2是植物光合作用的重要原料 C、SO2排放是导致酸雨的原因之一 D、PM2.5的含量越高空气质量越好4. 化学元素与人体健康息息相关,下列说法不正确的是A、饮用运动饮料补充钠、钾等元素 B、服用补铁剂治疗骨质疏松症 C、缺锌会影响青少年生长发育 D、汞、镉属于对人体有害的元素5. 在家务劳动中感悟化学原理。下列家务劳动涉及的化学知识正确的是
选项
家务劳动
化学知识
A
用天然气作燃料生火做饭
天然气的成分是CO和H2
B
用洗洁精清洗餐具
洗洁精与油污发生中和反应
C
用食盐调节汤的咸淡
食盐和水的比例影响NaCl的浓度
D
用NH4NO3配制绿萝生长的营养液
NH4NO3是复合肥料
A、A B、B C、C D、D6. 对下列宏观事实的微观解释,合理的是A、空气湿度增大:单位体积空气中水分子数目增多 B、石墨一定条件下转变成金刚石:原子种类发生改变 C、CO2气体制成干冰:二氧化碳分子由运动变为静止 D、稀硫酸能使紫色石蕊溶液变红:溶液中含硫酸根离子7. 钕(Nd)等稀土元素是一类有重要用途的资源。下列说法正确的是 A、钕属于非金属元素 B、一个钕原子的质量为144.2g C、Nd3+的核外电子数为60 D、一个钕原子含60个质子8. 某学习小组制作的净水器如图,关于该净水器的说法正确的是
A、钕属于非金属元素 B、一个钕原子的质量为144.2g C、Nd3+的核外电子数为60 D、一个钕原子含60个质子8. 某学习小组制作的净水器如图,关于该净水器的说法正确的是
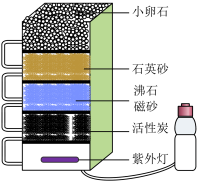 A、能把自来水变成纯净物 B、能除尽水中的可溶性杂质 C、能除去水中的色素和异味 D、净水时水最后流经小卵石9. 液氢、煤油(含C、H元素)、液氧可用作神舟飞船运载火箭的推进剂,下列说法不正确的是A、火箭发射时仅靠空气不足以使燃料充分燃烧 B、液氢和煤油完全燃烧的反应都是化合反应 C、液氢是高能燃料且燃烧后的产物无污染 D、飞船进入轨道后主要利用太阳能维持工作10. 用电解水实验探究水的元素组成,下列说法不正确的是
A、能把自来水变成纯净物 B、能除尽水中的可溶性杂质 C、能除去水中的色素和异味 D、净水时水最后流经小卵石9. 液氢、煤油(含C、H元素)、液氧可用作神舟飞船运载火箭的推进剂,下列说法不正确的是A、火箭发射时仅靠空气不足以使燃料充分燃烧 B、液氢和煤油完全燃烧的反应都是化合反应 C、液氢是高能燃料且燃烧后的产物无污染 D、飞船进入轨道后主要利用太阳能维持工作10. 用电解水实验探究水的元素组成,下列说法不正确的是 A、a管和b管中气体体积比约为2:1 B、b管中的气体能使燃着的木条烧得更旺 C、该探究说明水中含有氢分子和氧分子 D、该探究的依据是化学变化前后元素种类不变11. N2是重要的化工原料,N2和H2反应的微观示意图如下,下列说法正确的是
A、a管和b管中气体体积比约为2:1 B、b管中的气体能使燃着的木条烧得更旺 C、该探究说明水中含有氢分子和氧分子 D、该探究的依据是化学变化前后元素种类不变11. N2是重要的化工原料,N2和H2反应的微观示意图如下,下列说法正确的是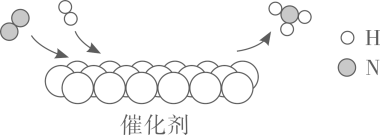 A、常温下N2的化学性质很活泼 B、
A、常温下N2的化学性质很活泼 B、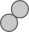 和
和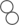 按个数比1:1进行该反应
C、
按个数比1:1进行该反应
C、 中N、H元素的质量比为1:3
D、反应前后分子种类和数目发生变化
12. 下列果汁或饮料中,呈弱碱性的是A、苹果汁(pH≈3) B、番茄汁(pH≈4) C、西瓜汁(pH≈6) D、苏打水(pH≈9)13. 钴(Co)的金属活动性与铁相似,钴的化合物相关性质如下、下列预测合理的是
中N、H元素的质量比为1:3
D、反应前后分子种类和数目发生变化
12. 下列果汁或饮料中,呈弱碱性的是A、苹果汁(pH≈3) B、番茄汁(pH≈4) C、西瓜汁(pH≈6) D、苏打水(pH≈9)13. 钴(Co)的金属活动性与铁相似,钴的化合物相关性质如下、下列预测合理的是物质
CoO
Co(OH)2
CoCl2
CoCO3
在水中的溶解性
难溶,灰绿色
固体
难溶,粉红色
固体
易溶,溶液呈
粉红色
难溶,粉红色
固体
A、Co能从MgCl2溶液中置换出Mg B、CoO能与盐酸反应得到粉红色溶液 C、CoCO3能与盐酸反应生成H2 D、Co(OH)2可由Co与NaOH溶液反应制得14. 关于下列实验的说法,正确的是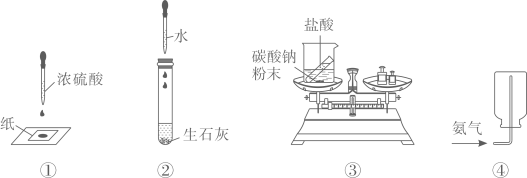 A、实验①:滴有浓硫酸的部位变黑,说明浓硫酸有腐蚀性 B、实验②:试管壁发烫,说明物质溶解过程伴随热量变化 C、实验③:反应后总质量减小,说明该反应不符合质量守恒定律 D、实验④:氨气用向下排空气法收集,说明氨气的密度比空气大
A、实验①:滴有浓硫酸的部位变黑,说明浓硫酸有腐蚀性 B、实验②:试管壁发烫,说明物质溶解过程伴随热量变化 C、实验③:反应后总质量减小,说明该反应不符合质量守恒定律 D、实验④:氨气用向下排空气法收集,说明氨气的密度比空气大二、非选择题:本题包括6小题,共48分。
-
15. 磷及其化合物广泛应用于新能源汽车电池的制造,如LiFePO4等。(1)、白磷保存在水中可以防止自燃,主要原因是。(2)、测定空气中氧气含量时,消耗0.4g氧气至少有g红磷参加反应。(3)、磷有多种化合价,PCl5读作;已知 , 磷酸根离子的化学符号是;根据化合物的分类,LiFePO4属于。16. 我国古代科技璀璨夺目,金属的冶炼与使用在当时已处于世界先进水平。(1)、日常生活中,适合制作电缆的金属是(填标号)。
A.金 B. 铜 C. 汞 D. 钨
(2)、明代《天工开物》描述了锡的冶炼方法,如图a。①原料锡砂中的SnO2和木炭反应得到锡和二氧化碳,化学方程式为。
②炼锡时混入少许铅形成合金,产物更易熔化流出,原因是。
 (3)、图b为古代炼锌工艺原理示意图。炉甘石成分是ZnCO3 , 高温易分解生成ZnO。
(3)、图b为古代炼锌工艺原理示意图。炉甘石成分是ZnCO3 , 高温易分解生成ZnO。①泥罐外煤饼的主要作用是燃烧提供热量,泥罐内煤粉的主要作用是。
②已知锌的沸点为907℃。泥罐下部温度可达1200℃,上部约为600℃,该工艺从反应混合物中收集液态锌的方法属于(填标号)。
A.结晶 B.蒸发 C.蒸馏 D.升华
③必须冷却后才能取锌,是为了防止发生反应:(写化学方程式)。
(4)、湿法冶金利用置换反应。向Cu(NO3)2、AgNO3混合液中加入Fe粉,充分反应后过滤。若滤渣中有两种金属,则滤液中一定不含的金属阳离子是。17. 制盐在我国有着悠久的历史。某盐湖水样品含有NaCl、Na2SO4及少量MgSO4和CaSO4 , 某小组从中获取NaCl和Na2SO4的主要过程如下: (1)、“除杂1”应依次加入的两种试剂是、 , “除杂2”应加入的试剂是。(除杂限选试剂:HCl、HNO3、Na2CO3、Ca(OH)2)(2)、将“溶液A”在80℃蒸发浓缩,至有少量固体析出。
(1)、“除杂1”应依次加入的两种试剂是、 , “除杂2”应加入的试剂是。(除杂限选试剂:HCl、HNO3、Na2CO3、Ca(OH)2)(2)、将“溶液A”在80℃蒸发浓缩,至有少量固体析出。
①该小组分析溶解度曲线,推测析出的少量固体是NaCl,但检验后却发现是Na2SO4。请作出合理解释:。
②该小组停止蒸发浓缩,经、过滤得到大量Na2SO4固体及母液;将母液中的NaCl分离出来,操作是。
(3)、设计由硫磺(单质硫)生产Na2SO4的转化路径,依次写出反应的化学方程式:。(提示:常见+4价硫的化合物可与O2化合为+6价硫的化合物)18. 通过观察和实验等方法获取证据是科学探究的重要环节。(1)、向少量Fe(OH)3沉淀中加入稀盐酸,观察到 , 可判断发生了反应。(2)、向Ca(OH)2溶液中通入CO2 , 观察到 , 可判断发生了反应。(3)、向氢氧化钙溶液中滴加稀盐酸,无明显现象。两位同学欲获取反应发生的证据。①甲同学向滴有酚酞溶液的氢氧化钙溶液中,逐滴滴加稀盐酸至足量,溶液由红色变成无色,证明溶液中 , 可判断Ca(OH)2与HCl发生了反应。
②乙同学将氢氧化钙溶液与稀盐酸混合,然后检验了混合液中含有Ca2+和Cl- , 他据此认为Ca(OH)2与HCl发生了反应,且生成了CaCl2。你认为乙同学是否找到了反应发生的证据?请说出你的观点并阐述理由:。
(4)、如图a所示,向NaOH稀溶液中缓缓通入HCl气体,测定该过程中溶液导电能力的变化,实验结果如图b.(溶液体积、温度的变化可忽略)
①分析A→B段变化,其他条件相同,导电能力:OH-Cl-。(填“>”“<”或“=”)
②分析B→C段变化,溶液的导电能力除了与离子种类有关,还与有关。
19. 某学习小组用不同浓度的溶液浇灌植物,研究重金属对植物生长的影响。(1)、该小组首先研究了CuSO4的影响。每次施用的浇灌液均为100mL,配液方案如下:(本研究所用溶液很稀,密度均近似看作1g/cm3)
编号
浇灌液中CuSO4的
浓度
总体积/mL
5%CuSO4溶液的
用量/mL
水的用量/mL
盆1
5%
100
100
0
盆2
3%
100
60
40
盆3
1%
100
a
b
盆4
w
100
c
d
①补充盆3的配液数据:a= , b=。
②为了获得严谨的结论,合理设计盆4的配液方案:w= , d=。
(2)、该小组还研究了BaCl2的影响。研究结束后该小组将未用完的BaCl2溶液和CuSO4溶液直接混合,准备作无害化处理。①混合后产生大量白色沉淀,反应的化学方程式为。
②过滤,所得蓝色滤液中含有的溶质可能是:
假设一:只有CuCl2 假设二:CuCl2和BaCl2 假设三:。
③设计实验确定蓝色滤液的成分,完成下表:
实验操作
现象与结论
取少量滤液于试管中,。
说明假设二不成立。
。
, 说明假设三成立。
20. 某小组采用图a所示实验装置探究CO还原Fe2O3时,出现了争论。甲同学观察到固体由红色变成黑色,推断黑色固体是Fe;乙同学提出质疑,认为黑色固体可能是Fe3O4 , 并查阅了资料:Fe3O4可被磁铁吸引,几乎不溶于稀的酸溶液。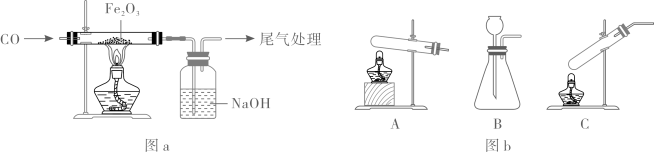 (1)、制备CO的原理是:(HCOOH在常温下为液态),图b所示三种气体发生装置中,可用于制备CO的是(填标号)。(2)、若甲同学推断正确,反应的化学方程式为。(3)、对乙同学提出的质疑进行分析和验证。
(1)、制备CO的原理是:(HCOOH在常温下为液态),图b所示三种气体发生装置中,可用于制备CO的是(填标号)。(2)、若甲同学推断正确,反应的化学方程式为。(3)、对乙同学提出的质疑进行分析和验证。①定量分析物质组成可知,该反应生成Fe3O4是合理的,理由是。
②该小组通过对黑色固体进行检验,证明同时含有Fe3O4和Fe.检验的操作和现象是:取样于试管中,。
(4)、该小组为了探索CO还原Fe2O3与温度的关系,走访了某钢铁厂。工程师用SDTQ热分析仪对该反应进行研究,根据不同温度下所得固体的质量,推导对应的固体成分,结果如图。
①用CO炼铁时,还原Fe2O3的温度应不低于℃。(填“400”“600”或“800”)
②图中:x=。
③该小组查阅资料得知酒精灯加热温度为600℃左右,他们发现上述对黑色固体成分的检验结果与图像有矛盾,推测黑色固体在冷却过程中发生了以下反应:。