山东省潍坊市安丘市2022-2023学年高一上学期期末考试化学试题
试卷更新日期:2023-06-21 类型:期末考试
一、单选题
-
1. 化学与生产、生活、科技密切相关。下列说法正确的是( )A、“雨过天晴云破处”所描述的瓷器青色,来自氧化铁 B、古剑“沈卢”“以剂钢为刃,柔铁为茎干……”,剂钢是铁合金,其硬度比纯铁小 C、“朝坛雾卷,曙岭烟沉”中的雾是一种胶体,能产生丁达尔效应 D、“青蒿一握,以水二升渍,绞取汁”,青蒿素提取过程中涉及化学变化2. 用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作.下列图示对应的操作规范的是( )A、
 称量
B、
称量
B、 溶解
C、
溶解
C、 转移
D、
转移
D、 定容
3. 下列过程涉及氧化还原反应的是 ( )A、生物固氮 B、添加碳酸氢钠蒸馒头 C、食醋除水垢 D、侯氏制碱法制备纯碱4. 下列说法不正确的是 ( )A、硫粉可用于除去洒落的汞 B、氨气可用作制冷剂 C、“84”消毒液可用于皮毛制品及钢铁制品的消毒 D、可用作食品添加剂5. 下列物质不能由两种单质直接反应生成的是 ( )A、 B、 C、 D、6. 实验小组设计如图所示实验,探究Fe与稀硝酸、稀硫酸的反应。实验过程①、③管口处产生红棕色气体,经检验③中反应无产生。
定容
3. 下列过程涉及氧化还原反应的是 ( )A、生物固氮 B、添加碳酸氢钠蒸馒头 C、食醋除水垢 D、侯氏制碱法制备纯碱4. 下列说法不正确的是 ( )A、硫粉可用于除去洒落的汞 B、氨气可用作制冷剂 C、“84”消毒液可用于皮毛制品及钢铁制品的消毒 D、可用作食品添加剂5. 下列物质不能由两种单质直接反应生成的是 ( )A、 B、 C、 D、6. 实验小组设计如图所示实验,探究Fe与稀硝酸、稀硫酸的反应。实验过程①、③管口处产生红棕色气体,经检验③中反应无产生。
下列说法正确的是( )
A、①中反应产生 , ③中反应产生 B、②中存在大量阳离子和 C、③中一定既含有 , 又含有 D、实验结论:稀硝酸的氧化性强于稀硫酸7. 下列离子方程式符合题目要求的是 ( )A、向少量中滴加足量醋酸溶液: B、向溶液中滴加氨水: C、在空气中变为红褐色: D、向稀硫酸中滴加少量氢氧化钡溶液:8. 是阿伏加德罗常数的值。下列说法错误的是 ( )A、由原子完全变成离子时,失去的电子数为 B、标准状况下,和的混合气体中含有的分子数为 C、的溶液中含有的数为 D、标准状况下,中含有的原子数为9. 物质的类别和核心元素的化合价是研究物质性质的两个重要维度。下图为硫及其部分化合物的“价-类”二维图,其中X、Y、Z、W代表含硫物质。
下列说法正确的是 ( )
A、X对应的物质只有一种 B、Y点对应的物质属于酸性氧化物 C、Z对应物质可使石蕊溶液先变红后褪色 D、W对应的物质是10. 利用废铁屑(主要成分为Fe,还含有C、S、P等)制取高效净水剂 , 流程如图:
下列说法不正确的是 ( )
A、废铁屑在酸溶前可用少量稀硫酸溶液预处理去除油污 B、步骤②中发生反应的离子方程式为 C、步骤③中每生成8.3g 转移0.15mol D、步骤④中发生的反应类型为复分解反应11. 已知还原性。向一定体积的和混合溶液中通入氯气,测得溶液中离子的物质的量随氯气体积的变化曲线如图所示(e和g点横坐标分别为2.5和4.5)。下列说法正确的是 ( )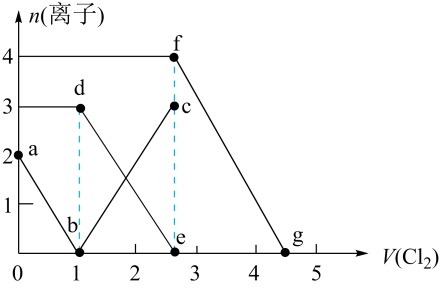 A、ab段表示物质的量的变化情况 B、原溶液中和的物质的量分别为、 C、fg段发生反应: D、反应能发生12. 某无色混合气体甲可能含、、、、中的几种,将甲气体依次经过如图系列实验处理,最终得到酸性溶液,且几乎无气体剩余,则甲中一定含有 ( )
A、ab段表示物质的量的变化情况 B、原溶液中和的物质的量分别为、 C、fg段发生反应: D、反应能发生12. 某无色混合气体甲可能含、、、、中的几种,将甲气体依次经过如图系列实验处理,最终得到酸性溶液,且几乎无气体剩余,则甲中一定含有 ( ) A、、、 B、、、 C、、、、 D、、、
A、、、 B、、、 C、、、、 D、、、二、多选题
-
13. 根据提供的仪器和试剂,能达到实验目的的是 ( )
选项
实验目的
仪器
试剂
A
配制的食盐水
容量瓶、烧杯、胶头滴管、量筒
食盐、蒸馏水
B
探究补铁剂口服液中铁元素的价态
试管、胶头滴管
补铁口服液、溶液、溶液、氯水、溶液、酸性溶液
C
测定家用84消毒液的
表面皿、玻璃棒
家用84消毒液、试纸
D
探究水溶液的还原性
试管、胶头滴管
、溶液、溶液
A、A B、B C、C D、D14. 工业上用亚铬酸亚铁制备晶体的部分工艺流程如下。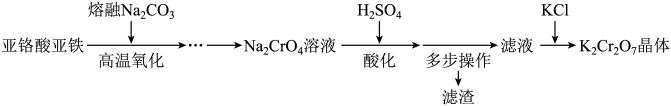
已知:
下列说法不正确的是 ( )
A、“高温氧化”过程中元素被氧化 B、“酸化”过程转变为 C、“滤渣”的主要成分是和 D、的溶解度比小15. 一种以为催化剂去除水体中的机理如图a所示;其他条件相同,不同时,转化率和还原产物百分比()的关系如图b所示。
已知:溶液会影响对的吸附,不影响对H的吸附。
下列说法正确的是 ( )
A、变小时对的吸附能力增强 B、通过调节溶液 , 可以使大多数转化为铵态氮 C、反应ii中生成的离子方程式为 D、处理 , 理论上转移电子三、填空题
-
16. 钴酸锂电池应用广泛。利用废旧电池的正极材料(含 , 其中Li为价)经过多步处理可回收金属钴、锂,其中“酸浸”过程的离子反应涉及、、、、、等微粒,反应过程中测得、的物质的量随时间的变化曲线如图所示。回答下列问题:
 (1)、 在水溶液中的电离方程式为。(2)、“酸浸”过程发生反应的还原剂是(填化学式)。(3)、 氧化性比(填“强”、“弱”或“无法判断”)。(4)、“酸浸”过程中,若产生(标准状况) , 则反应中转移电子。(5)、“酸浸”过程需要稀硫酸,现用98%的浓硫酸(密度为)进行配制。配制过程中需要的玻璃仪器有烧杯、量筒、(填名称);需要用量筒量取98%的浓硫酸mL,若量取浓硫酸后使用蒸馏水洗涤量筒2~3次,并把洗涤液倒入烧杯中,则最终配制溶液浓度(填“偏大”、“偏小”或“无影响”)
(1)、 在水溶液中的电离方程式为。(2)、“酸浸”过程发生反应的还原剂是(填化学式)。(3)、 氧化性比(填“强”、“弱”或“无法判断”)。(4)、“酸浸”过程中,若产生(标准状况) , 则反应中转移电子。(5)、“酸浸”过程需要稀硫酸,现用98%的浓硫酸(密度为)进行配制。配制过程中需要的玻璃仪器有烧杯、量筒、(填名称);需要用量筒量取98%的浓硫酸mL,若量取浓硫酸后使用蒸馏水洗涤量筒2~3次,并把洗涤液倒入烧杯中,则最终配制溶液浓度(填“偏大”、“偏小”或“无影响”)四、实验题
-
17. 氨气与灼热氧化铜反应生成铜、氮气和水。实验小组选用如图所示装置测定氨分子的组成(夹持、固定装置均略去)。

回答下列问题:
(1)、实验开始后,应该先(填实验操作),一段时间后再点燃酒精灯,装置C玻璃管中发生反应的化学方程式为。(2)、装置A中盛装浓氨水的仪器名称为;橡皮管a的作用是。(3)、装置E中长导管的作用是。(4)、实验结束后,G读数折算成标准状况下的气体体积为 , 称得干燥管D增重mg,则氨分子中氮、氢的原子个数比为(用含V、m的代数式表示);有同学认为装置E可以省略不用,试分析若不用装置E,测得结果会(“偏大”、“偏小”或“无影响”)。五、工业流程题
-
18. 七水合硫酸亚铁一种用途广泛的无机盐,可用于制备氧化铁颜料、媒染剂、净水剂等。一种采用工业烧渣(主要成分为、、等)制取 , 并利用其制备纳米氧化铁黄颜料的部分流程如图所示:
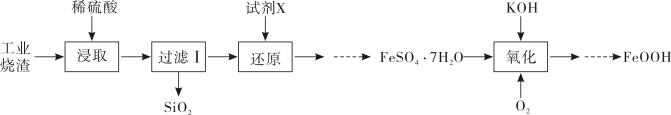
回答下列问题:
(1)、为了提高“浸取”速率,可采取的措施有(填写一种)。(2)、试剂X最好选用(填化学式),“还原”时发生反应的离子方程式为。(3)、“还原”结束至得到产品 , 应进行的操作依次是、、过滤、洗涤、干燥。(4)、“氧化”过程发生反应的化学方程式。(5)、色光度是产品质量的指标之一,合格氧化铁黄的色光度值范围为。氧化过程中溶液对产率、色光度的影响如图所示。
“氧化”时应控制的范围是;若过大会导致产品颜色变黑,可能含有的杂质为(填化学式)。
19. 某工厂以黄铁矿(主要成分为)为原料,采用接触氧化法生产的流程如下:
回答下列问题:
(1)、 中硫元素的化合价为;“炉渣”中铁元素主要以(填化学式)形式存在。(2)、“接触室”中发生反应的化学方程式为。(3)、生产过程中为提高原料的利用率,可以将尾气再次通入(填设备名称)中参与反应。(4)、查阅资料知:“尾气”可用双碱脱硫法处理,其过程如图所示。
①写出过程I的离子反应方程式。
②过程II反应中氧化剂与还原剂的物质的量之比为。
(5)、生产过程中采用一种含杂质为25%的黄铁矿石,若消耗1吨该矿石,理论上可制得98%的浓硫酸吨(假设生产过程中硫的损失为零)。20. 是一种晶体,易溶于水,不溶于酒精。工业上用天然二氧化锰与硫化锰矿(含有Fe、Zn、Ni、Si等元素的氧化物)制取的一种工艺流程如下。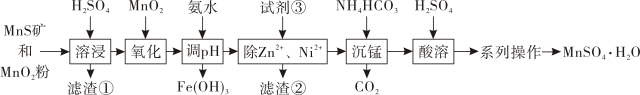
已知:i、硫化锰矿中元素主要以形式存在,不与硫酸反应。
ii、除、外,金属硫化物一般难溶于水。
回答下列问题:
(1)、“滤渣①”的主要成分是S和(填化学式)。(2)、“溶浸”所得溶液中既含有又含有 , 欲检验溶液中的可选用的试剂是;试分析“氧化”过程加入的作用是(用离子方程式回答)。(3)、“试剂③”可选用(填化学式)。(4)、“沉锰”过程锰元素转化为碳酸锰,写出“酸溶”过程发生反应的离子方程式。(5)、最终需经过“过滤、洗涤”等操作得到 , 则洗涤时最好选用(填试剂名称),选用该试剂的理由是。
-
-