山东省莘县多校2022-2023学年高一上学期期末线上联考化学试题
试卷更新日期:2023-06-21 类型:期末考试
一、单选题
-
1. 下列说法中错误的是( )A、“常恐秋节至,焜黄华叶衰”,树叶由绿变黄是发生了化学变化 B、“墨滴无声入水惊,如烟袅袅幻形生”中的“墨滴”具有胶体的性质 C、“朝坛雾卷,曙岭烟沉”,雾有丁达尔效应是因为胶体粒子对光有散射作用 D、石墨与“嫦娥五号”卫星所用的含碳量90%以上的碳纤维互为同素异形体2. 下列说法中正确的是( )
①酸性氧化物在一定条件下均能与碱发生反应
②金属氧化物不一定都是碱性氧化物,但碱性氧化物一定都是金属氧化物
③蔗糖和硫酸钡均属于电解质
④盐酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
⑤因为胶粒比溶液中溶质粒子大,所以胶体可以用过滤的方法把胶粒分离出来
⑥氢氧化铁胶体稳定存在的主要原因是胶粒直径介于1~100nm
A、5个 B、4个 C、3个 D、2个3. 下列关于在实验室中操作的说法错误的是( )A、新制氯水需要避光保存 B、保存溶液需添加少量铁粉 C、做焰色试验时需用硫酸洗净铂丝 D、制备氯气应在通风橱中进行4. 下列生活中的物质及其有效成分的化学式、用途的对应关系中,不正确的是( )选项
A
B
C
D
生活中的物质
小苏打
铁红
复方氢氧化铝片
84消毒液
有效成分化学式
Na2CO3
Fe2O3
Al(OH)3
NaClO
用途
做发酵粉
油漆颜料
做抗酸药
可用于杀灭新型冠状病毒
A、A B、B C、C D、D5. 下图所示实验方案无法达到预期实验目的的是( )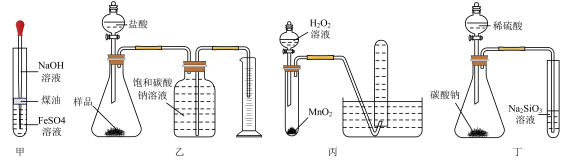 A、用图甲制备 B、用图乙测定纯碱样品中碳酸钠的质量分数(杂质与酸不反应) C、用图丙制备并收集 D、用图丁比较S、C、Si的非金属性强弱6. 下列物质的应用中,对应的离子方程式书写错误的是( )A、将溴水加入KI溶液: B、用盐酸溶解磁性氧化铁: C、氯气与水反应: D、用可溶性强碱溶液除去铝表面的氧化膜:7. 下列除去杂质的方法中,正确的是( )
A、用图甲制备 B、用图乙测定纯碱样品中碳酸钠的质量分数(杂质与酸不反应) C、用图丙制备并收集 D、用图丁比较S、C、Si的非金属性强弱6. 下列物质的应用中,对应的离子方程式书写错误的是( )A、将溴水加入KI溶液: B、用盐酸溶解磁性氧化铁: C、氯气与水反应: D、用可溶性强碱溶液除去铝表面的氧化膜:7. 下列除去杂质的方法中,正确的是( )选项
物质(括号内为杂质)
除去杂质的方法
A
NaCl溶液 (Na2CO3)
加入适量的溶液、过滤
B
MgO固体 (Al2O3)
加入足量NaOH溶液、过滤、洗涤、干燥
C
固体 (Na2CO3)
加热至恒重
D
气体(HCl)
通过饱和溶液洗气、干燥
A、A B、B C、C D、D8. 类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能确定其正确与否。下列几个类推结论中,正确的是( )①钠与水反应生成NaOH和;所有金属与水反应都生成碱和
②铁制品露置在空气中一段时间后就会生锈;铝的性质比铁活泼,铝制品在空气中不能稳定存在
③Al与S直接化合时可得到;Fe与S直接化合时也可得到
④受热易分解,Al(OH)3、Cu(OH)2受热也易分解
A、①②③ B、④ C、③④ D、②③④9. 某工业废水中含有KCN(其中N为价),拟采用如下反应处理:(未配平)。下列有关该反应的说法错误的是( )A、作还原剂,发生氧化反应 B、氧化产物和还原产物的物质的量之比为10:3 C、当有1 mol N2生成时,反应过程中氧化剂共得到10 mol电子 D、每处理1 mol含KCN的工业废水,至少需要消耗标准状况下56 LCl210. 如图是部分短周期元素的原子序数与其某种常见化合价的关系图,原子序数a、b、c、d、e所对应的元素分别为A、B、C、D、E,则下列说法正确的是( ) A、和属于同种核素 B、B和C的最高价氧化物对应的水化物可以反应 C、简单气态氢化物的稳定性: D、A和B只能形成一种化合物11. 为测定某区域空气中 的含量,课外小组的同学将空气样品通入 的酸性 溶液中(假定样品中无其他还原性气体, 可被溶液充分吸收),反应的离子方程式为 。若空气流量为 ,经过 溶液恰好褪色,则该空气样品中 的含量(单位:g/L)为( )A、 B、 C、 D、12. 在的混合溶液中,加入一定量的铁屑,反应完全后将固体滤出,下列说法正确的是( )A、若滤出的固体只有铜,则溶液中一定含有的阳离子是 , 一定不含 B、若滤出的固体只有铜,则溶液中一定含有的阳离子是 , 可能含 C、若滤出的固体只有铜,则溶液中一定含有的阳离子是和 , 一定不含 D、若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是 , 一定不含 , 可能含有13. 三效催化剂能有效实现汽车尾气中三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。下列说法正确的是( )
A、和属于同种核素 B、B和C的最高价氧化物对应的水化物可以反应 C、简单气态氢化物的稳定性: D、A和B只能形成一种化合物11. 为测定某区域空气中 的含量,课外小组的同学将空气样品通入 的酸性 溶液中(假定样品中无其他还原性气体, 可被溶液充分吸收),反应的离子方程式为 。若空气流量为 ,经过 溶液恰好褪色,则该空气样品中 的含量(单位:g/L)为( )A、 B、 C、 D、12. 在的混合溶液中,加入一定量的铁屑,反应完全后将固体滤出,下列说法正确的是( )A、若滤出的固体只有铜,则溶液中一定含有的阳离子是 , 一定不含 B、若滤出的固体只有铜,则溶液中一定含有的阳离子是 , 可能含 C、若滤出的固体只有铜,则溶液中一定含有的阳离子是和 , 一定不含 D、若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是 , 一定不含 , 可能含有13. 三效催化剂能有效实现汽车尾气中三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。下列说法正确的是( ) A、在转化过程中,氮元素均被还原 B、依据图示判断催化剂不参与储存和还原过程 C、还原过程中每生成1分子 , 转移5个电子 D、X的化学式为14. 某兴趣小组同学为研究Cu与的反应进行如下实验(已知CuCl为白色固体,微溶于水):
A、在转化过程中,氮元素均被还原 B、依据图示判断催化剂不参与储存和还原过程 C、还原过程中每生成1分子 , 转移5个电子 D、X的化学式为14. 某兴趣小组同学为研究Cu与的反应进行如下实验(已知CuCl为白色固体,微溶于水):序号
实验步骤
实验现象
Ⅰ

充分振汤,加入2 mL蒸馏水
铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象
Ⅱ

充分振汤,加入2 mL蒸馏水
铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀
Ⅲ

充分振汤,加入2 mL蒸馏水
铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀
下列说法不正确的是( )
A、三个实验中消耗的铜粉的量不完全一样 B、上述实验表明能否形成白色沉淀主要取决于加入Cu的量 C、实验Ⅰ、Ⅱ、Ⅲ中均发生了反应 D、实验Ⅱ中加水后的离子反应可能是15. 某无色澄清溶液中只可能含有①②③④⑤⑥⑦中的几种,且每种离子的个数均相等。依次进行下列实验,每步所加试剂均过量,观察到的现象如下表所示:步骤
操作
现象
(1)
向溶液中滴加2~3滴紫色石蕊溶液
溶液变红
(2)
向溶液中滴加溶液和稀盐酸
有白色沉淀生成
(3)
将(2)中所得沉淀过滤,向滤液中加入溶液和稀硝酸
有白色沉淀生成
下列结论正确的是( )
A、该实验无法确定原溶液中是否含有③ B、原溶液中可能含有的离子是①③ C、原溶液中肯定含有的离子是①②⑥ D、原溶液中肯定不含的离子是②④⑤⑦16. 下列有关物质检验实验结论正确的是( )A、取适量待测溶液于试管中,加足量稀盐酸,无明显现象,再滴加硝酸银溶液,出现白色沉淀,说明该待测溶液中一定含有 B、取一根洁净的铂丝,在酒精灯火焰上灼烧至无色,然后蘸取少量待测液,置于火焰上灼烧,火焰呈黄色,则溶液中一定含有某种钠盐 C、取适量待测液于试管中,滴入足量KSCN溶液,无明显现象,再滴入适量氯水,溶液变为血红色,则原待测液中一定含有 D、向新制的氯水中加入固体,有气泡产生,说明氯水中含HClO二、多选题
-
17. 设为阿伏加德罗常数的值,下列叙述正确的是( )A、1 L 1mol/L NaCl溶液中含有个NaCl分子 B、标准状况下,中含有的中子数为 C、标准状况下,中,含有非极性共价键的数目为 D、和组成的混合气体中含有的原子数为18. 已知某固体样品中含有、中的一种或两种,下列说法不正确的是( )
 A、取适量样品配成溶液,滴加1滴酚酞溶液,若溶液变红,则样品中不一定只含有 B、取样在试管中加热,将可能产生的气体全部通入澄清石灰水,若最终仍为澄清溶液,则样品中不含 C、已知固体样品同时含有和 , 现取一定质量的样品配成溶液,滴加溶液至沉淀完全,根据白色沉淀的质量可求出的含量 D、取一定量的样品,利用如图所示装置测定样品中的含量,若球形干燥管增重4.4 g,则所取样品中含有19. 利用废旧镀锌铁皮制备胶体粒子的流程如图。
A、取适量样品配成溶液,滴加1滴酚酞溶液,若溶液变红,则样品中不一定只含有 B、取样在试管中加热,将可能产生的气体全部通入澄清石灰水,若最终仍为澄清溶液,则样品中不含 C、已知固体样品同时含有和 , 现取一定质量的样品配成溶液,滴加溶液至沉淀完全,根据白色沉淀的质量可求出的含量 D、取一定量的样品,利用如图所示装置测定样品中的含量,若球形干燥管增重4.4 g,则所取样品中含有19. 利用废旧镀锌铁皮制备胶体粒子的流程如图。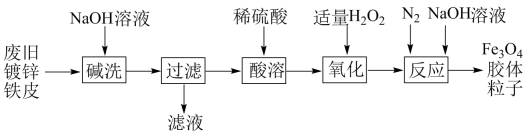
已知:Zn溶于强碱时生成可溶于水的
下列有关说法不正确的是( )
A、是一种复杂的化合物,是具有磁性的黑色晶体 B、滤液中主要存在的离子有、、 C、“酸溶”的离子方程式为: D、“氧化”的目的是将全部氧化为三、填空题
-
20. 下表列出9种元素在元素周期表(元素周期表只给出部分)中的位置
族
周期
ⅠA
0
1
①
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
②
③
④
⑤
3
⑥
⑦
⑧
4
⑨
请回答下列问题:
(1)、考古工作者利用某元素的一种核素测定一些文物的年代,这种核素的元素符号是。(2)、写出由元素②和元素④形成原子个数比为1∶2的化合物的电子式:。(3)、元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式为(4)、③、④、⑤三种元素的简单氢化物稳定性顺序是(填化学式;用“>”连接)。(5)、表中的ⅠA族、ⅡA族元素全部是金属元素,这种判断(填“正确”或“错误”);根据元素周期律,自然界中最强的碱是(填化学式)。四、实验题
-
21. 实验室利用如图所示装置制取并收集氯气。
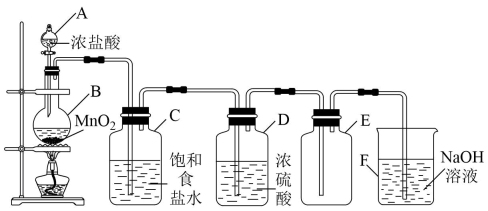 (1)、仪器A的名称为(2)、写出B中反应的化学方程式: , 假设理论上有0.5 mol的HCl被氧化,可产生标准状况下的气体体积为L(不考虑损耗)。(3)、次氯酸钠是家用“84”消毒剂的有效成分,写出制取“84”消毒剂的离子方程式:;假设尾气吸收装置中的NaOH完全与氯气反应得200 mL混合溶液。为了测定有成分的浓度(假设其他成分不参与反应),某兴趣小组进行了如下实验:
(1)、仪器A的名称为(2)、写出B中反应的化学方程式: , 假设理论上有0.5 mol的HCl被氧化,可产生标准状况下的气体体积为L(不考虑损耗)。(3)、次氯酸钠是家用“84”消毒剂的有效成分,写出制取“84”消毒剂的离子方程式:;假设尾气吸收装置中的NaOH完全与氯气反应得200 mL混合溶液。为了测定有成分的浓度(假设其他成分不参与反应),某兴趣小组进行了如下实验:①取20 mL溶液,调pH至溶液呈酸性,加入溶液,充分反应的离子方程式:(未配平)。
②向上述反应后的溶液中滴加溶液20.00 mL,恰好完全反应(此条件下不参与反应)的离子方程式:(未配平)。
则次氯酸钠的物质的量浓度为。
22. Ⅰ.某工厂的酸性废水中主要含有、等离子,为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾 ()。 (1)、Ⅰ.某工厂的酸性废水中主要含有、等离子,为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾 ()。
(1)、Ⅰ.某工厂的酸性废水中主要含有、等离子,为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾 ()。
操作Ⅰ是;试剂甲是(填化学式)。 (2)、获得的需密闭保存,原因是。(3)、绿矾可消除某种酸性工业废水中+6价铬()的污染,使之转化为毒性较小的 , 该反应的离子方程式是。(4)、黄铜是铜锌合金,是用来制造铜钱的原料,能鉴别黄铜中有金属锌的试剂是。(5)、Ⅱ.某小组为探究、、的氧化性强弱,设计实验如下:
(2)、获得的需密闭保存,原因是。(3)、绿矾可消除某种酸性工业废水中+6价铬()的污染,使之转化为毒性较小的 , 该反应的离子方程式是。(4)、黄铜是铜锌合金,是用来制造铜钱的原料,能鉴别黄铜中有金属锌的试剂是。(5)、Ⅱ.某小组为探究、、的氧化性强弱,设计实验如下:【查阅资料】稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。氧化性强弱探究:
【分析与解释】实验Ⅰ

实验Ⅱ
取a中的黄色溶液少许,加入KI溶液,再加入淀粉溶液
实验Ⅲ
另取a中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液
实验Ⅰ中a试管中反应的离子方程式是。
(6)、①甲同学认为:实验Ⅱ观察到现象,得出氧化性。②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性;他补做了实验Ⅲ。补做实验Ⅲ的目的是。
-