江西省上饶市2022-2023学年高一上学期期末教学质量测试化学试题
试卷更新日期:2023-06-21 类型:期末考试
一、单选题
-
1. 下列语句或谚语都与化学现象有关,下列说法不正确的是A、“铁质菜刀生锈”与氧化还原反应有关 B、“雨过天晴云破处”所描述的瓷器青色,来自氧化铁 C、“水乳交融,火上烧油”前者包含物理变化,后者包含化学变化 D、“古人以剂钢为刃,柔铁为茎干,不尔则多断折”(《沈卢、鱼肠》)中“剂钢”指的是铁的合金,其硬度比纯铁的大,熔点比纯铁的低2. 和的关系属于A、同素异形体 B、不同的核素 C、同位素 D、同一物质3. 下列表示物质结构的化学用语正确的是A、的结构示意图:
 B、H、D、T表示同一种核素
C、8个中子的碳原子的核素符号:
D、、具有不同的最外层电子数
4. 为除去下列物质中所含的杂质(括号内为杂质),选用的实验操作方法正确的是A、固体():加热至固体质量不再变化 B、溶液():加入稍过量的铁粉,过滤 C、Al(Fe):加入稍过量的氢氧化钠溶液,过滤 D、(气体):通过足量的饱和的溶液5. 用NA代表阿伏加德罗常数,下列说法不正确的是A、在20℃,压强为时,71 g氯气所含的原子数目为2 NA B、在体积为1 L、物质的量浓度为的溶液中,含有个数为NA C、3.2 g氧气与臭氧混合物所含氧原子数目为0.2 NA D、中阴离子数目为NA6. 下列说法正确的是A、导电性强的溶液里自由移动的离子数目一定比导电性弱的溶液里自由移动的离子数目多 B、和都是电解质,所以它们熔融状态下都能导电 C、中和反应的实质是与结合生成水,故中和反应的离子方程式均为 D、在水中的溶解度很小,所以在离子方程式里不能拆成离子形式7. 能正确表示下列反应的离子方程式是A、溶液中加入稀: B、溶液中加入过量氨水: C、Cu溶于溶液中: D、将稀盐酸滴在氧化铁上:8. 运用元素周期律分析下面的推断,其中错误的是A、已知Cl的非金属性比P强,故的酸性比的强 B、已知I是第五周期第ⅦA族元素,故HI的热稳定性比HF的热稳定性弱 C、已知Rb是第五周期第ⅠA族元素,故Rb与水反应比Na与水反应更剧烈 D、已知Ba是第六周期第ⅡA族元素,故的碱性比的碱性强9. 某无色稀溶液与铝作用放出 , 则下列离子在该溶液中可能大量共存的是A、、、、 B、、、、 C、、、、 D、、、、10. 下列氯化物既可以由氯气与金属反应制得,又可以由金属与盐酸反应制得的是A、FeCl2 B、MgCl2 C、FeCl3 D、CuCl211. 类推时要注意物质的相似性和特殊性,下列类推结论正确的是
B、H、D、T表示同一种核素
C、8个中子的碳原子的核素符号:
D、、具有不同的最外层电子数
4. 为除去下列物质中所含的杂质(括号内为杂质),选用的实验操作方法正确的是A、固体():加热至固体质量不再变化 B、溶液():加入稍过量的铁粉,过滤 C、Al(Fe):加入稍过量的氢氧化钠溶液,过滤 D、(气体):通过足量的饱和的溶液5. 用NA代表阿伏加德罗常数,下列说法不正确的是A、在20℃,压强为时,71 g氯气所含的原子数目为2 NA B、在体积为1 L、物质的量浓度为的溶液中,含有个数为NA C、3.2 g氧气与臭氧混合物所含氧原子数目为0.2 NA D、中阴离子数目为NA6. 下列说法正确的是A、导电性强的溶液里自由移动的离子数目一定比导电性弱的溶液里自由移动的离子数目多 B、和都是电解质,所以它们熔融状态下都能导电 C、中和反应的实质是与结合生成水,故中和反应的离子方程式均为 D、在水中的溶解度很小,所以在离子方程式里不能拆成离子形式7. 能正确表示下列反应的离子方程式是A、溶液中加入稀: B、溶液中加入过量氨水: C、Cu溶于溶液中: D、将稀盐酸滴在氧化铁上:8. 运用元素周期律分析下面的推断,其中错误的是A、已知Cl的非金属性比P强,故的酸性比的强 B、已知I是第五周期第ⅦA族元素,故HI的热稳定性比HF的热稳定性弱 C、已知Rb是第五周期第ⅠA族元素,故Rb与水反应比Na与水反应更剧烈 D、已知Ba是第六周期第ⅡA族元素,故的碱性比的碱性强9. 某无色稀溶液与铝作用放出 , 则下列离子在该溶液中可能大量共存的是A、、、、 B、、、、 C、、、、 D、、、、10. 下列氯化物既可以由氯气与金属反应制得,又可以由金属与盐酸反应制得的是A、FeCl2 B、MgCl2 C、FeCl3 D、CuCl211. 类推时要注意物质的相似性和特殊性,下列类推结论正确的是选项
化学事实
类推结论
A
是碱性氧化物
也是碱性氧化物
B
溶解度:
溶解度:
C
Na投入溶液会生成蓝色沉淀
Na投入溶液也会生成红褐色沉淀
D
、溶液均显碱性
钠盐溶液均能使酚酞溶液变红
A、A B、B C、C D、D12. 有、、、、五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是A、溶液 B、烧碱溶液 C、氨水 D、溶液13. 下列操作能达到实验目的的是A
B
C
D




证明能与烧碱溶液反应
检验装置的气密性
干燥氯气
制备氢氧化铁胶
A、A B、B C、C D、D14. 已知如下反应:①②③ , 下列有关说法不正确的是A、反应①②③中的氧化产物分别是、、 B、根据以上方程式可以得到还原性: C、可以判断反应能发生 D、在反应③中有生成时,转移的电子为15. 常温下向双氧水的酸性溶液中滴入少量的溶液,发生如下转化关系。下列说法不正确的是 A、在完全分解后,和的总量会减少 B、上述转化关系中涉及到如下反应: C、图中转化关系说明既有氧化性又有还原性 D、生产和贮运的过程中要避免混入或者16. 向和的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量关系如图所示。下列说法正确的是
A、在完全分解后,和的总量会减少 B、上述转化关系中涉及到如下反应: C、图中转化关系说明既有氧化性又有还原性 D、生产和贮运的过程中要避免混入或者16. 向和的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量关系如图所示。下列说法正确的是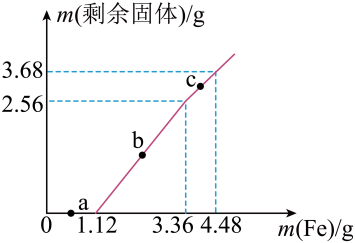 A、c点时溶液中的离子反应是: B、a点时溶液中金属阳离子只有和 C、原溶液中物质的量浓度为 D、原溶液中的物质的量为
A、c点时溶液中的离子反应是: B、a点时溶液中金属阳离子只有和 C、原溶液中物质的量浓度为 D、原溶液中的物质的量为二、元素或物质推断题
-
17. 短周期主族元素A、B、C、D、E、F都可能存在于某些食品添加剂中,且它们的原子序数依次增大,均小于18。A的一种核素原子核内没有中子;B是地壳中含量最多的元素;C在同周期中原子半径最大;D元素原子的最外层电子数与电子层数相等;B、E元素的原子最外层电子数相同。请回答下列问题:(1)、当化合物CF不慎洒落在天然气的火焰上,观察到的现象是。(2)、E元素在元素周期表中的位置为。(3)、E、F离子半径由大到小的顺序为(用元素符号表示)。(4)、B单质与C单质在加热条件下反应的化学方程式。(5)、使用F的单质对自来水消毒时,会与水中的有机物发生反应生成的有机氯化物对人体可能有害,目前已开始使用新的自来水消毒剂。两者作为自来水消毒剂时,均被还原成最低价离子 , 则等物质的量与用作自来水消毒时转移电子数之比。(6)、D元素最高价氧化物对应水化物与C元素最高价氧化物对应水化物的溶液反应的离子方程式为。
三、计算题
-
18. 根据要求回答下列问题。(1)、在标准状况下,① ② ③中,含原子数最多的是(填序号),体积最小的是(填序号)。(2)、现有由和组成的混合气体,该混合气体中的和物质的量之比为 , 该混合气体的平均摩尔质量为(保留一位小数)。(3)、厨房里小苏打常作面包和糕点的发泡剂,写出小苏打受热分解的化学方程式:。(4)、84消毒液(主要成分是)和洁厕灵(主要成分是)同时使用时生成有毒气体,用离子方程式表示该反应。(5)、某溶液中有、、、等离子,向其中加入足量的后,过滤,将滤渣投入足量的盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是_______。A、 B、 C、和 D、
四、工业流程题
-
19. 为实现工业含铝、铁、铜合金(假定其余杂质与酸碱都不反应)废料的再利用,某化学兴趣小组设计了如下回收利用方案:

回答下列问题:
(1)、请写出生成滤液A的离子方程式为。(2)、若要从滤液D得到绿矾晶体,步骤③实验操作有、、过滤、洗涤、干燥。(3)、滤液D易被空气氧化,设计实验检验滤液D是否变质。(4)、为配制的溶液,配制该溶液用到的玻璃仪器除量筒、烧杯、玻璃棒外,还需要(填玻璃仪器名称),需称量胆矾晶体的质量为g。下列操作会导致所配溶液浓度偏高的是(填字母)。A.转移溶液前容量瓶中存在少量蒸馏水 B.所称取的晶体失去了部分结晶水
C.定容前未洗涤烧杯和玻璃棒 D.定容时仰视容量瓶刻度线
五、实验题
-
20. 如图是实验室制备氯气并进行一系列相关实验的装置(加热夹持仪器已略)。
 (1)、实验仪器a的名称。制备氯气选用的药品为固体二氧化锰和浓盐酸,则该反应的化学方程式为。(2)、装置B有两个作用,第一除去氯气中的氯化氢气体杂质,第二作安全瓶,监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时装置B中的现象:。(3)、装置C实验目的是验证氯气是否有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入(请填序号)。
(1)、实验仪器a的名称。制备氯气选用的药品为固体二氧化锰和浓盐酸,则该反应的化学方程式为。(2)、装置B有两个作用,第一除去氯气中的氯化氢气体杂质,第二作安全瓶,监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时装置B中的现象:。(3)、装置C实验目的是验证氯气是否有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入(请填序号)。序号
a
b
c
d
Ⅰ
湿润的有色布条
湿润的有色布条
干燥的有色布条
干燥的有色布条
Ⅱ
浓硫酸
无水氯化钙
碱石灰
无水硫酸铜
Ⅲ
干燥的有色布条
干燥的有色布条
湿润的有色布条
湿润的有色布条
(4)、设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向装置D中缓缓通入少量氯气时,观察到D中的现象是。然后打开活塞,将装置D中少量溶液加入装置E中,振荡,发生反应的离子方程式为。(5)、装置F中用足量的溶液吸收多余氯气,试写出相应的离子方程式:。
-
-
-