湖南省常德市澧县2022-2023学年高一上学期多校线上期末联考化学试题
试卷更新日期:2023-06-21 类型:期末考试
一、单选题
-
1. 中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是( )A、用胆矾炼铜 B、用铁矿石炼铁 C、烧结粘土制陶瓷 D、打磨磁石制指南针2. 化学概念逻辑上存在如图所示关系,对下列概念间的关系说法正确的是
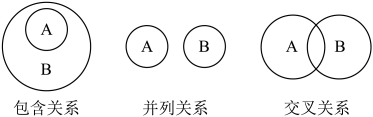
①纯净物与混合物属于包含关系
②化合物与氧化物属于包含关系
③单质与化合物属于交叉关系
④金属元素与非金属元素属于并列关系
⑤中和反应与复分解反应属于并列关系
A、①② B、③④ C、①⑤ D、②④3. 常温下,下列各组离子在指定溶液中一定能大量共存的是A、含大量 的无色溶液中: 、 、 、 B、含有大量 的溶液中: 、 、 、 C、含大量 的溶液: 、 、 、 D、使石蕊变红色的溶液: 、 、 、4. 下列属于非氧化还原反应的是A、2Mg+CO22MgO+C B、 C、 D、5. 下列有关焰色试验的说法正确的是( )A、金属及其化合物在灼烧时产生的不同特征颜色是发生化学变化引起的 B、焰色试验可适合所有金属元素的检验 C、某溶液做焰色试验火焰呈黄色说明该溶液一定含有钠元素、一定不含钾元素 D、焰色试验必需的仪器及试剂:铂丝或光洁无锈的铁丝、酒精灯或煤气灯、盐酸6. 向盛适量冷水的烧杯中滴入1~2滴酚酞溶液,取一块绿豆粒大小的金属钠放入烧杯中。下列实验现象、分析及结论都正确的是( )选项
实验现象
分析及结论
A
钠先沉入水底后浮出水面
钠的密度比水小
B
钠熔成光亮的小球
反应放热,钠的沸点低
C
小球在水面上四处游动,发出“嘶嘶”的响声
产生的气体不均匀,推动小球四处游动,反应剧烈
D
溶液变红
产生了碱性物质:Na+2H2O=NaOH+H2↑
A、A B、B C、C D、D7. 下列说法不正确的是( )A、Na2O2可以作为呼吸面具或潜水艇里的氧气来源 B、将Na2O加到酚酞溶液中,溶液先变红色后褪色 C、可用水来检验某Na2O样品中是否含有Na2O2 D、过氧化钠为淡黄色固体粉末8. 已知:微溶于水,可溶于硝酸。溶液X中可能含有中的几种离子。为了确定其组成,某同学进行了如下实验:
下列说法正确的是
A、溶液X中一定含有和 B、溶液X中一定不含、 C、为确定溶液X中是否含有 , 可取溶液2,加入溶液 D、在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变为红色9. 设 为阿伏加德罗常数的值。下列说法中正确的是A、 中含有阴离子数目为 B、向 溶液中通入氯气,当有 被氧化时,转移电子的数目为 C、 乙烯与丙烯的混合物中含碳原子的数目为 D、用磁铁矿炼铁的反应中, 被 还原成 , 转移电子数目为10. vLFe2(SO4)3溶液中含有agSO , 取此溶液0.5vL,用水稀释至2vL,则稀释后溶液中Fe3+的物质的量浓度为A、mol•L-1 B、mol•L-1 C、mol•L-1 D、mol•L-111. 如图是某同学用500mL容量瓶配制0.10mol·L-1NaOH溶液的过程:
该同学的错误步骤有
A、1处 B、2处 C、3处 D、4处12. 下列关于实验问题处理方法或操作正确的是A、加热饱和溶液可制取胶体 B、分液时,分液漏斗中上层液体从下口流出 C、用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 D、用浓硫酸配制一定物质的量浓度的稀硫酸时,应冷却至室温再转移到容量瓶中13. 检验硫酸亚铁溶液中是否含有少量硫酸铁,可选用最佳试剂是A、氯水 B、KMnO4溶液 C、KSCN溶液 D、Fe 粉14. 下列有关金属铝及其化合物的叙述正确的是A、铝是地壳里含量最多的元素 B、在常温下,铝不能与氧气反应 C、在常温下,可以用铝制容器盛装冷的浓硫酸 D、氧化铝只能与酸反应,不能与强碱反应15. 有些金属的表面在空气中能自然形成致密的氧化膜,从而保护内层金属不易被继续氧化,符合这种特点的金属是A、 B、 C、 D、16. 四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( ) A、原子半径Z<M B、Y的最高价氧化物对应水化物的酸性比X的弱 C、X的最简单气态氢化物的热稳定性比Z的小 D、W是和X同一族的短周期元素,最简单氢化物沸点W<X17. 据最新报道,放射性同位素钬可有效地治疗肝癌。该同位素原子内的中子数与核外电子数之差为A、 B、 C、 D、18. 下列说法不正确的是( )A、构成单质的分子内不一定存在共价键 B、HF的热稳定性很好,是因为HF分子间存在氢键 C、由非金属元素组成的化合物不一定是共价化合物 D、NaCl晶体熔化,需要破坏离子键19. 下列化学用语对事实的表述不正确的是A、硬脂酸与乙醇的酯化反应:Cl7H35COOH+C2H518OHCl7H35CO18OC2H5+H2O B、常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2ONH4++OH− C、由Na和Cl形成离子键的过程:
A、原子半径Z<M B、Y的最高价氧化物对应水化物的酸性比X的弱 C、X的最简单气态氢化物的热稳定性比Z的小 D、W是和X同一族的短周期元素,最简单氢化物沸点W<X17. 据最新报道,放射性同位素钬可有效地治疗肝癌。该同位素原子内的中子数与核外电子数之差为A、 B、 C、 D、18. 下列说法不正确的是( )A、构成单质的分子内不一定存在共价键 B、HF的热稳定性很好,是因为HF分子间存在氢键 C、由非金属元素组成的化合物不一定是共价化合物 D、NaCl晶体熔化,需要破坏离子键19. 下列化学用语对事实的表述不正确的是A、硬脂酸与乙醇的酯化反应:Cl7H35COOH+C2H518OHCl7H35CO18OC2H5+H2O B、常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2ONH4++OH− C、由Na和Cl形成离子键的过程: D、电解精炼铜的阴极反应:Cu2+ +2e−=Cu
20. 已知 、 、 、 为短周期元素, 、 同族, 、 、 同周期, 的气态氢化物的稳定性的大于 的气态氢化物的稳定性, 、 为金属元素, 的阳离子的氧化性小于 的阳离子的氧化性。下列说法正确的是A、、、、的原子半径依次减小 B、与形成的化合物中只含离子键 C、的气态氢化物的沸点一定高于的气态氢化物的沸点 D、若 与 的原子序数相差 , 则二者形成化合物的化学式一定为
D、电解精炼铜的阴极反应:Cu2+ +2e−=Cu
20. 已知 、 、 、 为短周期元素, 、 同族, 、 、 同周期, 的气态氢化物的稳定性的大于 的气态氢化物的稳定性, 、 为金属元素, 的阳离子的氧化性小于 的阳离子的氧化性。下列说法正确的是A、、、、的原子半径依次减小 B、与形成的化合物中只含离子键 C、的气态氢化物的沸点一定高于的气态氢化物的沸点 D、若 与 的原子序数相差 , 则二者形成化合物的化学式一定为二、元素或物质推断题
-
21. 下表为元素周期表的一部分,表中列出了种元素在周期表中的位置,按要求完成下列各小题。
主族
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
周期
2
⑥
⑦
⑨
3
①
③
⑤
⑧
⑩
4
②
④
⑪
(1)、化学性质最不活泼的元素是(填元素符号,下同),非金属性最强的元素。金属性最强的单质与水反应的离子方程式是。(2)、①、③、⑤三种元素的最高价氧化物水化物中,碱性最强的化合物的化学式是。(3)、①、③、⑤三种元素的原子半径由大到小的顺序是(元素符号表示)。(4)、⑥、⑦两种元素形成的最简单氢化物的稳定性由大到小的顺序(写化学式);写出⑦元素形成的简单氢化物的电子式。(5)、⑧、⑪两种元素形成的最简单氢化物的沸点由大到小的顺序(写化学式)。三、填空题
-
22. 二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知:①Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O; ②2SO2+SeO2+2H2O=Se+2SO42-+4H+。
(1)、Se与浓H2SO4的反应中,氧化剂是 , 还原剂是 , 反应中被还原的元素是。当有标准状况下22.4 L SO2气体生成时,转移电子的物质的量是 mol。(2)、依据反应①、②判断SeO2、浓H2SO4、SO2的氧化性由强到弱的顺序是。(3)、用双线桥法标出反应②电子转移的方向和数目:。(4)、SeO2、KI和HNO3发生如下反应:SeO2+KI+HNO3→Se+I2+KNO3+H2O配平上述反应的化学方程式。。
四、实验题
-
23. 过氧化钠是重要的工业漂白剂。某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时需要与水接触。
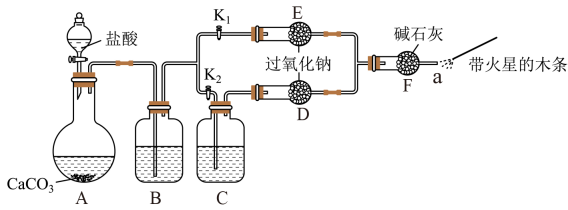 (1)、【装置分析】
(1)、【装置分析】i.装置中反应的离子方程式是。
ii.装置中的试剂是(填序号)。
a.饱和溶液
b.饱和溶液
c.浓
iii.装置中的试剂是。
(2)、【进行实验】步骤:打开 , 关闭 , 打开分液漏斗活塞加入盐酸,将带火星的木条放在处。
步骤:打开 , 关闭 , 打开分液漏斗活塞加入盐酸,将带火星的木条放在处。
步骤和步骤中,处带火星的木条产生的实验现象分别是。
(3)、【实验反思】i.有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应。”其理由是。
ii.需要补充的实验操作是取装置中反应后的少量固体,。
-
-