湖北省云学新高考联盟2022-2023学年高一上学期期末联考化学试题
试卷更新日期:2023-06-21 类型:期末考试
一、单选题
-
1. 关于下列诗句或谚语,说法合理的是A、“滴水石穿、绳锯木断”前者包含化学变化,而后者包含物理变化 B、“雨过天晴云破处,这般颜色做将来。”所描述的瓷器青色,来自氧化铁 C、“日照澄州江雾开”诗句中描述的丁达尔现象是因为胶体粒子本身发光 D、“纷纷灿烂如星陨,霍霍喧逐似火攻。”诗中涉及的焰色试验属于化学变化2. “碳中和”有利于全球气候改善。下列有关CO2的说法错误的是A、CO2晶体可用于人工增雨 B、CO2属于酸性氧化物 C、CO2分子中含有非极性键 D、CO2是侯氏制碱法的原料之一3. 正确掌握化学用语是学好化学的基础,下列有关化学用语表述正确的是A、S2-核外电子排布结构示意图:
 B、质子数为18、中子数为22的氩原子:Ar
C、“氢燃烧”反应H+H→He+γ涉及的三种核素互为同位素
D、Mg和Cl形成离子键的过程:
B、质子数为18、中子数为22的氩原子:Ar
C、“氢燃烧”反应H+H→He+γ涉及的三种核素互为同位素
D、Mg和Cl形成离子键的过程: 4. 下列有关实验说法,不正确的是A、碱液不慎溅到手上,先用大量水冲洗,再用饱和硼酸溶液洗,最后用水冲洗 B、中学实验室中可以将未用完的钠放回原试剂瓶 C、向Na2CO3粉末中滴加几滴蒸馏水,Na2CO3结块变成晶体,并伴随着吸热现象 D、用容量瓶配制溶液,定容时若加水超过刻度线,应重新配制5. 丰富多彩的颜色变化增添了化学的魅力。下列颜色变化过程中气体被氧化的是A、水蒸气使淡黄色过氧化钠变白色 B、H2通过灼热的氧化铜固体由黑色变为红色 C、白色的CuSO4粉末遇水蒸气变蓝 D、Cl2使湿润的淀粉碘化钾试纸变蓝6. 小强的化学笔记中有如下内容:
4. 下列有关实验说法,不正确的是A、碱液不慎溅到手上,先用大量水冲洗,再用饱和硼酸溶液洗,最后用水冲洗 B、中学实验室中可以将未用完的钠放回原试剂瓶 C、向Na2CO3粉末中滴加几滴蒸馏水,Na2CO3结块变成晶体,并伴随着吸热现象 D、用容量瓶配制溶液,定容时若加水超过刻度线,应重新配制5. 丰富多彩的颜色变化增添了化学的魅力。下列颜色变化过程中气体被氧化的是A、水蒸气使淡黄色过氧化钠变白色 B、H2通过灼热的氧化铜固体由黑色变为红色 C、白色的CuSO4粉末遇水蒸气变蓝 D、Cl2使湿润的淀粉碘化钾试纸变蓝6. 小强的化学笔记中有如下内容:①单质分为金属和非金属两类;
②无机化合物主要包括:酸、碱、盐和氧化物;
③合金的熔点一定低于各成分金属
④按照分散质粒子直径大小可将分散系分为溶液、浊液和胶体;
⑤在水溶液中或熔融状态下能导电的化合物都是电解质;
⑥按照树状分类法可将化学反应分为:氧化还原反应和离子反应;
⑦氧化还原反应的本质是化合价升降。
你认为他的笔记中正确的有几项
A、2 B、3 C、4 D、57. 已知NA为阿伏加德罗常数的值,下列说法正确的是A、18g重水含有的电子数为9NA B、足量铁粉与1mol氯气充分反应,转移电子数3NA C、0.1mol/LAlCl3溶液中含有的Cl3数目为0.3NA D、同温同压下,体积相同的CH4与NH3的分子数均为NA8. 常温下,下列各组离子在指定溶液中一定能大量共存的是A、1.0mol/L的KSCN溶液:Na+、Fe3+、Cl-、SO B、使石蕊呈红色的溶液:Fe2+、K+、Cl-、ClO- C、能与HCO反应的溶液:Na+、Al3+、Cl-、CO D、澄清透明溶液:Na+、Cu2+、Cl-、SO9. 下列离子方程式书写正确的是选项
实验操作和现象
离子方程式
A
钠与水反应
2Na+2H2O=2Na++2OH-+H2↑
B
刻蚀印刷电路板
Cu+Fe3+=Cu2++Fe2+
C
H2O2溶液滴入酸性KMnO4溶液中,紫色褪去
2MnO+7H2O2+6H+=2Mn2++6O2↑+10H2O
D
Ca(HCO3)2溶液中加入过量澄清石灰水
Ca2++2HCO+2OH-=CaCO3↓+2H2O+CO
A、A B、B C、C D、D10. 模型认知是简洁揭示化学本质的一种方法,如图为氯化钠固体溶于水的微观模型,下列说法正确的是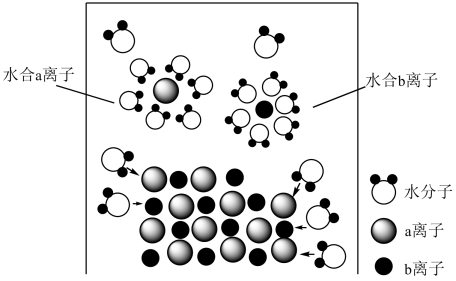 A、NaCl固体中存在自由移动的Na+、Cl- B、该过程可以表示为NaClNa++Cl- C、水合氯离子中H2O的H最靠近Cl- D、NaCl溶液是电解质11. 下列“实验结论”与“实验操作及事实”相符的一组是
A、NaCl固体中存在自由移动的Na+、Cl- B、该过程可以表示为NaClNa++Cl- C、水合氯离子中H2O的H最靠近Cl- D、NaCl溶液是电解质11. 下列“实验结论”与“实验操作及事实”相符的一组是选项
实验操作及事实
实验结论
A
向某溶液中加入硝酸银溶液,产生白色沉淀
该溶液中一定含有Cl-
B
向某溶液中加入稀盐酸酸化的BaCl2溶液,有白色沉淀生成
该溶液中一定含有SO
C
向某溶液中加入稀盐酸,有无色无味气体生成,该气体能使澄清石灰水变浑浊
该溶液中可能含有CO或HCO
D
向某溶液中加入酸性KMnO4溶液,溶液紫色褪去
该溶液中一定含有Fe2+
A、A B、B C、C D、D12. 部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是 A、通过化合反应和复分解反应均能直接得到e B、固体g溶于氢碘酸的离子方程式为 C、a能与水蒸气发生置换反应 D、可存在的转化关系13. 将pH传感器、氯离子传感器、氧气传感器分别插入盛有氯水的广口瓶中,用强光照氯水,测得的实验数据如图所示。下列说法正确的是
A、通过化合反应和复分解反应均能直接得到e B、固体g溶于氢碘酸的离子方程式为 C、a能与水蒸气发生置换反应 D、可存在的转化关系13. 将pH传感器、氯离子传感器、氧气传感器分别插入盛有氯水的广口瓶中,用强光照氯水,测得的实验数据如图所示。下列说法正确的是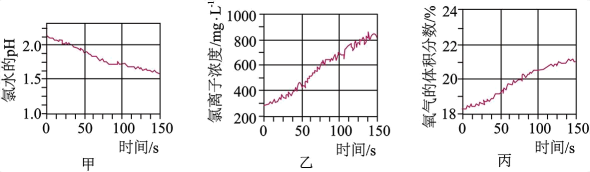 A、由图甲可推知新制氯水需避光保存,光照会使氯水的酸性增强 B、由图乙可推知新制的氯水中无氯离子,而久置的氯水中则含氯离子 C、由图丙可推知光照可催化水分解 D、由图甲、乙、丙可知新制的氯水所含成分少,而久置的氯水所含成分多14. 化学实验操作是进行科学实验的基础。下列操作符合规范能达到实验目的的是
A、由图甲可推知新制氯水需避光保存,光照会使氯水的酸性增强 B、由图乙可推知新制的氯水中无氯离子,而久置的氯水中则含氯离子 C、由图丙可推知光照可催化水分解 D、由图甲、乙、丙可知新制的氯水所含成分少,而久置的氯水所含成分多14. 化学实验操作是进行科学实验的基础。下列操作符合规范能达到实验目的的是



A.比较Na2CO3、NaHCO3的稳定性
B.排空气法收集CO2
C.钠的燃烧
D.溶液滴加
A、A B、B C、C D、D15. 向1LNaOH溶液中通入一定量的气体,充分反应后,再向所得溶液中逐滴加入的盐酸,产生的体积与所加盐酸体积之间关系如图所示。下列判断正确的是 A、通入的在标准状况下的体积为448mL B、原NaOH溶液的浓度为 C、所得溶液的溶质成分的物质的量之比为 D、所得溶液的溶质成分的物质的量之比为
A、通入的在标准状况下的体积为448mL B、原NaOH溶液的浓度为 C、所得溶液的溶质成分的物质的量之比为 D、所得溶液的溶质成分的物质的量之比为二、元素或物质推断题
-
16. 153年前门捷列夫制得世界上第一张元素周期表,它反映了元素之间的内在联系,是对元素的一种很好的自然分类。如图为现代元素周期表的一部分,请回答下列问题:(以下问题均用相应的化学用语表达)
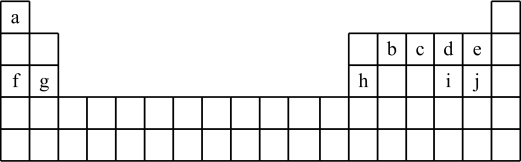 (1)、在这10种元素中,非金属性最强的元素在周期表中的位置是。(2)、由a、d、f三种元素形成的化合物含有的化学键有(填写化学键类型),属于化合物。(3)、元素b、c形成的简单气态氢化物中较稳定的是;d、h、i、j的简单离子半径由大到小的顺序排列为。(4)、用电子式表示c2的形成过程。(5)、在含有a、g、h简单阳离子的100mL溶液中,逐滴滴加5mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示。由图中数据分析计算:
(1)、在这10种元素中,非金属性最强的元素在周期表中的位置是。(2)、由a、d、f三种元素形成的化合物含有的化学键有(填写化学键类型),属于化合物。(3)、元素b、c形成的简单气态氢化物中较稳定的是;d、h、i、j的简单离子半径由大到小的顺序排列为。(4)、用电子式表示c2的形成过程。(5)、在含有a、g、h简单阳离子的100mL溶液中,逐滴滴加5mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示。由图中数据分析计算:
①沉淀减少时发生的离子方程式:。
②a点的数值为:mL。
17. 已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体M。 (1)、写出下列物质的化学式:A: , D:。(2)、按要求写出下列反应方程式:
(1)、写出下列物质的化学式:A: , D:。(2)、按要求写出下列反应方程式:H在潮湿空气中变成M的过程中的化学方程式:。
Q+B→N的离子方程式:。
(3)、足量的R分别与等物质的量的HCl和B反应:①生成H2的物质的量之比为。
②消耗R的物质的量之比为。
(4)、反应B+E→H中如果想白色沉淀保持时间长,可采用如图装置:
实验开始时,先检查装置的气密性,再装好药品,打开止水夹,反应一段时间后关闭止水夹,I中的溶液沿导管流入II中,生成的白色沉淀可以保持较长时间,原因是:。
(5)、向W溶液中加入一定量T后,为检验所得溶液中金属阳离子,甲同学做了如下实验:甲同学取出少量反应后溶液,加入少量酸性KMnO4溶液,发现酸性KMnO4溶液褪色,由此得出结论有Fe2+。乙同学看了实验过程后认为甲同学的结论有问题,你觉得乙同学判断甲同学结论的依据是:。三、原理综合题
-
18. 近年来,我国储氢碳管研究获得重大进展,电弧法合成碳纳米管,常伴有大量物质-碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:3C+2K2Cr2O7+8H2SO4(稀)=3CO2↑+3K2SO4+2Cr2(SO4)3+8H2O。请回答下列问题。(1)、下列物质中:①碳纳米颗粒②K2Cr2O7晶体③CO2④熔融K2SO4⑤Cr2(SO4)3溶液⑥H2O⑦稀硫酸。属于电解质是(填序号)。(2)、CO2的摩尔质量为。(3)、用单线桥法标出上述反应电子转移的方向和数目。(4)、标准状况下,由CO和CO2组成的混合气体为6.72L,质量为12g,则该混合气体的平均相对分子质量是。(5)、实验探究小组在实验中需要用到456mL1mol•L-1的H2SO4溶液,但是在实验室中只发现一瓶8mol•L-1的H2SO4溶液,该小组用8mol•L-1的H2SO4溶液配制所需溶液。
①如图所示的仪器中配制溶液肯定不需要的是(填序号),配制上述溶液还需用到的玻璃仪器是(填仪器名称)。

②该实验中需要量取8mol•L-1的H2SO4溶液mL。
四、实验题
-
19. 某兴趣小组的同学拟采用以下装置制备氯气并进行一系列相关探究实验的装置。请回答下列问题:
 (1)、装置A中a仪器的名称: , 用装置A制氯气所发生反应的离子方程式为 , 反应中氧化剂与还原剂的物质的量之比为。(2)、装置C的实验目的是验证氯气是否具有漂白性,为此装置C中I、II、III处依次放入(填字母)。
(1)、装置A中a仪器的名称: , 用装置A制氯气所发生反应的离子方程式为 , 反应中氧化剂与还原剂的物质的量之比为。(2)、装置C的实验目的是验证氯气是否具有漂白性,为此装置C中I、II、III处依次放入(填字母)。a
b
c
d
I
干燥的有色布条
干燥的有色布条
湿润的有色布条
湿润的有色布条
II
碱石灰
硅胶
浓硫酸
无水氯化钙
III
湿润的有色布条
湿润的有色布条
干燥的有色布条
干燥的有色布条
(3)、设计装置D、E的目的是比较氯、溴、碘的非金属性。实验过程:I.打开弹簧夹,打开a的活塞,滴加浓盐酸。
II.当D和F中的溶液都变为黄色时,夹紧弹簧夹。
III.当D中溶液由黄色变为红棕色时,关闭a的活塞。
IV.打开活塞b,将少量F中溶液滴入E中,关闭活塞b,取下E振荡,静置后CCl4层变为紫红色
①过程IV的现象能证明溴的氧化性强于碘,反应的离子方程式是。
②过程III实验的目的是。
③氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下 , 得电子能力逐渐减弱。
-