湖北省十堰市2022-2023学年高一上学期期末调研考试题化学试卷
试卷更新日期:2023-06-21 类型:期末考试
一、单选题
-
1. 化学与生产、生活密切相关,下列说法正确的是A、碳酸氢钠受热易分解,故其可用于治疗胃酸过多 B、聚合硫酸铁是新型絮凝剂,其中显+3价 C、《千里江山图》中含有很多着色的矿石颜料,其中孔雀石的主要成分是碱式碳酸铜 D、返回舱表面的烧蚀层可以保护返回舱不因高温而烧毁,因为烧蚀层的硬度大2. 下列说法错误的是A、可用铁质或铝质容器贮存冷的浓盐酸或稀盐酸 B、臭氧和氧气互为同素异形体 C、氯气和钠反应生成 , 氯气和钾反应生成 D、碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物3. 铁粉与水蒸气反应的实验装置图(夹持装置已略去)如图,下列说法错误的是
 A、实验进行前,应检查装置的气密性 B、该实验表明:常温下,铁的化学性质不活泼 C、生成的气体在点燃之前,必须验纯 D、该反应的基本反应类型为置换反应4. 某化学兴趣小组同学采用如图所示装置来制备氯气并检验其性质,仪器a中反应的化学方程式为(未配平),下列说法正确的是(忽略空气对反应的影响)
A、实验进行前,应检查装置的气密性 B、该实验表明:常温下,铁的化学性质不活泼 C、生成的气体在点燃之前,必须验纯 D、该反应的基本反应类型为置换反应4. 某化学兴趣小组同学采用如图所示装置来制备氯气并检验其性质,仪器a中反应的化学方程式为(未配平),下列说法正确的是(忽略空气对反应的影响) A、该反应中,浓盐酸只体现了还原性 B、生成的氯气中的氯全部来自 C、随着反应进行,烧杯中溶液颜色由绿色变为黄色再变为蓝色 D、由该实验可判断出氧化性:5. 下列各组物质中,物质之间能通过一步反应实现如图所示转化的是
A、该反应中,浓盐酸只体现了还原性 B、生成的氯气中的氯全部来自 C、随着反应进行,烧杯中溶液颜色由绿色变为黄色再变为蓝色 D、由该实验可判断出氧化性:5. 下列各组物质中,物质之间能通过一步反应实现如图所示转化的是A
B
C
D

X
Y
Z
A、A B、B C、C D、D6. 常温下,往一定量的溶液不断通入的过程中(如图所示),下列图像能正确表示该溶液导电能力(用电流强度I表示)变化的是 A、
A、 B、
B、 C、
C、 D、
D、 7. 铁在浓度极稀的硝酸中发生的反应为(未配平),下列说法正确的是A、该反应出现的物质中,属于氧化物的有4种 B、溶液可以导电,故溶液属于电解质 C、该反应中,参与反应的氧化剂与还原剂的总物质的量之比为15∶4 D、该反应中,每消耗 , 同时转移电子8. 将水滴入盛有过氧化钠的仪器中(如图所示,夹持装置已略去),下列说法正确的是
7. 铁在浓度极稀的硝酸中发生的反应为(未配平),下列说法正确的是A、该反应出现的物质中,属于氧化物的有4种 B、溶液可以导电,故溶液属于电解质 C、该反应中,参与反应的氧化剂与还原剂的总物质的量之比为15∶4 D、该反应中,每消耗 , 同时转移电子8. 将水滴入盛有过氧化钠的仪器中(如图所示,夹持装置已略去),下列说法正确的是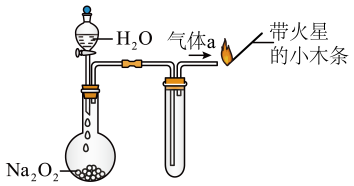 A、是碱性氧化物 B、气体a能使带火星的小木条复燃,则气体a具有可燃性 C、反应一段时间后,过氧化钠白色粉末逐渐消失,且轻轻触摸该仪器外壁能感受到发烫 D、该实险不需要进行尾气处理9. 下列化学方程式书写正确的是A、往碳酸钠溶液中加入少量稀盐酸: B、往硫酸亚铁溶液中加入少量铜粉: C、往氯化铁溶液中加入少量金属钠: D、往氯化钙溶液中通入少量二氧化碳:10. 溶液中,所含的总质量为 , 往该溶液中逐滴滴入的溶液,当沉淀量达到最大时(不考虑水的电离及与水发生的反应),共消耗溶液,下列说法正确的是A、 B、沉淀量达到最大时,反应的离子方程式为 C、原溶液中, D、该反应生成的沉淀均不溶于稀硫酸11. 是一种常用的补血剂,在空气中易变质。某同学通过如下实验测定该补血剂中的含量:先称取样品,用煮沸冷却的蒸馏水配制成溶液;再量取溶液于锥形瓶中,逐滴滴入的溶液,反应完全后,共消耗溶液(不考虑空气对反应的影响)。下列说法错误的是A、该反应的离子方程式为 B、该样品中的含量为21.875% C、配制溶液时需用到的玻璃仪器仅有烧杯、漏斗、量筒、玻璃棒和容量瓶 D、用煮沸冷却的蒸馏水配制溶液的目的是除去溶解在水中的氧气12. 现有X、Y、Z三种元素,它们的单质之间有如下性质:①X的单质可以在Z的单质中燃烧,生成 , 燃烧时火焰为苍白色;②X的单质可与Y的单质化合,生成 , 在常温下为液体;③Z的单质溶于中,所得溶液具有漂白性。下列说法错误的是A、①②③中只有①②发生了氧化还原反应 B、将溶液滴入的水溶液中有气泡产生 C、Z的单质溶于中,具有漂白性的物质并不是Z的单质本身 D、X、Y、Z三种元素的单质中只有X、Y的单质在常温下为无色气体13. 粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等)。某班同学在粗盐提纯实验中,为把少量可溶性杂质、一并除上,进行如图所示的操作(所加试剂均过量,杂质不参与反应),下列说法错误的是
A、是碱性氧化物 B、气体a能使带火星的小木条复燃,则气体a具有可燃性 C、反应一段时间后,过氧化钠白色粉末逐渐消失,且轻轻触摸该仪器外壁能感受到发烫 D、该实险不需要进行尾气处理9. 下列化学方程式书写正确的是A、往碳酸钠溶液中加入少量稀盐酸: B、往硫酸亚铁溶液中加入少量铜粉: C、往氯化铁溶液中加入少量金属钠: D、往氯化钙溶液中通入少量二氧化碳:10. 溶液中,所含的总质量为 , 往该溶液中逐滴滴入的溶液,当沉淀量达到最大时(不考虑水的电离及与水发生的反应),共消耗溶液,下列说法正确的是A、 B、沉淀量达到最大时,反应的离子方程式为 C、原溶液中, D、该反应生成的沉淀均不溶于稀硫酸11. 是一种常用的补血剂,在空气中易变质。某同学通过如下实验测定该补血剂中的含量:先称取样品,用煮沸冷却的蒸馏水配制成溶液;再量取溶液于锥形瓶中,逐滴滴入的溶液,反应完全后,共消耗溶液(不考虑空气对反应的影响)。下列说法错误的是A、该反应的离子方程式为 B、该样品中的含量为21.875% C、配制溶液时需用到的玻璃仪器仅有烧杯、漏斗、量筒、玻璃棒和容量瓶 D、用煮沸冷却的蒸馏水配制溶液的目的是除去溶解在水中的氧气12. 现有X、Y、Z三种元素,它们的单质之间有如下性质:①X的单质可以在Z的单质中燃烧,生成 , 燃烧时火焰为苍白色;②X的单质可与Y的单质化合,生成 , 在常温下为液体;③Z的单质溶于中,所得溶液具有漂白性。下列说法错误的是A、①②③中只有①②发生了氧化还原反应 B、将溶液滴入的水溶液中有气泡产生 C、Z的单质溶于中,具有漂白性的物质并不是Z的单质本身 D、X、Y、Z三种元素的单质中只有X、Y的单质在常温下为无色气体13. 粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等)。某班同学在粗盐提纯实验中,为把少量可溶性杂质、一并除上,进行如图所示的操作(所加试剂均过量,杂质不参与反应),下列说法错误的是 A、操作I和操作II的名称均为过滤 B、沉淀b的主要成分为、 C、试剂X只能为稀盐酸 D、往溶液b中滴加硝酸酸化的硝酸银,有白色沉淀产生14. 下列实验方案中,不能测定出Na2CO3和NaHCO3的混合物中的质量分数的是A、取ag混合物充分加热,质量减少bg B、取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体 C、取ag混合物与足量NaOH溶液充分反应,得到bg溶液 D、取ag混合物与足量稀硫酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加bg15. 将物质的量之比为4∶1∶3的、和的混合物通入和放入一密闭容器中,用电火花点燃并充分反应后,再恢复到常温下。下列说法正确的是A、容器中有剩余 B、容器中有剩余 C、容器中有剩余 D、容器中固体是和
A、操作I和操作II的名称均为过滤 B、沉淀b的主要成分为、 C、试剂X只能为稀盐酸 D、往溶液b中滴加硝酸酸化的硝酸银,有白色沉淀产生14. 下列实验方案中,不能测定出Na2CO3和NaHCO3的混合物中的质量分数的是A、取ag混合物充分加热,质量减少bg B、取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体 C、取ag混合物与足量NaOH溶液充分反应,得到bg溶液 D、取ag混合物与足量稀硫酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加bg15. 将物质的量之比为4∶1∶3的、和的混合物通入和放入一密闭容器中,用电火花点燃并充分反应后,再恢复到常温下。下列说法正确的是A、容器中有剩余 B、容器中有剩余 C、容器中有剩余 D、容器中固体是和二、工业流程题
-
16. 钛是航空、军工、电力等领域的重要原材料。地壳中的含钛矿石之一是金红石 , 其是冶炼钛的重要原料。生产钛的工艺流程如图:

已知:①常温下,钛既不与常见非金属单质反应,也不与强酸反应;
②加热时,钛可以和常见的非金属单质反应。
(1)、在反应I中:①下列有关的说法正确的是(填标号)。
A.属于酸性氧化物 B.摩尔质量为28 C.为可燃性气体 D.具有还原性
②反应I的化学方程式为。
③每转移电子,同时生成的体积为(标准状况下)。
(2)、在反应II中:①氩气的作用为。
②该反应的基本反应类型为。
(3)、为了测定反应II制得的金属钛(杂质仅含)中的钛元素含量。常温下,取反应II制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为的稀硫酸,当不再出现气泡时,共用去稀硫酸:①上述反应的离子方程式为。
②金属钛的质量分数为(用含m、c、V的代数式表示)。
三、填空题
-
17. 合成氨工业生产中所用的催化剂的主要成分是。回答下列问题:(1)、 的摩尔质量为。(2)、室温下,将适量的粉末投入足量的稀盐酸中:
①取少量上述反应后的溶液于试管中,静置一段时间后,可观察到溶液的颜色由绿色变为黄色,溶液由绿色变为黄色的原因为(用离子方程式表示)。
②往①的试管的溶液中加入足量的氢氧化钠溶液,此时观察到溶液中的现象为。
③(填“能”或“不能”)选用酸性高锰酸钾溶液检验①的试管中的存在,原因为(用离子方程式表示)。
(3)、在的混合物中:①若铁原子、氧原子的物质的量之比为7∶8,则与的物质的量之比为。
②当该混合物中+2价铁与+3价铁的物质的量之比为时,该混合物中铁元紫的质量分数为(用含a、b的代数式表示)。
(4)、电子工业上常用30%的溶液腐蚀覆在绝缘板上的铜箔,制造印刷电路板。发生的反应为 , 该反应中,若生成的还原产物与氧化产物质量相差 , 则此时转移的电子的物质的量为。四、实验题
-
18. 实验室制备氯气并进行相关实验的装置(加热及夹持装置均已略去)如图。

回答下列问题:
(1)、仪器a的名称为。(2)、该实验装置中有一处明显的错误,请指出具体的错误装置: , 判断的理由为。(3)、装置VI中,溶液的作用为。(4)、装置I中发生反应的化学方程式为。(5)、实验进行过程中,在装置V中(不考虑物质与水发生的反应):①可能观察到的现象为。
②发生反应的离子方程式为。
③由此可判断,氧化性:(填“>”、“<”或“=”)。
五、计算题
-
19. 将一定物质的量浓度的溶液分成A、B两等份,分别向A、B中通入物质的量不等的 , 充分反应后,再继续向两溶液中分别逐滴加入的盐酸,边滴边振荡,产生的气体体积(假设所产生的气体全部逸出)与所加的盐酸体积之间的关系如图所示,回答下列问题:

已知:①不考虑水电离出的和及和与水发生的反应;
②不考虑溶液混合时引起的体积和温度的变化;
③只考虑反应过程中盐酸的酸性。
(1)、由曲线A可知:①相同状况下,。
②P点溶液中,(用含x的代数式表示)。
(2)、由曲线B可知:①“”段发生反应的离子方程式为。
②向原B等份的溶液中通入后,所得溶液中的溶质为(填化学式),其质量之比为。
(3)、若将M、N两处所产生的气体全部通入足量的某未知浓度的澄清石灰水中,所得沉淀的质量为g(用含x的代数式表示,不考虑气体的逸出,下同),原溶液中溶质的质量为g。
-
-
-