河南省洛阳市2022-2023学年高一上学期期末考试化学试题
试卷更新日期:2023-06-21 类型:期末考试
一、单选题
-
1. 下列物质中,在一定条件下与铁反应,且铁元素的化合价能变为+3价的是( )A、氯化铁溶液 B、硫酸铜溶液 C、氯气 D、稀盐酸2. 下列离子方程式中,正确的是( )A、铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑ B、氯气与氯化亚铁溶液反应:2FeCl2+Cl2=2FeCl3 C、氯化铁溶液与铁反应:Fe3++Fe=2Fe2+ D、氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH- = Fe(OH)3↓3. 下列关于合金的说法中,正确的是( )A、合金的熔点一定比各成分金属的低 B、在我国使用最早的合金是钢 C、生铁的含碳量为0.03%-2% D、稀土金属可用于生产合金4. 下列关于铝的说法中,正确的是A、铝的化学性质不活泼 B、铝不与酸、碱反应 C、常温下铝不与氧气反应 D、铝表面容易生成一层致密的氧化铝保护膜5. 等质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,充分反应后放出的氢气在同温同压下体积之比为( )A、1∶1 B、1∶6 C、2∶3 D、3∶26. 要想证明某溶液中是否含Fe3+ , 下列操作中正确的是A、加入铁粉 B、滴加KSCN溶液 C、通入Cl2 D、加入铜片7. 考古学常用来确定文物的历史年代,原子核内中子数是A、6 B、8 C、14 D、208. 下列关于F、Cl、Br、I的比较,不正确的是( )A、它们的原子核外电子层数随核电荷数的增加而增多 B、单质的氧化性随核电荷数的增加而减弱 C、它们的氢化物的稳定性随核电荷数的增加而增强 D、单质的颜色随核电荷数的增加而加深9. 下列物质中,只含有非极性键的是A、 B、 C、 D、10. 下列关于化学键的说法中不正确的是A、化学键是一种作用力 B、化学键可以使离子相结合,也可以使原子相结合 C、化学反应过程中,反应物的化学键断裂,生成物的化学键形成 D、非极性键不是化学键11. 2016年IUPAC命名117号元素为Ts(中文名“钿”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是A、Ts是第七周期第ⅦA族元素 B、Ts的同位素原子具有相同的电子数 C、Ts在同族元素中非金属性最弱 D、中子数为176的Ts核素符号是Ts12. 元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )A、左下方区域的金属元素 B、右上方区域的非金属元素 C、金属元素和非金属元素分界线附近的元素 D、稀有气体元素13. 雷雨天闪电时空气中有O3生成。下列说法中,正确的是A、O2和O3互为同位素 B、O2和O3的相互转化是物理变化 C、在相同的温度和压强下,等体积的O2和O3含有相同的分子数 D、等物质的量的O2和O3含有相同的质子数14. 下列关于物质性质的比较,不正确的是( )A、酸性强弱: B、原子半径大小: C、碱性强弱: D、金属性强弱:15. 根据表1信息,判断以下叙述正确的是( )
表1 部分短周期元素的原子半径及主要化合价
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A、氢化物的沸点为H2T<H2R B、单质与稀盐酸反应的速率为L<Q C、M与T形成的化合物具有两性 D、L2+与R2-的核外电子数相等16. 常温下,下列溶液可用铝或铁质容器盛装的是A、稀硝酸 B、稀硫酸 C、浓硝酸 D、浓盐酸17. 下列化学用语不正确的是A、Na+的结构示意图: B、H2O的分子结构模型:
B、H2O的分子结构模型: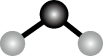 C、NaCl的电离方程式:NaCl=Na++Cl−
D、用电子式表示HCl的形成过程:
C、NaCl的电离方程式:NaCl=Na++Cl−
D、用电子式表示HCl的形成过程: 18. 下列物质的电子式书写正确的是( )A、Cl:Cl B、
18. 下列物质的电子式书写正确的是( )A、Cl:Cl B、 C、
C、 D、
D、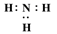 19. 合金的应用促进了人类社会的发展。下列不属于合金的是( )A、碳素钢 B、陶瓷 C、硬铝 D、生铁20. X、Y、Z、W为短周期元素,X2−和Y+核外电子排布相同,X、Z位于同一主族,Y、Z、W位于同一周期,W的最外层电子数是X、Y最外层电子数之和。下列说法不正确的是A、X、Y、Z、W核电荷数逐渐增大 B、对应单质的氧化性:X>Z C、最高价氧化物对应水化物的酸性:W>Z D、离子半径X<Y
19. 合金的应用促进了人类社会的发展。下列不属于合金的是( )A、碳素钢 B、陶瓷 C、硬铝 D、生铁20. X、Y、Z、W为短周期元素,X2−和Y+核外电子排布相同,X、Z位于同一主族,Y、Z、W位于同一周期,W的最外层电子数是X、Y最外层电子数之和。下列说法不正确的是A、X、Y、Z、W核电荷数逐渐增大 B、对应单质的氧化性:X>Z C、最高价氧化物对应水化物的酸性:W>Z D、离子半径X<Y二、填空题
-
21. 水是生命之源,通常水加热至100℃时变为水蒸气,加热至2000℃会缓慢分解为和 , 从粒子间的相互作用角度进行分析,这两种变化有所不同。(1)、水加热至100℃变为水蒸气时,破坏的粒子间的相互作用包含 , 加热至2000℃分解为和时破坏的粒子间的相互作用是。(2)、以上三种作用力由大到小的顺序是。(3)、H、、半径由大到小的顺序是。22. 联合国将2019年定为“国际化学元素周期表年”,新版周期表包含118种元素,下表代表元素周期表前四周期,回答下列问题:(1)、将磷的元素符号填写在上述周期表相应的空格中。(2)、Cl元素的最高价氧化物对应水化物的化学式为。(3)、下列有关性质的比较正确,且能用元素周期律解释的是。
a.酸性:HCl>H2SO3 b.非金属性:O>S
c.碱性:NaOH>Mg(OH)2 d.热稳定性:HF<HCl
(4)、从原子结构角度解释元素的非金属性S弱于Cl的原因。(5)、硒(Se)是人体必需的微量元素,其原子结构示意图为 。
。①Se在元素周期表中的位置是。
②Se的气态氢化物的化学式为。
③和互称为。
三、实验题
-
23. 某班同学用如下实验探究、性质。回答下列问题:(1)、分别取一定量硫酸铁、硫酸亚铁固体,均配制成100mL0.1mol/L的溶液。在配制溶液时需加入少量铁屑,其目的是。(2)、甲组同学取2mL溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明可将氧化。溶液与氯水反应的离子方程式为。(3)、乙组同学认为甲组的实验不够严谨,该组同学在2mL溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是。(4)、丁组同学为了探究与Cu的反应,做了如图所示实验:

①与Cu反应的离子方程式为。
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
ⅰ.CuSCN是难溶于水的白色固体;ⅱ.SCN的化学性质与相似;ⅲ.
填写实验方案:
实验方案
现象
步骤1:取4mL0.2mol/L的溶液,向其中滴加3滴0.1mol/L的KSCN溶液。
无明显现象
步骤2:取4mL_▲_mol/L的溶液,向其中滴加3滴0.1mol/L的KSCN溶液。
产生白色沉淀
步骤2中的溶液的浓度是mol/L,与反应的离子方程式为。
24. 已知某激光打印机墨粉的成分如下:炭黑、四氧化三铁(20~30%)、粘结树脂、电荷调节剂、添加剂等。某学习小组对墨粉展开探究,请回答如下问题:(1)、四氧化三铁中铁元素的化合价是。(2)、某同学用最简便的方法检验了四氧化三铁的存在,他的做法是。(3)、另一位同学用化学方法来检验四氧化三铁的存在,实验方案:①取少量墨粉溶于过量稀硫酸后过滤;②将滤液分为两份,其中一份加入溶液,另一份加入KSCN溶液,这位同学观察到的现象是。(4)、有同学提出疑问,如果实验室没有稀硫酸,(填“可以”或“不可以”)将墨粉溶于过量的稀盐酸,理由是。(5)、有同学提出测定墨粉中四氧化三铁含量的实验方案:取墨粉,溶于过量稀硫酸过滤,加入过量的_______,充分反应后过滤,向滤液中加入足量的溶液。A、Fe B、Zn C、Cu D、(6)、已知(5)中消耗mol/L溶液L,墨粉中四氧化三铁质量分数是。(7)、某同学查阅资料,工业上采用化学共沉淀法制备纳米磁性 , 将亚铁盐和铁盐溶液按照一定比例混合,将碱性沉淀剂快速加入到上述混合盐溶液中,搅拌、反应一段时间后,即可得到纳米磁性粒子,该反应的离子方程式是。