河北省定州市2022-2023学年高一上学期期末考试化学试题
试卷更新日期:2023-06-21 类型:期末考试
一、单选题
-
1. 化学与生活、生产及科技密切相关,下列有关说法错误的是A、为防控新冠病毒,将“84”消毒液与酒精1:1混合,消毒效果更好 B、中国“奋斗者”号载人潜水器的钛合金比纯金属钛具有更高的硬度 C、2022年北京冬奥火种灯采用了很多高科技手段致力于结构创新和节能减碳,火种灯材质采用的铝合金是混合物 D、2021年5月,四川广汉三星堆遗址最新发现的3号祭祀坑的国宝级商代文物“铜顶尊跪坐人像”再惊天下,青铜器的出土表明我国商代已经掌握冶炼铜技术2. 化学科学需要借助化学专用语言描述,下列有关化学用语正确的是A、HCl的电子式为
 B、Cl-的结构示意图
B、Cl-的结构示意图 C、HClO的结构式为H-Cl-O
D、质量数为37的氯原子Cl
3. 设NA为阿伏加德罗常数的值,下列说法正确的是A、5.6 g Fe与足量稀盐酸反应转移的电子数为0.3NA B、标准状况下,11.2 L H2O中所含分子数为0.5NA C、标准状况下,46 gNO2和N2O4的混合气体含有的原子数为3NA D、1 mol·L-1 Na2CO3溶液含有Na+个数为2NA4. 下列关于碱金属或卤族元素的叙述中,正确的是A、碱金属单质都可保存在煤油中 B、随着核电荷数的增加,碱金属单质、卤素单质的熔沸点依次升高,密度依次增大 C、碱金属单质的金属性很强,均易与氧气发生反应,加热时生成氧化物R2O D、砹(At)是第六周期的卤族元素,根据卤素性质的递变规律,还原性:HAt>HI5. 对下列各组物质的分类正确的是
C、HClO的结构式为H-Cl-O
D、质量数为37的氯原子Cl
3. 设NA为阿伏加德罗常数的值,下列说法正确的是A、5.6 g Fe与足量稀盐酸反应转移的电子数为0.3NA B、标准状况下,11.2 L H2O中所含分子数为0.5NA C、标准状况下,46 gNO2和N2O4的混合气体含有的原子数为3NA D、1 mol·L-1 Na2CO3溶液含有Na+个数为2NA4. 下列关于碱金属或卤族元素的叙述中,正确的是A、碱金属单质都可保存在煤油中 B、随着核电荷数的增加,碱金属单质、卤素单质的熔沸点依次升高,密度依次增大 C、碱金属单质的金属性很强,均易与氧气发生反应,加热时生成氧化物R2O D、砹(At)是第六周期的卤族元素,根据卤素性质的递变规律,还原性:HAt>HI5. 对下列各组物质的分类正确的是①混合物:钢铁、水银、冰水混合物
②电解质:胆矾、氯化氢、硫酸钡
③酸性氧化物:CO、Al2O3、SO2
④同位素:2H2、1H、3H
⑤同素异形体:C60、金刚石、石墨
⑥干冰、液氯都是非电解质
A、①②③④⑤⑥ B、④⑤⑥ C、②⑤ D、②④⑤6. 下表是各物质及其所含的少量杂质,以及除去这些杂质所选用的试剂或操作方法,其中正确的是选项
物质
杂质
除杂试剂或操作方法
A
FeCl2溶液
FeCl3
加入过量铜粉,再过滤
B
NaHCO3溶液
Na2CO3
通入过量的CO2气体
C
NaNO3溶液
Na2SO4
加入适量的BaCl2溶液,再过滤
D
MgO固体
Al2O3
加入过量的盐酸溶液,再过滤
A、A B、B C、C D、D7. 在无色透明强酸性溶液中,能大量共存的离子组是A、、、、 B、、、、 C、、Cu2+、、 D、、、、8. 下列离子方程式书写正确的是( )A、Ba(OH)2和H2SO4两溶液混合:Ba2++OH-+H++SO =BaSO4↓+H2O B、氢氧化铜加到盐酸中:OH-+H+=H2O C、锌和硝酸银溶液反应:Zn+Ag+=Ag+Zn2+ D、FeCl3和NaOH溶液反应:Fe3++3OH-=Fe(OH)3↓9. 酸性K2Cr2O7溶液具有较强的氧化性,能将Na2SO3氧化为Na2SO4。现有10 mL0.3 mol/L的Na2SO3溶液,与10 mL0.1 mol/L的K2Cr2O7溶液刚好完全反应,则还原产物中Cr的化合价为A、+6 B、+5 C、+3 D、+210. 下列叙述正确的是①标准状况下,1LHCl和1LH2O的物质的量相同;
②常温常压下,1gH2和14gN2的体积相同;
③28gCO的体积为22.4L;
④两种物质的物质的量相同,则它们在标准状况下的体积也相同;
⑤同温同体积时,气体的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的摩尔质量成正比
⑦2molH2SO4分子的摩尔质量是196g/mol
A、①③④⑥⑦ B、②⑤⑥ C、⑤⑥⑦ D、①⑤⑥11. 下列说法不正确的是A、某短周期元素最外层有2个电子,则其一定是第ⅡA族元素 B、在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 C、元素周期表有7个主族、8个副族和0族,副族均由长周期元素组成 D、117号元素Ts位于周期表的第七周期第ⅦA族12. 可以根据5I- + +6H+=3I2+3H2O检验食盐中是否存在 。下列说法正确的是( )A、I2是氧化产物,H2O是还原产物 B、 得电子,被氧化 C、该条件下氧化性: 强于I- D、每生成3 mol I2转移6 mol电子13. 用硫酸渣(主要成分为、)制备铁基颜料铁黄()的一种工艺流程如图。已知:“还原”时,发生反应;、均与不反应。下列有关说法不正确的是 A、“酸溶”时加速搅拌可加快反应速率 B、“过滤Ⅰ”所得滤液中存在的阳离子主要有和 C、“还原”时还原产物与氧化产物的物质的量之比为 D、“氧化”时离子方程式:
A、“酸溶”时加速搅拌可加快反应速率 B、“过滤Ⅰ”所得滤液中存在的阳离子主要有和 C、“还原”时还原产物与氧化产物的物质的量之比为 D、“氧化”时离子方程式:二、多选题
-
14. 在给定条件下,下列选项所示的物质间转化均能一步实现的是( )A、 B、 C、 D、15. 氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是A、加入有色布条,一会儿有色布条褪色,说明有Cl2存在 B、溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在 C、先加入硝酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在 D、加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
三、填空题
-
16. Ⅰ.现有以下物质:①盐酸②液氨③BaCO3固体④熔融 K2SO4⑤氢氧化铁胶体⑥蔗糖⑦CO2⑧NaOH 溶液。按要求回答问题:(1)、属于非电解质的是(填序号),电解质的是(填序号)(2)、⑤的实验室制备方法:向沸水中滴加几滴饱和 FeCl3溶液,加热至液体呈红褐色,停止加热;其化学方程式为。(3)、Ⅱ.某未知溶液中只可能大量存在下列离子:Na+、Ba2+、、、Cl-、H+ , 为探究其组成,某实验小组进行了以下实验:

写出“沉淀2”的化学式;
(4)、“沉淀1”与稀盐酸反应的离子方程式为;(5)、原溶液中一定大量存在的离子是 , 可能存在的离子是。四、元素或物质推断题
-
17. 如图是部分短周期元素(用字母x等表示)化合价与原子序数的关系图。

根据判断出的元素回答问题:
(1)、h在周期表中的位置是。(2)、比较z、f、g、r常见离子的半径大小(用化学式表示,下同) ;比较r、m的最高价氧化物对应水化物的酸性强弱;比较d、m的氢化物的沸点;(3)、z的一种氢化物分子中既含非极性键又含极性键,其结构式为。(4)、由y、m和氢元素组成一种离子化合物,写出其电子式:。五、实验题
-
18. 某同学进行实验时需要溶液左右,但实验室只有的浓硫酸。该同学利用所给试剂配制所需溶液。(1)、该同学应用量筒量取的浓硫酸体积为(精确到),实验必须用到的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外,至少还需要的一种玻璃仪器是(2)、量取的浓硫酸需在烧杯中先稀释,稀释浓硫酸的操作是。(3)、配制过程中主要有以下操作:
①定容 ②转移 ③量取 ④洗涤 ⑤稀释 ⑥摇匀
正确的操作顺序应是___________。
A、①②③④⑤⑥ B、③⑤②④①⑥ C、④⑤③②①⑥(4)、下列操作会引起所配溶液浓度偏高的有___________A、用量筒量取浓硫酸时,仰视量筒的刻度 B、容量瓶未干燥即用来配制溶液 C、浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容 D、烧杯中稀溶液往容量瓶转移时,有少量液体溅出19. 作为一种广谱型的消毒剂,将逐渐用来取代成为自来水的消毒剂。已知是一种易溶于水而难溶于有机溶剂的气体,实验室制备的原理是用亚氯酸钠固体与氯气反应:。下图是实验室用于制备和收集一定量较纯净的的装置(某些夹持装置和垫持用品省略)。其中E中盛有液体(用于除去中的未反应的)。
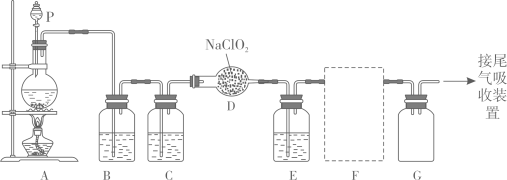 (1)、仪器P的名称是。(2)、写出装置A中烧瓶内发生反应的离子方程式:。(3)、G瓶的作用是。(4)、F为收集装置,应选用的装置是(填序号)
(1)、仪器P的名称是。(2)、写出装置A中烧瓶内发生反应的离子方程式:。(3)、G瓶的作用是。(4)、F为收集装置,应选用的装置是(填序号) (5)、若用的浓盐酸与足量的制备 , 则被氧化的的物质的量是___________(填序号)。A、 B、 C、 D、无法判断
(5)、若用的浓盐酸与足量的制备 , 则被氧化的的物质的量是___________(填序号)。A、 B、 C、 D、无法判断六、工业流程题
-
20. 经检测某工厂的酸性废水中所含离子及其浓度如表所示:
离子
Fe3+
Cu2+
Na+
H+
浓度/(mol/L)
(1)、 。(2)、为了减少污染并变废为宝,工程师们设计了如图流程,回收铜和绿矾。
①工业废水中加入铁粉生成固体C的离子方程为:。
②试剂B的化学式是。
③通过检验溶液D,来判断废水中是否除尽,实验方法是。
④上述废水经处理,可获得的物质的量是。
⑤在含有的溶液中加入现象是;已知反应物恰好完全反应且反应转移电子,生成的气体标况下的体积为L。
-
-