广东省佛山市禅城区2022-2023学年高一上学期期末统测化学试题
试卷更新日期:2023-06-21 类型:期末考试
一、单选题
-
1. 下列佛山传统手工艺品与现代建筑作品中所用材料,属于合金的是




A.石湾陶瓷
B.南海藤编
C.顺峰山公园牌坊外表挂花岗石
D.世纪莲体育中心所用的钢索拉环
A、A B、B C、C D、D2. 2022年9月,我国嫦娥五号探测器首次获得月壤中氦-3(3He)的含量与提取参数,为后续开采氦-3提供了重要的数据支撑。下列说法错误的是A、氦是主族元素 B、3He的中子数为1 C、3He与4He互为同位素 D、3He与4He化学性质相似3. 下列转化不能一步实现的是A、CuSO4→Cu(OH)2 B、K→KOH C、Fe2O3→Fe(OH)3 D、SO3→Na2SO44. “低钠饮料”是指钠含量低于120mg/100mL的饮料,“极低钠饮料”是指钠含量不高于40mg/100mL的饮料。如表是某电解质饮料标签的一部分。有关说法正确的是*微粒浓度(平均值)
离子
mg/100mL
mmol/L
Na+
49
21
K+
21
5.4
Ca2+
2
0.5
Cl-
60
16
…
…
…
A、该饮料属于“极低钠饮料” B、1L溶液中Ca2+的质量为20g C、整个电解质饮料呈电中性 D、从20mL该饮料中取出10mL,c(Cl-)变为8mmol/L5. 我国科学家使用Fe基催化剂,实现了以CH4、H2O2和CO为原料高选择性制备CH3COOH的新突破。下列说法正确的是A、Fe能导电,所以Fe是电解质 B、CH4分子结构模型为 C、CO的摩尔质量是28g
D、CH3COOH属于强酸
6. 下列操作中,符合实验安全规范的是A、手持试管给其中的液体加热 B、稀释浓硫酸时,将水加入浓硫酸中 C、实验结束后,将剩余的钠放到废液缸中 D、闻氯气时,用手轻轻扇动,使少量气体飘进鼻孔7. 下列有关气体除杂、干燥的操作正确的是
C、CO的摩尔质量是28g
D、CH3COOH属于强酸
6. 下列操作中,符合实验安全规范的是A、手持试管给其中的液体加热 B、稀释浓硫酸时,将水加入浓硫酸中 C、实验结束后,将剩余的钠放到废液缸中 D、闻氯气时,用手轻轻扇动,使少量气体飘进鼻孔7. 下列有关气体除杂、干燥的操作正确的是A.除去Cl2中的HCl
B.除去CO2中的HCl
C.干燥O2
D.干燥CO2



 A、A B、B C、C D、D8. 下列关于FeCl3稀溶液、Fe(OH)3胶体、Fe(OH)3悬浊液的说法,正确的是A、三者均属于纯净物 B、三者的本质区别是能否发生丁达尔效应 C、分别对三者进行过滤操作,只有FeCl3溶液中的分散质粒子能穿过滤纸 D、向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续加热至红褐色可制得Fe(OH)3胶体9. 宏观辨识与微观探析是化学学科核心素养之一。下列反应方程式书写正确的是A、Fe在Cl2中燃烧:Fe+Cl2FeCl2 B、Cl2与FeCl2溶液反应:2Fe2++Cl2=2Fe3++2Cl- C、用AlCl3溶液和氨水制备Al(OH)3:Al3++3OH-=Al(OH)3↓ D、向NaHCO3溶液中加入Ba(OH)2溶液:HCO+OH-=CO+H2O10. 以不同类别物质间的转化为线索,可结构化认识钠及其化合物。下列说法错误的是
A、A B、B C、C D、D8. 下列关于FeCl3稀溶液、Fe(OH)3胶体、Fe(OH)3悬浊液的说法,正确的是A、三者均属于纯净物 B、三者的本质区别是能否发生丁达尔效应 C、分别对三者进行过滤操作,只有FeCl3溶液中的分散质粒子能穿过滤纸 D、向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续加热至红褐色可制得Fe(OH)3胶体9. 宏观辨识与微观探析是化学学科核心素养之一。下列反应方程式书写正确的是A、Fe在Cl2中燃烧:Fe+Cl2FeCl2 B、Cl2与FeCl2溶液反应:2Fe2++Cl2=2Fe3++2Cl- C、用AlCl3溶液和氨水制备Al(OH)3:Al3++3OH-=Al(OH)3↓ D、向NaHCO3溶液中加入Ba(OH)2溶液:HCO+OH-=CO+H2O10. 以不同类别物质间的转化为线索,可结构化认识钠及其化合物。下列说法错误的是 A、Na2O和CO2分别属于碱性氧化物和酸性氧化物 B、若改变过程I的反应条件,可得到钠的另一种氧化物 C、若改变过程IV中CO2的量,可得到另一种钠盐 D、过程I~IV中,发生了电子转移的是I、II、III11. 下列实验能达到目的的是
A、Na2O和CO2分别属于碱性氧化物和酸性氧化物 B、若改变过程I的反应条件,可得到钠的另一种氧化物 C、若改变过程IV中CO2的量,可得到另一种钠盐 D、过程I~IV中,发生了电子转移的是I、II、III11. 下列实验能达到目的的是A.检验Na2O2与水反应生成的气体
B.测定氯水的pH
C.制备纯净的Fe(OH)2
D.检验溶液中的Fe2+



 A、A B、B C、C D、D12. 我国科学家设计出仅需11步反应的人工合成淀粉路线,部分转化过程如图所示。已知HCHO的沸点为-19.5℃,NA为阿伏加德罗常数的值。下列说法错误的是
A、A B、B C、C D、D12. 我国科学家设计出仅需11步反应的人工合成淀粉路线,部分转化过程如图所示。已知HCHO的沸点为-19.5℃,NA为阿伏加德罗常数的值。下列说法错误的是 A、常温常压下,18gH2O中的质子数为18NA B、“碳固定”中,1molH2参与反应时转移的电子数为2NA C、标况下,22.4LHCHO和CO2混合物中所含碳原子数为NA D、人工合成淀粉若实现规模化生产,将有利于缓解全球变暖问题13. 价-类二维图是一种重要的学习工具,氯的价-类二维图如图。下列说法错误的是
A、常温常压下,18gH2O中的质子数为18NA B、“碳固定”中,1molH2参与反应时转移的电子数为2NA C、标况下,22.4LHCHO和CO2混合物中所含碳原子数为NA D、人工合成淀粉若实现规模化生产,将有利于缓解全球变暖问题13. 价-类二维图是一种重要的学习工具,氯的价-类二维图如图。下列说法错误的是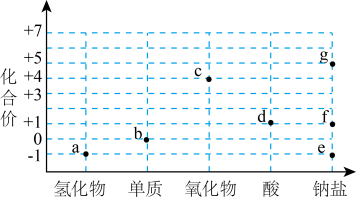 A、a→b需要加氧化剂 B、f→d可以加稀硫酸 C、b和烧碱反应可得e和f D、c不能用作自来水消毒剂14. 化学使生活更美好。下列生产生活情境中涉及的化学原理错误的是
A、a→b需要加氧化剂 B、f→d可以加稀硫酸 C、b和烧碱反应可得e和f D、c不能用作自来水消毒剂14. 化学使生活更美好。下列生产生活情境中涉及的化学原理错误的是选项
生产生活情境
化学原理
A
蒸馒头时加入小苏打,面团在发酵和蒸熟过程中体积均变大
NaHCO3与酸反应和加热条件下均能产生CO2气体
B
卡塔尔世界杯开幕式烟花秀流光溢彩
焰色试验属于化学变化
C
用FeCl3溶液刻蚀铜电路板
氧化性:Fe3+>Cu2+
D
工人将模具干燥后再注入熔融钢水
铁与H2O高温下会反应
A、A B、B C、C D、D15. 物质A是食品工业中一种重要的缓冲剂,其结构如图所示。W、X、Y、Z为原子序数依次增大的短周期主族元素,W、X、Y分别处于不同周期。下列说法正确的是 A、简单离子半径:Y>X B、简单氢化物的稳定性:X>Z C、该化合物中所有微粒均满足8电子稳定结构 D、W、X、Z形成的化合物是离子化合物16. 铁有两种氯化物,都是重要的化工试剂。它们的一些性质及制备方法如表:
A、简单离子半径:Y>X B、简单氢化物的稳定性:X>Z C、该化合物中所有微粒均满足8电子稳定结构 D、W、X、Z形成的化合物是离子化合物16. 铁有两种氯化物,都是重要的化工试剂。它们的一些性质及制备方法如表:物质
性质
工业制备方法
FeCl3
易升华,易潮解
向500~600℃的铁粉中通入氯气
FeCl2
易升华
向炽热铁粉中通入氯化氢
实验室可用如图所示的装置模拟工业生产无水氯化铁。下列说法正确的是
 A、装置A中药品为浓盐酸和MnO2 B、把a管换成细导管,实验更安全 C、装置C中的产品可能混有FeCl2 D、b管接装置D的效果优于接装置E
A、装置A中药品为浓盐酸和MnO2 B、把a管换成细导管,实验更安全 C、装置C中的产品可能混有FeCl2 D、b管接装置D的效果优于接装置E二、元素或物质推断题
-
17. 元素周期表反映元素之间的内在联系,是研究物质性质的重要工具。如表是元素周期表的一部分。请回答下列问题:
 (1)、画出④的原子结构示意图。(2)、①的单质在盛满⑧的单质的集气瓶中燃烧,反应现象为。(3)、③和④组成的一种物质中含有两种类型的化学键,该物质的电子式为。(4)、⑥的单质和④的最高价氧化物的水化物反应的化学方程式为。(5)、已知⑤的单质与②的最高价氧化物A在点燃条件下能反应生成黑色单质,推测④的单质(填“能不能”)与A反应,说明推测的理由。(6)、为比较⑦和⑧的非金属性,某小组同学设计实验进行探究。
(1)、画出④的原子结构示意图。(2)、①的单质在盛满⑧的单质的集气瓶中燃烧,反应现象为。(3)、③和④组成的一种物质中含有两种类型的化学键,该物质的电子式为。(4)、⑥的单质和④的最高价氧化物的水化物反应的化学方程式为。(5)、已知⑤的单质与②的最高价氧化物A在点燃条件下能反应生成黑色单质,推测④的单质(填“能不能”)与A反应,说明推测的理由。(6)、为比较⑦和⑧的非金属性,某小组同学设计实验进行探究。【理论依据】氧化性较强的单质能置换出氧化性较弱的单质
【实验方案】
实验操作
预测现象
取Na2S溶液于试管中,滴入少量新制氯水
_▲_
预测现象为。
【实验过程】
按照实验方案操作,观察到的现象与预测的一致,写出该反应的化学方程式。
【实验结论】
非金属性:⑦<⑧
三、实验题
-
18. 水体的化学需氧量(COD)能反映水体受还原性物质污染的程度。某小组用高锰酸钾法测定学校周边河水的COD值。请回答下列问题:
I.配制200mL2.00×10-3mol•L-1的KMnO4溶液
(1)、计算、称量:需用分析天平称量gKMnO4固体(保留到小数点后四位)。(2)、选择仪器:需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、。(3)、称量后,以下操作步骤的顺序为。
定容的操作是:将蒸馏水注入容量瓶,当 , 改用胶头滴管加水至溶液凹液面最底端与刻度线相切。
(4)、下列操作会使KMnO4溶液浓度偏低的是。①转移溶液前,容量瓶底部有水
②转移溶液时,溶液不慎洒到容量瓶外
③定容时,仰视刻度线
④摇匀后,液面低于刻度线,不再加水
(5)、配制KMnO4溶液后用稀硫酸酸化,说明不用盐酸酸化的原因。(6)、II.KMnO4法测定河水的COD值测定原理为:4KMnO4+5C+6H2SO4=4MnSO4+2K2SO4+5CO2↑+6H2O
其中C代替水中还原性物质,根据消耗KMnO4溶液的体积计算水样中还原性物质的浓度,进而计算水样的COD值[COD=c(C)×M(O2)]。
取水样25.00mL于锥形瓶中,加入稀硫酸,消耗所配制的KMnO4溶液的体积为12.50mL(三次实验平均值),计算该水样是否符合国家一级A出水标准。(写出计算过程,国家一级A出水标准为COD≤50mg•L-1)
19. 某小组通过实验探究氧化还原反应的规律。已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强,数值越小,还原性越强。
测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
物质
H2O2
H2O2(酸化)
FeCl3
KMnO4(酸化)
NaNO3(酸化)
NaBr
KI
Na2S
浓度
5%
5%
0.1mol•L-1
电位值/mV
276
683
671
1130
603
362
116
-361
根据表中数据,回答下列问题:
(1)、浓度均为0.1mol•L-1的下列三种溶液,氧化性由强到弱的顺序为(填序号)。①FeCl3 ②酸性KMnO4 ③酸性NaNO3
(2)、影响物质氧化性强弱的因素有、。(3)、已知Fe3+与I-不能共存,由此推测下列一定不能大量共存的离子组是。a.Fe3+、Br- b.Fe3+、S2- c.NO、H+、I- d.H+、MnO、I-
(4)、向等浓度的NaBr和KI混合溶液滴加少量酸性KMnO4溶液,发生反应的离子方程式为。(已知MnO在酸性环境下的产物为Mn2+)(5)、往淀粉-KI溶液中逐滴加入氯水,观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1:_▲_。
猜想2:I2被氯水继续氧化
查阅资料:HClO不能漂白淀粉与I2结合形成的蓝色物质。
序号
实验操作
试剂
现象
结论
1
分别取少量褪色的溶液于三支试管中,并加入对应试剂,观察实验现象
a
_▲_
猜想1不正确
2
淀粉溶液
溶液不变蓝
猜想2正确(I2被氧化为IO)
3
b+稀H2SO4
溶液变蓝
①猜想1为 , 实验1所用试剂a为 , 实验1的现象为。
②实验3所用试剂b是一种可溶性含碘化合物,该反应的离子方程式为。
四、工业流程题
-
20. 铁泥是一种常见的工业废料(主要成分为Fe2O3、FeO、Fe及杂质,杂质与酸不反应,难溶于水),可用于生产柠檬酸铁铵或磁性氧化铁,具体流程如图。

回答下列问题:
(1)、“溶解”时,Fe2O3与硫酸反应的离子方程式为。(2)、制备柠檬酸铁铵①写出“氧化”时发生反应的离子方程式并用单线桥表示该反应的电子转移情况。
②“氧化”时控制温度不超过90℃的原因是。
(3)、制备磁性氧化铁①“还原”时,加入的试剂X为(填化学式)。
②“操作I”为沉化、、洗涤至滤液呈性(填“酸、中、碱”)、干燥。
③在氩气中加热草酸亚铁晶体(FeC2O4∙2H2O),随温度升高,FeC2O4∙2H2O的质量变化曲线出现两个失重“台阶”,如图所示。结合表格,计算第一阶段的质量损失率为(保留4位有效数字),推断第二阶段产生的气体为。
(质量损失率=×100%)

失重阶段
温度范围/℃
质量损失率%
产物
第一阶段
室温~255
_▲_
FeC2O4
第二阶段
255-520
37.06
Fe3O4
-