北京市丰台区2022-2023学年高一上学期期末考试化学试题
试卷更新日期:2023-06-20 类型:期末考试
一、单选题
-
1. 2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。从物质分类看,醋酸钠属于( )A、酸 B、盐 C、碱 D、混合物2. 当光束通过下列分散系时,能观察到丁达尔效应的是A、H2SO4溶液 B、Fe(OH)3胶体 C、Na2SO4溶液 D、蔗糖溶液3. 下列物质能够导电且属于电解质的是A、盐酸 B、K2SO4溶液 C、熔融NaCl D、Cu4. 下列关于NaHCO3和Na2CO3的描述正确的是( )A、Na2CO3溶液显碱性,所以Na2CO3属于碱 B、NaHCO3水溶液中存在的离子只有Na+、H+和CO C、热稳定性:NaHCO3>Na2CO3 D、一定条件下,NaHCO3和Na2CO3之间可以互相转化5. 下列变化过程需要加入还原剂才能实现的是( )A、MnO→Mn2+ B、HSO→SO2 C、Fe→Fe2O3 D、Na→NaOH6. Na2SO3与下列物质的反应中,体现的性质与其他3个反应不同的是( )A、H2SO4 B、BaCl2 C、O2 D、Ca(OH)27. 常温下,下列物质可用铁制容器盛装的是( )A、稀硝酸 B、硫酸铜溶液 C、硝酸银溶液 D、浓硫酸8. 有关Na2O2的叙述不正确的是( )A、是淡黄色固体 B、可以作供氧剂 C、应密封保存 D、氧元素的化合价为−2价9. 下列物质与Cl2反应,能发出苍白色火焰的是( )A、H2 B、Na C、Fe D、Cu10. 下列气体既可用浓硫酸干燥,又可用碱石灰干燥的是( )A、H2 B、SO2 C、Cl2 D、NH311. 下列气体不能用排空气法收集的是( )A、SO2 B、NO C、O2 D、CO212. 下列各组离子在酸性溶液中能大量共存的是( )A、Na+、Mg2+、SO、Cl﹣ B、K+、Na+、Cl﹣、CO C、Na+、Ag+、Cl﹣、NO D、Fe3+、Na+、SO、OH﹣13. 下列物质间的转化,不能一步实现的是( )A、Na→Na2O2 B、Fe2O3→Fe(OH)3 C、Cl2→FeCl3 D、FeCl3→FeCl214. 下列离子方程式书写正确的是( )A、FeCl3腐蚀Cu电路板:2Fe3++Cu=2Fe2++Cu2+ B、铜与稀硝酸反应:Cu+4H++NO=Cu2++NO2↑+2H2O C、碳酸钙溶于盐酸中:CO+2H+=CO2↑+H2O D、氯气通入水中:Cl2+H2O=2H++Cl﹣+ClO﹣15. 下列说法中,正确的是( )A、0.1molN2中含有的原子数为0.1NA B、0.1molN2与0.1molCO的质量比为1:1 C、0.1molCO的体积是2.24L D、0.1mol•L﹣1NaCl溶液中含有0.1molNa+16. 下列物质中不能与CaO反应的是( )A、KOH B、H2O C、HCl D、SO217. 实验室中,下列行为不符合安全要求的是( )A、氯气制备应在通风橱内进行 B、金属钠着火时,立即用干燥沙土覆盖 C、实验结束后,将废液倒入下水道中 D、稀释浓硫酸时,将浓硫酸沿器壁缓慢倒入水中并用玻璃棒不断搅拌18. 下列关于容量瓶使用方法的叙述中,正确的是( )
①使用容量瓶前检查是否漏水;
②在容量瓶中溶解固体溶质;
③溶液需冷却至室温方可注入容量瓶;
④尽可能将溶质全部转移到容量瓶中;
⑤加水定容时,不小心超过刻度线,用胶头滴管吸出多余液体
A、①②③ B、①③④ C、③④⑤ D、①④⑤19. 如图是喷泉实验装置图,下列说法中不正确的是( ) A、烧瓶中的溶液呈红色 B、该实验说明氨气极易溶于水 C、该实验说明氨气的密度小于空气的 D、形成喷泉的原因是烧瓶内压强小于外界大气压20. 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )
A、烧瓶中的溶液呈红色 B、该实验说明氨气极易溶于水 C、该实验说明氨气的密度小于空气的 D、形成喷泉的原因是烧瓶内压强小于外界大气压20. 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )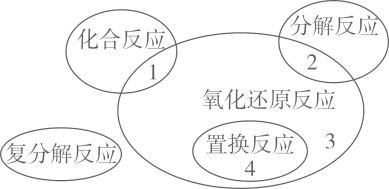 A、4Na+O2=2Na2O B、Na2CO3+2HCl=2NaCl+CO2↑+H2O C、4HNO32H2O+4NO2↑+O2↑ D、3CO+Fe2O32Fe+3CO221. 下列“实验结论”与“实验操作及现象”相符的一组是( )
A、4Na+O2=2Na2O B、Na2CO3+2HCl=2NaCl+CO2↑+H2O C、4HNO32H2O+4NO2↑+O2↑ D、3CO+Fe2O32Fe+3CO221. 下列“实验结论”与“实验操作及现象”相符的一组是( )选项
实验操作及现象
结论
A
向某溶液中加入稀盐酸,产生大量气体
该溶液中一定含有CO
B
向某溶液中加入AgNO3溶液,产生白色沉淀
该溶液中一定含有Cl﹣
C
向某溶液中加入BaCl2溶液产生白色沉淀,再加入盐酸,沉淀不消失
该溶液中一定含有SO
D
向某溶液中加入浓NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体
该溶液中一定含有NH
A、A B、B C、C D、D22. 为了除去粗盐中的Ca2+、Mg2+、SO , 可将粗盐溶于水后进行下列操作:
下列说法中不正确的是( )
A、NaOH的作用是除去Mg2+ B、Na2CO3的作用是除去过量的Ba2+ C、BaCl2必须在Na2CO3前加入 D、试剂a为盐酸23. 汽车尾气催化转化装置的工作原理如图所示。
下列说法中,不正确的是( )
A、汽车尾气中含有的CO和NO是大气污染物 B、该过程中氧元素被还原,氮元素只被氧化 C、使用催化转化装置在一定程度上提高了空气中CO2的含量 D、该过程中会发生反应:2NO2+4CO4CO2+N224. 双碱法脱除烟气中SO2的过程如图所示。下列说法中不正确的是( ) A、双碱法中的“双碱”是指NaOH和Ca(OH)2 B、过程Ⅰ和过程Ⅱ中碱的作用不同 C、脱除过程中硫元素的化合价一直没有变化 D、脱除SO2的过程中,NaOH可以循环利用25. 向100mL0.01mol/LBa(OH)2溶液中滴入几滴酚酞溶液,然后逐滴加入0.2mol/LH2SO4溶液,测得混合溶液的导电能力随时间变化如图所示。下列说法不正确的是( )
A、双碱法中的“双碱”是指NaOH和Ca(OH)2 B、过程Ⅰ和过程Ⅱ中碱的作用不同 C、脱除过程中硫元素的化合价一直没有变化 D、脱除SO2的过程中,NaOH可以循环利用25. 向100mL0.01mol/LBa(OH)2溶液中滴入几滴酚酞溶液,然后逐滴加入0.2mol/LH2SO4溶液,测得混合溶液的导电能力随时间变化如图所示。下列说法不正确的是( ) A、0s时溶液中存在的主要微粒是H2O、Ba2+、OH﹣ B、10~80s发生反应的离子方程式为Ba2++OH﹣+SO+H+=BaSO4↓+H2O C、最低点溶液完全褪色,此时消耗硫酸的体积为5mL D、90s以后电导率增大的原因是硫酸在水溶液中电离出H+和SO
A、0s时溶液中存在的主要微粒是H2O、Ba2+、OH﹣ B、10~80s发生反应的离子方程式为Ba2++OH﹣+SO+H+=BaSO4↓+H2O C、最低点溶液完全褪色,此时消耗硫酸的体积为5mL D、90s以后电导率增大的原因是硫酸在水溶液中电离出H+和SO二、填空题
-
26. 补齐物质与其用途之间的连线。
物质
用途
A.氧化铁
a.作红色颜料
B.硝酸钾
b.作膨松剂
C.次氯酸钠
c.作肥料
D.碳酸氢钠
d.作消毒剂
27. 氨气(NH3)是一种重要的化工原料,其中约80%用来生产各种氮肥。(1)、氨气的制备①实验室通过加热NH4Cl和Ca(OH)2的混合物制取氨,该反应的化学方程式为 。
②工业上以氮气和氢气为原料合成氨,该反应的化学方程式为 。其中氮元素的化合价 (填“升高”或“降低”),反应中每生成2molNH3 , 消耗H2的物质的量是 mol。
③我国科研团队借助一种固体催化剂(LDH),在常温、常压和可见光条件下合成了氨,其过程如图所示。
该反应的化学方程式为 。反应中每转移6mole﹣ , 生成NH3的体积为 L(标准状况下)。
 (2)、氮肥的制备和应用
(2)、氮肥的制备和应用主要转化途径如下(转化所需试剂及条件已略去):N2→NO2→HNO3硝酸盐[如NH4NO3]。
①写出NO2→HNO3的化学方程式 。
②将HNO3转化为NH4NO3 , 列举两种不同类别的化合物M (写化学式)。
③NH4NO3常作为水培植物营养液的氮肥来源。若配制0.2mol/L的NH4NO3溶液480mL,需要NH4NO3固体的质量 g。
三、实验题
-
28. 某小组同学利用以下实验装置研究SO2的性质(经检验,装置的气密性良好)。
 (1)、①中的现象说明SO2具有 性。(2)、②中石蕊溶液变红,说明SO2与H2O反应生成了酸性物质。写出该反应的化学方程式 。(3)、③中产生淡黄色浑浊,体现了SO2的 (填字母序号)。
(1)、①中的现象说明SO2具有 性。(2)、②中石蕊溶液变红,说明SO2与H2O反应生成了酸性物质。写出该反应的化学方程式 。(3)、③中产生淡黄色浑浊,体现了SO2的 (填字母序号)。a.氧化性 b.还原性
(4)、④的作用是 。29. 某小组同学探究久置FeSO4固体变质的情况,并测定其中铁元素的质量分数。将0.6gFeSO4固体用蒸馏水溶解,配成20mL待测液,进行实验。资料:KSCN中S元素的化合价为﹣2价;酸性条件下,MnO的还原产物为Mn2+。
(1)、实验一:
①i中溶液略微变红,说明待测液中存在 。
②ii中溶液颜色逐渐加深的原因是 (用离子方程式表示)。
③由实验一推测FeSO4固体变质的情况是 (填字母序号)。
a.未变质 b.部分变质 c.完全变质
(2)、实验二:探究ii中“红色褪去”的原因。针对“红色褪去”的现象,小组同学猜想可能的原因是 , 并通过如下实验证实了猜想。将褪色后的溶液分两份分别进行实验:
序号
操作
现象
①
滴加NaOH溶液
产生红褐色沉淀
②
滴加FeCl3溶液
__▲_
请补全②中的现象:。
(3)、实验三:测定久置FeSO4固体中铁元素的含量,设计实验方案如图:
①可选作A的物质是 (填字母序号)。
a.Zn b.Cu c.Fe d.KI
②若消耗0.1mol/LKMnO4溶液3.6mL,则久置FeSO4固体中铁元素的质量分数是 。
30. 某小组同学探究不同条件下氯气与二价锰化合物的反应资㺶:i.Mn2+在一定条件下被Cl2或ClO﹣氧化成MnO2(棕黑色)、MnO (绿色)、MnO (紫色)。
ii.浓同条件下,MnO可被OH﹣还原为MnO。
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):

序号
Ⅰ
Ⅱ
Ⅲ
物质a
水
5%NaOH溶液
40%NaOH溶液
通入Cl2前C中实验现象
得到无色溶液
产生白色沉淀,在空气中缓慢变成棕黑色沉淀
产生白色沉淀,在空气中缓慢变成棕黑色沉淀
通入Cl2后C中实验现象
产生棕黑色沉淀,且放置后不发生变化
棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
(1)、实验室中利用MnO2和浓盐酸加热的反应来制取氯气,对比本实验A中的反应,推测氧化性MnO2KMnO4(填“>”或“<”)。(2)、B中试剂是 (填序号)。①浓硫酸 ②饱和食盐水
(3)、通入Cl2前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色,补全发生反应的化学方程式:Mn(OH)2+=+H2O。(4)、对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是:①;
②在碱性条件下可以被氧化到更高价态。
(5)、根据资料ii,Ⅲ中应得到绿色溶液,实验中得到紫色溶液原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO氧化为MnO。
①用化学方程式表示可能导致溶液碱性减弱的原因 , 但通过实验测定,溶液的碱性变化很小。
②针对原因二小组同学做如下探究:
序号
Ⅳ
Ⅴ
操作
取Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液
取Ⅲ中放置后的1mL悬浊液,加入4mL水
现象
溶液紫色迅速变为绿色,且绿色缓慢加深
溶液紫色缓慢加深
Ⅳ中溶液紫色迅速变为绿色的离子方程式为 , 溶液绿色缓慢加深,原因是MnO2被 (填“化学式”)氧化,可证明Ⅲ的悬浊液中氧化剂过量。
③分析Ⅳ、Ⅴ实验现象不同的原因是 。