【高考真题】2023年辽宁省高考真题化学试题
试卷更新日期:2023-06-15 类型:高考真卷
一、单选题
-
1. 科技是第一生产力,我国科学家在诸多领域取得新突破,下列说法错误的是A、利用CO2合成了脂肪酸:实现了无机小分子向有机高分子的转变 B、发现了月壤中的“嫦娥石[(Ca8Y)Fe(PO4)7]”:其成分属于无机盐 C、研制了高效率钙钛矿太阳能电池,其能量转化形式:太阳能→电能 D、革新了海水原位电解制氢工艺:其关键材料多孔聚四氟乙烯耐腐蚀2. 下列化学用语或表述正确的是
 A、BeCl2的空间结构:V形 B、P4中的共价键类型:非极性键 C、基态Ni原子价电子排布式:3d10 D、顺—2—丁烯的结构简式:3. 下列有关物质的工业制备反应错误的是A、合成氨:N2+3H22NH3 B、制HCl:H2+Cl22HCl C、制粗硅:SiO2+2CSi+2CO D、冶炼镁:2MgO(熔融)2Mg+O2↑4. 下列鉴别或检验不能达到实验目的的是A、用石灰水鉴别Na2CO3与NaHCO3 B、用KSCN溶液检验FeSO4是否变质 C、用盐酸酸化的BaCl2溶液检验Na2SO3是否被氧化 D、加热条件下用银氨溶液检验乙醇中是否混有乙醛5. 我国古代四大发明之一黑火药的爆炸反应为:。设为阿伏加德罗常数的值,下列说法正确的是A、含键数目为 B、每生成转移电子数目为 C、晶体中含离子数目为 D、溶液中含数目为6. 在光照下,螺呲喃发生开、闭环转换而变色,过程如下。下列关于开、闭环螺呲喃说法正确的是
A、BeCl2的空间结构:V形 B、P4中的共价键类型:非极性键 C、基态Ni原子价电子排布式:3d10 D、顺—2—丁烯的结构简式:3. 下列有关物质的工业制备反应错误的是A、合成氨:N2+3H22NH3 B、制HCl:H2+Cl22HCl C、制粗硅:SiO2+2CSi+2CO D、冶炼镁:2MgO(熔融)2Mg+O2↑4. 下列鉴别或检验不能达到实验目的的是A、用石灰水鉴别Na2CO3与NaHCO3 B、用KSCN溶液检验FeSO4是否变质 C、用盐酸酸化的BaCl2溶液检验Na2SO3是否被氧化 D、加热条件下用银氨溶液检验乙醇中是否混有乙醛5. 我国古代四大发明之一黑火药的爆炸反应为:。设为阿伏加德罗常数的值,下列说法正确的是A、含键数目为 B、每生成转移电子数目为 C、晶体中含离子数目为 D、溶液中含数目为6. 在光照下,螺呲喃发生开、闭环转换而变色,过程如下。下列关于开、闭环螺呲喃说法正确的是 A、均有手性 B、互为同分异构体 C、N原子杂化方式相同 D、闭环螺吡喃亲水性更好7. 某无隔膜流动海水电解法制的装置如下图所示,其中高选择性催化剂可抑制产生。下列说法正确的是
A、均有手性 B、互为同分异构体 C、N原子杂化方式相同 D、闭环螺吡喃亲水性更好7. 某无隔膜流动海水电解法制的装置如下图所示,其中高选择性催化剂可抑制产生。下列说法正确的是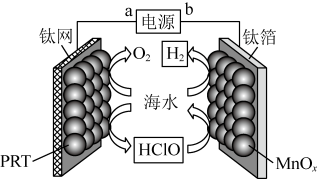 A、b端电势高于a端电势 B、理论上转移生成 C、电解后海水下降 D、阳极发生:8. 冠醚因分子结构形如皇冠而得名,某冠醚分子c可识别 , 其合成方法如下。下列说法错误的是
A、b端电势高于a端电势 B、理论上转移生成 C、电解后海水下降 D、阳极发生:8. 冠醚因分子结构形如皇冠而得名,某冠醚分子c可识别 , 其合成方法如下。下列说法错误的是 A、该反应为取代反应 B、a、b均可与溶液反应 C、c核磁共振氢谱有3组峰 D、c可增加在苯中的溶解度
A、该反应为取代反应 B、a、b均可与溶液反应 C、c核磁共振氢谱有3组峰 D、c可增加在苯中的溶解度二、多选题
-
9. 某种镁盐具有良好的电化学性能,其阴离子结构如下图所示。W、X、Y、Z、Q是核电荷数依次增大的短周期元素,W、Y原子序数之和等于Z,Y原子价电子数是Q原子价电子数的2倍。下列说法错误的是
 A、W与X的化合物为极性分子 B、第一电离能 C、Q的氧化物是两性氧化物 D、该阴离子中含有配位键
A、W与X的化合物为极性分子 B、第一电离能 C、Q的氧化物是两性氧化物 D、该阴离子中含有配位键三、单选题
-
10. 某工厂采用如下工艺制备 , 已知焙烧后元素以价形式存在,下列说法错误的是
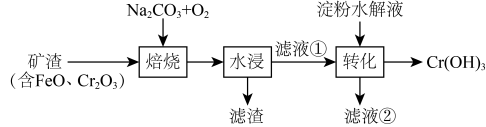 A、“焙烧”中产生 B、滤渣的主要成分为 C、滤液①中元素的主要存在形式为 D、淀粉水解液中的葡萄糖起还原作用11. 某低成本储能电池原理如下图所示。下列说法正确的是
A、“焙烧”中产生 B、滤渣的主要成分为 C、滤液①中元素的主要存在形式为 D、淀粉水解液中的葡萄糖起还原作用11. 某低成本储能电池原理如下图所示。下列说法正确的是 A、放电时负极质量减小 B、储能过程中电能转变为化学能 C、放电时右侧通过质子交换膜移向左侧 D、充电总反应:12. 一定条件下,酸性溶液与发生反应,(Ⅱ)起催化作用,过程中不同价态含粒子的浓度随时间变化如下图所示。下列说法正确的是
A、放电时负极质量减小 B、储能过程中电能转变为化学能 C、放电时右侧通过质子交换膜移向左侧 D、充电总反应:12. 一定条件下,酸性溶液与发生反应,(Ⅱ)起催化作用,过程中不同价态含粒子的浓度随时间变化如下图所示。下列说法正确的是 A、(Ⅲ)不能氧化 B、随着反应物浓度的减小,反应速率逐渐减小 C、该条件下,(Ⅱ)和(Ⅶ)不能大量共存 D、总反应为:13. 某小组进行实验,向蒸馏水中加入 , 充分振荡,溶液呈浅棕色,再加入锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知为棕色,下列关于颜色变化的解释错误的是
A、(Ⅲ)不能氧化 B、随着反应物浓度的减小,反应速率逐渐减小 C、该条件下,(Ⅱ)和(Ⅶ)不能大量共存 D、总反应为:13. 某小组进行实验,向蒸馏水中加入 , 充分振荡,溶液呈浅棕色,再加入锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知为棕色,下列关于颜色变化的解释错误的是选项
颜色变化
解释
A
溶液呈浅棕色
在水中溶解度较小
B
溶液颜色加深
发生了反应:
C
紫黑色晶体消失
()的消耗使溶解平衡右移
D
溶液褪色
与有色物质发生了置换反应
A、A B、B C、C D、D14. 晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是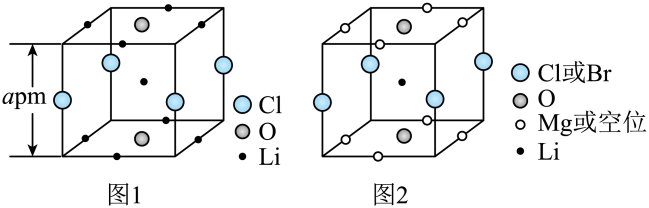 A、图1晶体密度为g∙cm-3 B、图1中O原子的配位数为6 C、图2表示的化学式为 D、取代产生的空位有利于传导15. 某废水处理过程中始终保持H2S饱和,即 , 通过调节pH使和形成硫化物而分离,体系中与关系如下图所示,c为和的浓度,单位为。已知 , 下列说法正确的是
A、图1晶体密度为g∙cm-3 B、图1中O原子的配位数为6 C、图2表示的化学式为 D、取代产生的空位有利于传导15. 某废水处理过程中始终保持H2S饱和,即 , 通过调节pH使和形成硫化物而分离,体系中与关系如下图所示,c为和的浓度,单位为。已知 , 下列说法正确的是 A、 B、③为与的关系曲线 C、 D、
A、 B、③为与的关系曲线 C、 D、四、工业流程题
-
16. 某工厂采用如下工艺处理镍钴矿硫酸浸取液含(和)。实现镍、钴、镁元素的回收。

已知:
物质
回答下列问题:
(1)、用硫酸浸取镍钴矿时,提高浸取速率的方法为(答出一条即可)。(2)、“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸 , 中过氧键的数目为。(3)、“氧化”中,用石灰乳调节 , 被氧化为 , 该反应的离子方程式为(的电离第一步完全,第二步微弱);滤渣的成分为、(填化学式)。(4)、“氧化”中保持空气通入速率不变,(Ⅱ)氧化率与时间的关系如下。体积分数为时,(Ⅱ)氧化速率最大;继续增大体积分数时,(Ⅱ)氧化速率减小的原因是。 (5)、“沉钴镍”中得到的(Ⅱ)在空气中可被氧化成 , 该反应的化学方程式为。(6)、“沉镁”中为使沉淀完全 , 需控制不低于(精确至0.1)。
(5)、“沉钴镍”中得到的(Ⅱ)在空气中可被氧化成 , 该反应的化学方程式为。(6)、“沉镁”中为使沉淀完全 , 需控制不低于(精确至0.1)。五、实验题
-
17. 2—噻吩乙醇()是抗血栓药物氯吡格雷的重要中间体,其制备方法如下:

Ⅰ.制钠砂。向烧瓶中加入液体A和金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至 , 加入噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至 , 加入稍过量的环氧乙烷的四氢呋喃溶液,反应。
Ⅳ.水解。恢复室温,加入水,搅拌;加盐酸调至4~6,继续反应 , 分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水 , 静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A后,得到产品。
回答下列问题:
(1)、步骤Ⅰ中液体A可以选择。a.乙醇 b.水 c.甲苯 d.液氨
(2)、噻吩沸点低于吡咯(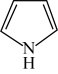 )的原因是。 (3)、步骤Ⅱ的化学方程式为。(4)、步骤Ⅲ中反应放热,为防止温度过高引发副反应,加入环氧乙烷溶液的方法是。(5)、步骤Ⅳ中用盐酸调节的目的是。(6)、下列仪器在步骤Ⅴ中无需使用的是(填名称):无水的作用为。
)的原因是。 (3)、步骤Ⅱ的化学方程式为。(4)、步骤Ⅲ中反应放热,为防止温度过高引发副反应,加入环氧乙烷溶液的方法是。(5)、步骤Ⅳ中用盐酸调节的目的是。(6)、下列仪器在步骤Ⅴ中无需使用的是(填名称):无水的作用为。 (7)、产品的产率为(用计算,精确至0.1%)。
(7)、产品的产率为(用计算,精确至0.1%)。六、原理综合题
-
18. 硫酸工业在国民经济中占有重要地位。(1)、我国古籍记载了硫酸的制备方法——“炼石胆(CuSO4·5H2O)取精华法”。借助现代仪器分析,该制备过程中CuSO4·5H2O分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如下图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有SO2、和(填化学式)。
 (2)、铅室法使用了大容积铅室制备硫酸(76%以下),副产物为亚硝基硫酸,主要反应如下:
(2)、铅室法使用了大容积铅室制备硫酸(76%以下),副产物为亚硝基硫酸,主要反应如下:NO2+SO2+H2O=NO+H2SO4
2NO+O2=2NO2
(ⅰ)上述过程中NO2的作用为。
(ⅱ)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是(答出两点即可)。
(3)、接触法制硫酸的关键反应为SO2的催化氧化:SO2(g)+O2(g)SO3(g) ΔH=-98.9kJ·mol-1
(ⅰ)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如下图所示,下列说法正确的是。

a.温度越高,反应速率越大
b.α=0.88的曲线代表平衡转化率
c.α越大,反应速率最大值对应温度越低
d.可根据不同下的最大速率,选择最佳生产温度
(ⅱ)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如下图所示,催化性能最佳的是(填标号)。

(ⅲ)设O2的平衡分压为p,SO2的平衡转化率为αe , 用含p和αe的代数式表示上述催化氧化反应的Kp=(用平衡分压代替平衡浓度计算)。
七、有机推断题
-
19. 加兰他敏是一种天然生物碱,可作为阿尔茨海默症的药物,其中间体的合成路线如下。

回答下列问题:
(1)、A中与卤代烃成醚活性高的羟基位于酯基的位(填“间”或“对”)。(2)、C发生酸性水解,新产生的官能团为羟基和(填名称)。(3)、用O2代替PCC完成D→E的转化,化学方程式为。(4)、F的同分异构体中,红外光谱显示有酚羟基、无N-H键的共有种。(5)、H→I的反应类型为。(6)、某药物中间体的合成路线如下(部分反应条件已略去),其中M和N的结构简式分别为和。
-
-
-
-