【高考真题】2023年湖北省高考真题化学试题
试卷更新日期:2023-06-15 类型:高考真卷
一、单选题
-
1. 2023年5月10日,天舟六号货运飞船成功发射,标志着我国航天事业进入到高质量发展新阶段。下列不能作为火箭推进剂的是A、液氮-液氢 B、液氧-液氢 C、液态-肼 D、液氧-煤油2. 下列化学事实不符合“事物的双方既相互对立又相互统一”的哲学观点的是A、石灰乳中存在沉淀溶解平衡 B、氯气与强碱反应时既是氧化剂又是还原剂 C、铜锌原电池工作时,正极和负极同时发生反应 D、Li、Na、K的金属性随其核外电子层数增多而增强3. 工业制备高纯硅的主要过程如下:
石英砂粗硅高纯硅
下列说法错误的是
A、制备粗硅的反应方程式为 B、1molSi含Si-Si键的数目约为 C、原料气HCl和应充分去除水和氧气 D、生成的反应为熵减过程4. 湖北蕲春李时珍的《本草纲目》记载的中药丹参,其水溶性有效成分之一的结构简式如图。下列说法正确的是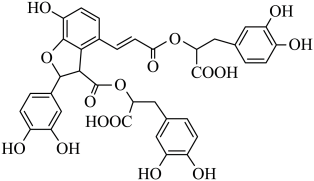 A、该物质属于芳香烃 B、可发生取代反应和氧化反应 C、分子中有5个手性碳原子 D、1mol该物质最多消耗9molNaOH5. 化学用语可以表达化学过程,下列化学用语的表达错误的是A、用电子式表示的形成:
A、该物质属于芳香烃 B、可发生取代反应和氧化反应 C、分子中有5个手性碳原子 D、1mol该物质最多消耗9molNaOH5. 化学用语可以表达化学过程,下列化学用语的表达错误的是A、用电子式表示的形成: B、用离子方程式表示溶于烧碱溶液:
C、用电子云轮廓图表示H-H的s-sσ键形成的示意图:
B、用离子方程式表示溶于烧碱溶液:
C、用电子云轮廓图表示H-H的s-sσ键形成的示意图: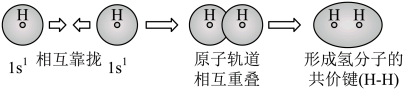 D、用化学方程式表示尿素与甲醛制备线型脲醛树脂:
D、用化学方程式表示尿素与甲醛制备线型脲醛树脂: 6. W、X、Y、Z为原子序数依次增加的同一短周期元素,其中X、Y、Z相邻,W的核外电子数与X的价层电子数相等,是氧化性最强的单质,4种元素可形成离子化合物。下列说法正确的是A、分子的极性: B、第一电离能:X<Y<Z C、氧化性: D、键能:7. 中科院院士研究发现,纤维素可在低温下溶于NaOH溶液,恢复至室温后不稳定,加入尿素可得到室温下稳定的溶液,为纤维素绿色再生利用提供了新的解决方案。下列说法错误的是
6. W、X、Y、Z为原子序数依次增加的同一短周期元素,其中X、Y、Z相邻,W的核外电子数与X的价层电子数相等,是氧化性最强的单质,4种元素可形成离子化合物。下列说法正确的是A、分子的极性: B、第一电离能:X<Y<Z C、氧化性: D、键能:7. 中科院院士研究发现,纤维素可在低温下溶于NaOH溶液,恢复至室温后不稳定,加入尿素可得到室温下稳定的溶液,为纤维素绿色再生利用提供了新的解决方案。下列说法错误的是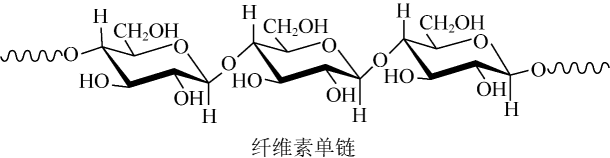 A、纤维素是自然界分布广泛的一种多糖 B、纤维素难溶于水的主要原因是其链间有多个氢键 C、NaOH提供破坏纤维素链之间的氢键 D、低温降低了纤维素在NaOH溶液中的溶解性8. 实验室用以下装置(夹持和水浴加热装置略)制备乙酸异戊酯(沸点142℃),实验中利用环己烷-水的共沸体系(沸点69℃)带出水分。已知体系中沸点最低的有机物是环己烷(沸点81℃),其反应原理:
A、纤维素是自然界分布广泛的一种多糖 B、纤维素难溶于水的主要原因是其链间有多个氢键 C、NaOH提供破坏纤维素链之间的氢键 D、低温降低了纤维素在NaOH溶液中的溶解性8. 实验室用以下装置(夹持和水浴加热装置略)制备乙酸异戊酯(沸点142℃),实验中利用环己烷-水的共沸体系(沸点69℃)带出水分。已知体系中沸点最低的有机物是环己烷(沸点81℃),其反应原理: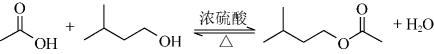
下列说法错误的是
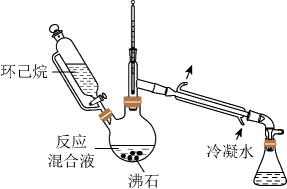 A、以共沸体系带水促使反应正向进行 B、反应时水浴温度需严格控制在69℃ C、接收瓶中会出现分层现象 D、根据带出水的体积可估算反应进度9. 价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是A、和的VSEPR模型均为四面体 B、和的空间构型均为平面三角形 C、和均为非极性分子 D、与的键角相等10. 我国科学家设计如图所示的电解池,实现了海水直接制备氢气技术的绿色化。该装置工作时阳极无生成且KOH溶液的浓度不变,电解生成氢气的速率为。下列说法错误的是
A、以共沸体系带水促使反应正向进行 B、反应时水浴温度需严格控制在69℃ C、接收瓶中会出现分层现象 D、根据带出水的体积可估算反应进度9. 价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是A、和的VSEPR模型均为四面体 B、和的空间构型均为平面三角形 C、和均为非极性分子 D、与的键角相等10. 我国科学家设计如图所示的电解池,实现了海水直接制备氢气技术的绿色化。该装置工作时阳极无生成且KOH溶液的浓度不变,电解生成氢气的速率为。下列说法错误的是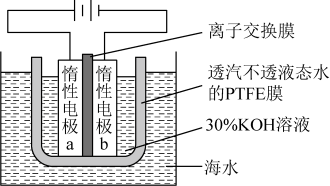 A、b电极反应式为 B、离子交换膜为阴离子交换膜 C、电解时海水中动能高的水分子可穿过PTFE膜 D、海水为电解池补水的速率为11. 物质结构决定物质性质。下列性质差异与结构因素匹配错误的是
A、b电极反应式为 B、离子交换膜为阴离子交换膜 C、电解时海水中动能高的水分子可穿过PTFE膜 D、海水为电解池补水的速率为11. 物质结构决定物质性质。下列性质差异与结构因素匹配错误的是选项
性质差异
结构因素
A
沸点:正戊烷(36.1℃)高于新戊烷(9.5℃)
分子间作用力
B
熔点:(1040℃)远高于(178℃升华)
晶体类型
C
酸性:()远强于()
羟基极性
D
溶解度(20℃):(29g)大于(8g)
阴离子电荷
A、A B、B C、C D、D12. 下列事实不涉及烯醇式与酮式互变异构原理的是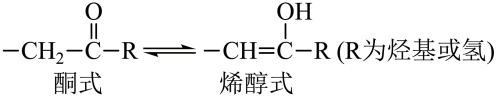 A、能与水反应生成 B、
A、能与水反应生成 B、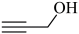 可与反应生成
可与反应生成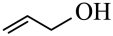 C、
C、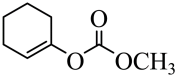 水解生成
水解生成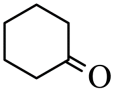 D、
D、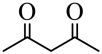 中存在具有分子内氢键的异构体
中存在具有分子内氢键的异构体 13. 利用如图所示的装置(夹持及加热装置略)制备高纯白磷的流程如下:
13. 利用如图所示的装置(夹持及加热装置略)制备高纯白磷的流程如下:
下列操作错误的是
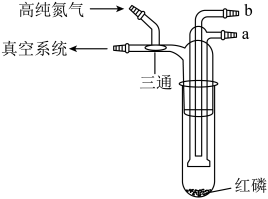 A、红磷使用前洗涤以除去表面杂质 B、将红磷转入装置,抽真空后加热外管以去除水和氧气 C、从a口通入冷凝水,升温使红磷转化 D、冷凝管外壁出现白磷,冷却后在氮气氛围下收集14. 为某邻苯二酚类配体,其 , 。常温下构建溶液体系,其中 , 。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数 , 已知 , 。下列说法正确的是
A、红磷使用前洗涤以除去表面杂质 B、将红磷转入装置,抽真空后加热外管以去除水和氧气 C、从a口通入冷凝水,升温使红磷转化 D、冷凝管外壁出现白磷,冷却后在氮气氛围下收集14. 为某邻苯二酚类配体,其 , 。常温下构建溶液体系,其中 , 。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数 , 已知 , 。下列说法正确的是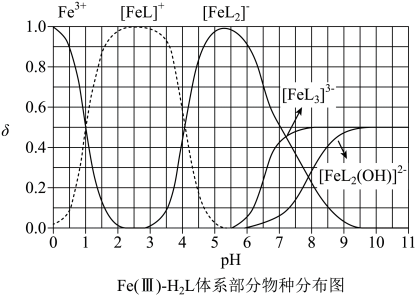 A、当时,体系中 B、pH在9.5~10.5之间,含L的物种主要为 C、的平衡常数的lgK约为14 D、当时,参与配位的15. 镧La和H可以形成一系列晶体材料 , 在储氢和超导等领域具有重要应用。 , 属于立方晶系,晶胞结构和参数如图所示。高压下,中的每个H结合4个H形成类似的结构,即得到晶体。下列说法错误的是
A、当时,体系中 B、pH在9.5~10.5之间,含L的物种主要为 C、的平衡常数的lgK约为14 D、当时,参与配位的15. 镧La和H可以形成一系列晶体材料 , 在储氢和超导等领域具有重要应用。 , 属于立方晶系,晶胞结构和参数如图所示。高压下,中的每个H结合4个H形成类似的结构,即得到晶体。下列说法错误的是 A、晶体中La的配位数为8 B、晶体中H和H的最短距离: C、在晶胞中,H形成一个顶点数为40的闭合多面体笼 D、单位体积中含氢质量的计算式为
A、晶体中La的配位数为8 B、晶体中H和H的最短距离: C、在晶胞中,H形成一个顶点数为40的闭合多面体笼 D、单位体积中含氢质量的计算式为二、工业流程题
-
16. 是生产多晶硅的副产物。利用对废弃的锂电池正极材料进行氯化处理以回收Li、Co等金属,工艺路线如下:
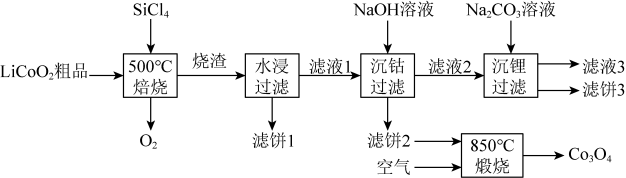
回答下列问题:
(1)、Co位于元素周期表第周期,第族。(2)、烧渣是LiCl、和的混合物,“500℃焙烧”后剩余的应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因。(3)、鉴别洗净的“滤饼3”和固体常用方法的名称是。(4)、已知 , 若“沉钴过滤”的pH控制为10.0,则溶液中浓度为。“850℃煅烧”时的化学方程式为。(5)、导致比易水解的因素有(填标号)。a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
三、有机推断题
-
17. 碳骨架的构建是有机合成的重要任务之一。某同学从基础化工原料乙烯出发,针对二酮H设计了如下合成路线:
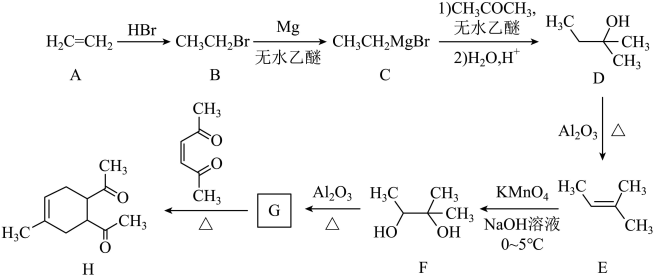
回答下列问题:
(1)、由A→B的反应中,乙烯的碳碳键断裂(填“π”或“σ”)。(2)、D的同分异构体中,与其具有相同官能团的有种(不考虑对映异构),其中核磁共振氢谱有三组峰,峰面积之比为的结构简式为。(3)、E与足量酸性溶液反应生成的有机物的名称为、。(4)、G的结构简式为。(5)、已知: ,H在碱性溶液中易发生分子内缩合从而构建双环结构,主要产物为I(
,H在碱性溶液中易发生分子内缩合从而构建双环结构,主要产物为I( )和另一种α,β-不饱和酮J,J的结构简式为。若经此路线由H合成I,存在的问题有(填标号)。
)和另一种α,β-不饱和酮J,J的结构简式为。若经此路线由H合成I,存在的问题有(填标号)。 a.原子利用率低 b.产物难以分离 c.反应条件苛刻 d.严重污染环境
四、填空题
-
18. 学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:(1)、铜与浓硝酸反应的装置如下图,仪器A的名称为 , 装置B的作用为。
 (2)、铜与过量反应的探究如下:
(2)、铜与过量反应的探究如下:
实验②中Cu溶解的离子方程式为;产生的气体为。比较实验①和②,从氧化还原角度说明的作用是。
(3)、用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,提纯干燥后的X在惰性氛围下加热,mgX完全分解为ng黑色氧化物Y,。X的化学式为。(4)、取含X粗品0.0500g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用标准溶液滴定,滴定终点时消耗标准溶液15.00mL。(已知: , )标志滴定终点的现象是 , 粗品中X的相对含量为。五、原理综合题
-
19. 纳米碗是一种奇特的碗状共轭体系。高温条件下,可以由分子经过连续5步氢抽提和闭环脱氢反应生成。的反应机理和能量变化如下:
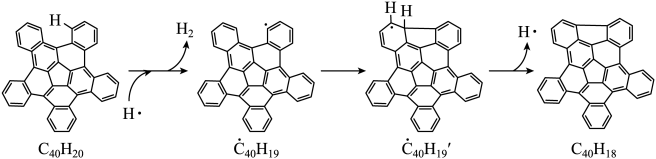
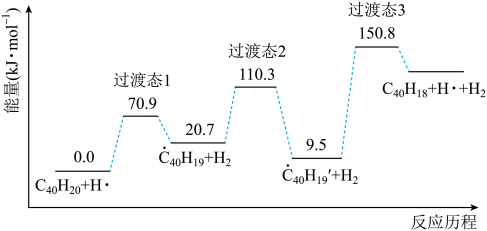
回答下列问题:
(1)、已知中的碳氢键和碳碳键的键能分别为和 , H-H键能为。估算的。(2)、图示历程包含个基元反应,其中速率最慢的是第个。(3)、 纳米碗中五元环和六元环结构的数目分别为、。(4)、1200K时,假定体系内只有反应发生,反应过程中压强恒定为(即的初始压强),平衡转化率为α,该反应的平衡常数为(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(5)、 及反应的(为平衡常数)随温度倒数的关系如图所示。已知本实验条件下,(R为理想气体常数,c为截距)。图中两条线几乎平行,从结构的角度分析其原因是。 (6)、下列措施既能提高反应物的平衡转化率,又能增大生成的反应速率的是(填标号)。
(6)、下列措施既能提高反应物的平衡转化率,又能增大生成的反应速率的是(填标号)。a.升高温度 b.增大压强 c.加入催化剂
-
-
-