浙江省温州市十校联合体2022-2023学年高一下学期期中联考化学试卷
试卷更新日期:2023-06-14 类型:期中考试
一、单选题
-
1. 下列属于酸性氧化物的是( )A、 B、 C、 D、2. 蒸馏实验中需要用到的仪器是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列化学用语表述正确的是( )A、的结构示意图:
3. 下列化学用语表述正确的是( )A、的结构示意图: B、的球棍模型:
B、的球棍模型: C、的结构式:
D、氟化钠的电子式:
C、的结构式:
D、氟化钠的电子式: 4. 下列物质不能使溴水褪色的是( )A、聚乙烯 B、二氧化硫 C、乙烯 D、乙炔5. 下列物质属于电解质的是( )A、 B、蔗糖溶液 C、熔融 D、6. 下列变化过程中,加入还原剂才能实现的是( )A、 B、 C、 D、7. 下列过程属于物理变化的是( )A、酒精消毒 B、胶水粘结 C、食醋清除水垢 D、甲烷的燃烧8. 下列物质的俗称与化学式对应正确的是( )A、苏打—— B、熟石膏—— C、胆矾—— D、磁性氧化铁——9. 下列说法正确的是( )A、与互称同位素 B、与互为同素异形体 C、和为同一物质 D、表示中子数为8的氧元素的一种核素10. 下列说法不正确的是( )A、利用丁达尔效应鉴别氢氧化铁胶体和氯化铁溶液 B、硫黄在过量空气中燃烧生成 C、在食品包装袋内放入铁系保鲜剂可以防止食品因氧化而变质 D、医疗上硫酸钡可用于肠胃X射线造影检查11. 短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为20,则下列说法不正确的是( )
4. 下列物质不能使溴水褪色的是( )A、聚乙烯 B、二氧化硫 C、乙烯 D、乙炔5. 下列物质属于电解质的是( )A、 B、蔗糖溶液 C、熔融 D、6. 下列变化过程中,加入还原剂才能实现的是( )A、 B、 C、 D、7. 下列过程属于物理变化的是( )A、酒精消毒 B、胶水粘结 C、食醋清除水垢 D、甲烷的燃烧8. 下列物质的俗称与化学式对应正确的是( )A、苏打—— B、熟石膏—— C、胆矾—— D、磁性氧化铁——9. 下列说法正确的是( )A、与互称同位素 B、与互为同素异形体 C、和为同一物质 D、表示中子数为8的氧元素的一种核素10. 下列说法不正确的是( )A、利用丁达尔效应鉴别氢氧化铁胶体和氯化铁溶液 B、硫黄在过量空气中燃烧生成 C、在食品包装袋内放入铁系保鲜剂可以防止食品因氧化而变质 D、医疗上硫酸钡可用于肠胃X射线造影检查11. 短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为20,则下列说法不正确的是( )X
Y
W
Z
A、工业上用电解熔融的W与Z所形成的化合物来制取W B、最高价氧化物的水化物的酸性: C、简单离子半径大小: D、W和Y形成的化合物可与Z的氢化物的水溶液发生反应12. 下列离子方程式正确的是( )A、与反应: B、与少量盐酸反应: C、溶液中通入 D、溶液与溶液等浓度等体积混合时:13. 用下图所示装置进行如下实验,能达到实验目的是( ) A、瓶中盛适量饱和溶液,从A口进气来除去二氧化硫中的二氧化碳 B、瓶中装满水,A口连导管并伸入量筒中,从B口进气,可用排水法测量生成甲烷的体积 C、从A口进气,用排空气法收集氢气 D、瓶中盛满水,从B口进气,用排水法收集氯气14. 关于有机物
A、瓶中盛适量饱和溶液,从A口进气来除去二氧化硫中的二氧化碳 B、瓶中装满水,A口连导管并伸入量筒中,从B口进气,可用排水法测量生成甲烷的体积 C、从A口进气,用排空气法收集氢气 D、瓶中盛满水,从B口进气,用排水法收集氯气14. 关于有机物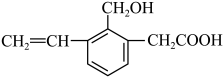 的说法不正确的是( ) A、含有3种官能团 B、能发生氧化、取代和加聚反应 C、分子式为 D、该有机物与足量反应生成15. 化学是一门以实验为基础的学科,掌握基本实验方法和操作技能是学好化学的基础。下列有关化学实验基本知识的描述不正确的是( )A、玻璃棒在过滤和蒸发操作中的作用不相同 B、水和苯的混合物可用分液的方法分离 C、胶体的制备是不能在沸腾的氢氧化钠溶液中滴加氯化铁溶液 D、向溶液中先通入少量 , 再滴加几滴品红溶液,可观察到:溶液先变浑浊,加品红后的溶液红色不褪色16. 肼是一种高能燃料,共价键的键能与热化学方程式信息如表:
的说法不正确的是( ) A、含有3种官能团 B、能发生氧化、取代和加聚反应 C、分子式为 D、该有机物与足量反应生成15. 化学是一门以实验为基础的学科,掌握基本实验方法和操作技能是学好化学的基础。下列有关化学实验基本知识的描述不正确的是( )A、玻璃棒在过滤和蒸发操作中的作用不相同 B、水和苯的混合物可用分液的方法分离 C、胶体的制备是不能在沸腾的氢氧化钠溶液中滴加氯化铁溶液 D、向溶液中先通入少量 , 再滴加几滴品红溶液,可观察到:溶液先变浑浊,加品红后的溶液红色不褪色16. 肼是一种高能燃料,共价键的键能与热化学方程式信息如表:共价键
键能/
391
161
498
946
463
则关于反应说法正确的是( )
A、比能量高 B、该反应是吸热反应 C、键比键稳定 D、反应物总键能小于生成物总键能17. 锌—空气电池(原理如图)适宜用作城市电动车的动力电源。该电池放电时转化为。该电池工作时,下列说法正确的是( ) A、向石墨电极移动 B、石墨电极的电极反应式: C、电极发生还原反应 D、当电路中流过电子,消耗的体积为(标准状况下)18. 下列工业生产过程中操作不正确的是( )A、在钢铁的生产中,注入铁水的模具必须干燥 B、侯氏制碱工业是以氯化钠为主要原料,制得大量 C、在含硫的燃料中加入适量生石灰,可以减少二氧化硫的排放量 D、人们往往根据需要在生产塑料的合成树脂中加入特定作用的添加剂19. 代表阿伏加德罗常数的值。下列有关的叙述中,正确的是( )A、标准状况下,含有的分子数为 B、金刚石含共价键数为 C、常温常压下,和混合气体中含有的碳原子数目小于 D、固体中含有的离子总数为20. 某温度下,在2 L恒容密闭容器中投入一定量的A、B,发生反应: , 12 s时生成C的物质的量为0.8 mol(反应进程如图所示)。下列说法中正确的是( )
A、向石墨电极移动 B、石墨电极的电极反应式: C、电极发生还原反应 D、当电路中流过电子,消耗的体积为(标准状况下)18. 下列工业生产过程中操作不正确的是( )A、在钢铁的生产中,注入铁水的模具必须干燥 B、侯氏制碱工业是以氯化钠为主要原料,制得大量 C、在含硫的燃料中加入适量生石灰,可以减少二氧化硫的排放量 D、人们往往根据需要在生产塑料的合成树脂中加入特定作用的添加剂19. 代表阿伏加德罗常数的值。下列有关的叙述中,正确的是( )A、标准状况下,含有的分子数为 B、金刚石含共价键数为 C、常温常压下,和混合气体中含有的碳原子数目小于 D、固体中含有的离子总数为20. 某温度下,在2 L恒容密闭容器中投入一定量的A、B,发生反应: , 12 s时生成C的物质的量为0.8 mol(反应进程如图所示)。下列说法中正确的是( ) A、12 s时,B的转化率为40% B、0∼2 s内,D的平均反应速率为0.2 mol⋅L⋅s C、化学计量系数之比 , 且 D、图中两曲线相交时,A的消耗速率等于A的生成速率21. 常温下固体遇会形成(可溶于水),加热条件下该固体又易分解生成和 , 下列说法正确的是( )A、作干燥剂时,可以干燥 B、实验室不适宜采用固体与固体混合加热的方法制备少量 C、溶于水,通入可以产生白色沉淀 D、与形成的过程不是化学变化22. 某工厂的工业废水中含有大量的和较多的。为减少污染并变废为宝,工厂计划从该废水中回收金属和硫酸亚铁晶体,流程如下:
A、12 s时,B的转化率为40% B、0∼2 s内,D的平均反应速率为0.2 mol⋅L⋅s C、化学计量系数之比 , 且 D、图中两曲线相交时,A的消耗速率等于A的生成速率21. 常温下固体遇会形成(可溶于水),加热条件下该固体又易分解生成和 , 下列说法正确的是( )A、作干燥剂时,可以干燥 B、实验室不适宜采用固体与固体混合加热的方法制备少量 C、溶于水,通入可以产生白色沉淀 D、与形成的过程不是化学变化22. 某工厂的工业废水中含有大量的和较多的。为减少污染并变废为宝,工厂计划从该废水中回收金属和硫酸亚铁晶体,流程如下:
下列说法不正确的是( )
A、检验硫酸亚铁晶体中的金属阳离子时,滴加的试剂依次是溶液、氯水 B、试剂A为铁粉,试剂B可能是稀硫酸 C、操作Ⅱ是蒸发浓缩、冷却结晶、过滤洗涤、干燥 D、溶液Z中的离子只有23. 根据表中信息判断,下列选项正确的是( )序号
反应物
产物
①
……
②
③
……
……
A、氧化性由强到弱的顺序为 B、第①组反应的其余产物只有 C、第②组反应中与的物质的量之比可能为 D、第③组反应中生成 , 转移电子24. 在水中溶解和电离的示意图如下图,下列叙述正确的是( ) A、氯化钠的电离过程没有能量变化 B、氯化钠分子在水中的电离方程式为: C、在外加电场作用下,氯化钠溶液中的水合钠离子向电源负极连接的电极移动 D、氯化钠在水中形成能够自由移动的水合钠离子
A、氯化钠的电离过程没有能量变化 B、氯化钠分子在水中的电离方程式为: C、在外加电场作用下,氯化钠溶液中的水合钠离子向电源负极连接的电极移动 D、氯化钠在水中形成能够自由移动的水合钠离子 和水合氯离子
和水合氯离子 25. 室温下进行下列实验,根据实验操作、现象和结论不正确的是( )
25. 室温下进行下列实验,根据实验操作、现象和结论不正确的是( )选项
实验操作和现象
实验目的或结论
A
将两小块的钠,分别投入盛有水和乙醇溶液的两个烧杯中,可观察到钠与乙醇的反应要缓和的多
乙醇羟基上的氢不如水中的活泼
B
向未知溶液中,加入盐酸酸化的硝酸钡溶液,有白色沉淀生成。
溶液中不一定存在硫酸根离子
C
将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明。
生成的无色1,二溴乙烷溶于
D
向碘化钾溶液中滴加几滴氯水溶液,再滴加淀粉溶液后变蓝色
的还原性比的强
A、A B、B C、C D、D二、填空题
-
26. 回答下列问题:(1)、写出正丁烷的结构简式:;(2)、胆矾晶体遇浓硫酸变白,体现了浓硫酸的性;(3)、写出铁和氯化铁溶液反应的离子方程式;(4)、根据所学的知识,试解释比热稳定性强的原因。
三、有机推断题
-
27. 有机物A的分子式为 , 其转化关系如图所示:

请回答:
(1)、有机物A的名称是 , D官能团的结构简式是;(2)、有机物C反应生成E的化学方程式是;(3)、下列说法正确的是_______。A.仅用溶液无法鉴别有机物
A、C和D B、等质量的A和E完全燃烧,消耗的的量相同 C、C和D都可以和发生反应 D、工业上可以利用乙烯与水的加成反应制取有机物C四、元素或物质推断题
-
28. 为探究X(仅含有两种短周期元素)的组成和性质,设计并完成如下实验。已知A为气体单质,液体B能使硫酸铜粉末变为蓝色。请回答:
 (1)、写出液体B的电子式;(2)、X的化学式是;(3)、写出金属C与 , 反应的化学方程式;(4)、写出E转化为F的离子方程式。
(1)、写出液体B的电子式;(2)、X的化学式是;(3)、写出金属C与 , 反应的化学方程式;(4)、写出E转化为F的离子方程式。五、实验题
-
29. 石墨烯铜复合材料的电导率高,韧性好,可用于制备高铁的“超级导线”。某化学小组用如下装置测定其中的碳含量(铜、碳以外的成分不与浓硫酸反应)。已知:实验前后,各通入一次 , 将装置中的气体全部赶入到U型管中。
 (1)、仪器B的名称为 , 装置D中的试剂为;(2)、碳与浓硫酸反应的化学方程式为;(3)、装置E和F中碱石灰的作用为;(4)、实验结束后,U型管(E)增重 , 则碳含量为;(5)、若撤去D,则实验测定的结果(填“偏高”“偏低”或“无影响”)。
(1)、仪器B的名称为 , 装置D中的试剂为;(2)、碳与浓硫酸反应的化学方程式为;(3)、装置E和F中碱石灰的作用为;(4)、实验结束后,U型管(E)增重 , 则碳含量为;(5)、若撤去D,则实验测定的结果(填“偏高”“偏低”或“无影响”)。六、填空题
-
30. 已知:。现将固体溶于水配成溶液,吸收空气管道中的 , 若管道中空气流量为 , 经过溶液恰好褪色。请计算:(1)、所用溶液的物质的量浓度;(2)、空气样品中的含量;(3)、若空气中的浓度不超过为合格,则上述空气质量(填“合格”或“不合格”)。
-
-
-
-