浙教版七升八科学专题(14)-溶解度和质量分数
试卷更新日期:2023-06-14 类型:同步测试
一、单选题
-
1. 在配制食盐溶液的过程中,下列操作既能改变食盐的溶解速度又能改变其溶解性的是( )A、搅拌 B、加水 C、加食盐 D、酒精灯加热2. 现对某物质A的不饱和溶液进行恒温蒸发,若蒸发10克水析出a克固体,若蒸发20克水析出b克固体,若蒸发30克水析出c克固体,则下列关系正确的是( )A、c=a+b B、c=2b-a C、c=2b+a D、2a+b3. 下列有关溶液知识的解释不正确的是( )A、饱和溶液析出晶体后,溶质的质量分数可能不变 B、“冬天捞碱,夏天晒盐”的主要原理是不同物质的溶解度随温度变化不同 C、不饱和溶液转化为饱和溶液,其溶质质量分数一定变大 D、使一杯接近饱和的硝酸钾溶液达到饱和可采用降温的方式4. 科学研究常用图像来表示两个量(x,y)之间的关系。以使研究的问题变得直观明了,下列两个量之间的关系不符合图示的是( )
 A、固体溶解度与温度的关系 B、物体受到的浮力与排开液体体积的关系 C、同种材料制成的实心物体,质量与体积的关系 D、一定温度下,某物质饱和溶液在哪个溶质质量与溶剂质量的关系5. 20℃时,四个实验小组分别取不同质量的NaCl,逐渐加入到各盛有10克水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表。下列叙述正确的是( )
A、固体溶解度与温度的关系 B、物体受到的浮力与排开液体体积的关系 C、同种材料制成的实心物体,质量与体积的关系 D、一定温度下,某物质饱和溶液在哪个溶质质量与溶剂质量的关系5. 20℃时,四个实验小组分别取不同质量的NaCl,逐渐加入到各盛有10克水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表。下列叙述正确的是( )实验序号
水的质量(g)
加入氯化钠的质量(g)
剩余氯化钠的质量(g)
①
10
2
0
②
10
3
0
③
10
4
0.4
④
10
5
1.4
A、 20℃时,10克NaCl饱和溶液中含有3.6克NaCl B、相同温度下,NaCl在水里的溶解度与水的质量有关 C、第四组所得溶液的溶质与溶剂的质量比为9∶25 D、20℃时,氯化钠的溶解度是366. 结合下表,下列有关溶解度的分析正确的是( )20℃时几种物质的溶解度如表:
物质名称
氯化钠
氢氧化钙
蔗糖
氯酸钾
硝酸钾
溶解度(克)
36.0
0.165
203.9
7.4
31.6
A、氯化钠属于易溶物质 B、20℃时,100克的水中溶解的硝酸钾质量是31.6克 C、20℃时,氢氧化钙的溶解度是0.165 D、溶解度越大,表明该温度下物质的溶解性越弱7. 物质M在不同温度下的溶解度数据如下表所示,以下说法正确的是( )温度℃
0
20
40
60
80
溶解度(g)
12.6
15.3
20.0
25.0
38.2
A、0℃时,15.9gM溶于150g水中形成饱和溶液 B、20℃时,M形成饱和溶液的溶质分数是15.3% C、若要配制200g20.0%的M的饱和溶液,对应温度必须是60℃ D、80℃时,M的饱和溶液138.2g降温至40℃,析出晶体的质量大于20.0g8. 现有质量分数为 15%的硝酸钾溶液,若使溶质的质量分数增大 1 倍,可采用的方法是( )A、将水蒸发掉一半 B、将硝酸钾的质量增大一倍 C、蒸发掉水的质量为原溶液质量的一半 D、溶质,溶剂的质量同时减少一半9. 常温下,在两个各盛有 100mL 水的烧杯中,分别加入相同质量的甲、乙两种物质,使其充分溶解,并 恢复到原温度,结果如图所示。下列说法中正确的是( ) A、该温度下的溶解度: 甲>乙 B、升高温度,剩余的甲固体继续溶解 C、甲溶液可能是饱和溶液 D、乙溶液可能是饱和溶液10. t℃时,根据某物质在不同质量的水中达到饱和状态时所溶解的质量绘制成图中的斜线。下列说法错误的是( )
A、该温度下的溶解度: 甲>乙 B、升高温度,剩余的甲固体继续溶解 C、甲溶液可能是饱和溶液 D、乙溶液可能是饱和溶液10. t℃时,根据某物质在不同质量的水中达到饱和状态时所溶解的质量绘制成图中的斜线。下列说法错误的是( ) A、t℃时该物质的溶解度为50g B、图中4个点表示的溶液中w和z是饱和溶液 C、点z向点w移动的一种方法是恒温蒸发一定量的水 D、将m点表示的溶液变为饱和溶液的一种方法是再加入20g溶质11. 实验室用固体氯化钠配制50g溶质质量分数为16%的氯化钠溶液。下列说法正确的是( )A、所需固体氯化钠的质量是8.0g B、固体氯化钠可以直接放在托盘天平的左盘上称量 C、溶解固体氯化钠时,用玻璃棒搅拌能增大氯化钠的溶解度 D、用量筒量取42mL水时,若仰视读数,会导致配制的溶液溶质质量分数偏大12. 下列叙述正确的是( )
A、t℃时该物质的溶解度为50g B、图中4个点表示的溶液中w和z是饱和溶液 C、点z向点w移动的一种方法是恒温蒸发一定量的水 D、将m点表示的溶液变为饱和溶液的一种方法是再加入20g溶质11. 实验室用固体氯化钠配制50g溶质质量分数为16%的氯化钠溶液。下列说法正确的是( )A、所需固体氯化钠的质量是8.0g B、固体氯化钠可以直接放在托盘天平的左盘上称量 C、溶解固体氯化钠时,用玻璃棒搅拌能增大氯化钠的溶解度 D、用量筒量取42mL水时,若仰视读数,会导致配制的溶液溶质质量分数偏大12. 下列叙述正确的是( )①饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液; ②蔗糖的溶解度是187克; ③20℃时,100克食盐溶液中含有10克食盐,所以20℃时食盐的溶解度是10克; ④20℃时,100克硫酸铜饱和溶液的质量分数一定比100克硫酸铜不饱和溶液的质量分数大
A、④ B、①③ C、② D、②④13. 如图是某品牌“一摇冰"功能饮料,该饮料罐在夏天能制冷,罐底中的固体是( )
 A、氢氧化钠 B、硝酸铵 C、氯化钠 D、蔗糖14. 如图所示,该装置的气密性良好,在左边烧杯中,放入下列哪一种物质后,会在右边导管口看见气泡冒出( )
A、氢氧化钠 B、硝酸铵 C、氯化钠 D、蔗糖14. 如图所示,该装置的气密性良好,在左边烧杯中,放入下列哪一种物质后,会在右边导管口看见气泡冒出( ) A、氯化钠 B、硝酸铵 C、蔗糖 D、氢氧化钠15. 下列氯化钠溶液的溶质质量分数不是15%的是( )A、100 g水中溶解15 g氯化钠 B、氯化钠与水按15∶85的质量比形成的溶液 C、100 g溶液中含15 g氯化钠 D、30 g氯化钠溶解于170 g水中所形成的溶液16. 一定温度下,向如图所示烧杯中加入一定质量的水,仅有部分晶体溶解。所得溶液与原溶液相比,说法正确的是( )
A、氯化钠 B、硝酸铵 C、蔗糖 D、氢氧化钠15. 下列氯化钠溶液的溶质质量分数不是15%的是( )A、100 g水中溶解15 g氯化钠 B、氯化钠与水按15∶85的质量比形成的溶液 C、100 g溶液中含15 g氯化钠 D、30 g氯化钠溶解于170 g水中所形成的溶液16. 一定温度下,向如图所示烧杯中加入一定质量的水,仅有部分晶体溶解。所得溶液与原溶液相比,说法正确的是( ) A、溶剂的质量增加,溶液颜色变浅 B、溶质溶解度不变,溶液颜色变深 C、溶质的质量增加,溶液颜色变深 D、溶质溶解度不变,溶液颜色不变17. 在一个大萝卜上挖一个孔,向其中注入饱和食盐水,一段时间后将食盐水倒出,在相同的温度下,向倒出的溶液中加入少量食盐,食盐全部溶解。此时的溶液与原饱和食盐水比较不变的是( )A、溶液质量 B、溶质质量 C、溶剂质量 D、食盐的溶解度18. 如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态。分析实验过程,判断下列说法正确的是( )
A、溶剂的质量增加,溶液颜色变浅 B、溶质溶解度不变,溶液颜色变深 C、溶质的质量增加,溶液颜色变深 D、溶质溶解度不变,溶液颜色不变17. 在一个大萝卜上挖一个孔,向其中注入饱和食盐水,一段时间后将食盐水倒出,在相同的温度下,向倒出的溶液中加入少量食盐,食盐全部溶解。此时的溶液与原饱和食盐水比较不变的是( )A、溶液质量 B、溶质质量 C、溶剂质量 D、食盐的溶解度18. 如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态。分析实验过程,判断下列说法正确的是( )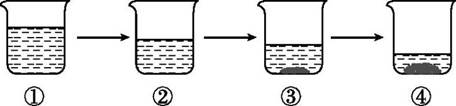 A、①→②过程中,氯化钠的质量分数保持不变 B、②→③过程中,氯化钠的溶解度不断增大 C、③→④过程中,水的质量分数不断增大 D、②→④过程中,氯化钠的质量分数先不变后增大19. 在一定的温度下,某物质的溶解度为S g,饱和溶液的溶质质量分数为A%,则S与A在数值上的关系是( )A、S=A B、S<A C、S>A D、无法确定20. 60℃时,硝酸钾的溶解度为110g,该温度下硝酸钾饱和溶液中有关质量关系正确的是( )A、 溶质质量∶溶剂质量=1∶10 B、溶剂质量∶溶液质量=20∶21 C、溶质质量∶溶剂质量=11∶10 D、溶液质量∶溶质质量=21∶1021. 下列有关氯化钠(NaCl)溶解度的说法,正确的是( )A、20℃时,18.0gNaCl溶解在50g水中达到饱和状态,故20℃时,NaCl的溶解度为18.0g B、36.0g NaCl溶解在100g水中达到饱和状态,NaCl的溶解度为36.0g C、20℃时,36.0gNaCl溶解在100g水中,故20℃时,NaCl的溶解度为36.0g D、20℃时,100g水中最多能溶解36.0gNaCl,故20℃时,NaCl的溶解度为36.0g22. 硫酸镁在工农业以及医疗上有广泛应用,其溶解度如下表所示。则下列说法正确的是( )
A、①→②过程中,氯化钠的质量分数保持不变 B、②→③过程中,氯化钠的溶解度不断增大 C、③→④过程中,水的质量分数不断增大 D、②→④过程中,氯化钠的质量分数先不变后增大19. 在一定的温度下,某物质的溶解度为S g,饱和溶液的溶质质量分数为A%,则S与A在数值上的关系是( )A、S=A B、S<A C、S>A D、无法确定20. 60℃时,硝酸钾的溶解度为110g,该温度下硝酸钾饱和溶液中有关质量关系正确的是( )A、 溶质质量∶溶剂质量=1∶10 B、溶剂质量∶溶液质量=20∶21 C、溶质质量∶溶剂质量=11∶10 D、溶液质量∶溶质质量=21∶1021. 下列有关氯化钠(NaCl)溶解度的说法,正确的是( )A、20℃时,18.0gNaCl溶解在50g水中达到饱和状态,故20℃时,NaCl的溶解度为18.0g B、36.0g NaCl溶解在100g水中达到饱和状态,NaCl的溶解度为36.0g C、20℃时,36.0gNaCl溶解在100g水中,故20℃时,NaCl的溶解度为36.0g D、20℃时,100g水中最多能溶解36.0gNaCl,故20℃时,NaCl的溶解度为36.0g22. 硫酸镁在工农业以及医疗上有广泛应用,其溶解度如下表所示。则下列说法正确的是( )温度/℃
10
30
50
75
90
溶解度/g
27.7
39.3
49.0
54.1
51.1
A、硫酸镁的溶解度随温度升高而减小 B、10 ℃时,27.7 g硫酸镁和72.3 g水可配制成100 g硫酸镁溶液 C、50 ℃时,100 g硫酸镁不饱和溶液中溶质和溶剂的质量比为49:100 D、75 ℃时,154.1 g硫酸镁饱和溶液升温至90 ℃,溶液析出3 g溶质23. 在一定温度下,若将某不饱和溶液蒸发15 g 水(部分)后,会析出2 g晶体(不含结晶水);若向原溶液投入5 g溶质晶体后,溶液中会剩下1 g固体溶质,则此温度下该溶质的溶解度为( )A、13.3 g B、26.7 g C、33.3 g D、40 g24. 如图所示,向100 g水中加入固体A(该物质的溶解能力随温度的升高而增大)或改变温度,得到相应的溶液①~⑤。下列说法正确的是( )25℃ 100g水
 ①(无固体剩余)
①(无固体剩余)  ②(剩余固体4.2g)
②(剩余固体4.2g)  ③(无固体剩余)
③(无固体剩余)  ④(无固体剩余)
④(无固体剩余)  ⑤(无固体剩余)A、只有②是饱和溶液 B、③⑤溶液组成完全一样 C、②④⑤的溶液为饱和溶液 D、①②一定饱和,⑤可能饱和25. 氢氧化钙的溶解能力随温度的升高而减弱。将一瓶接近饱和的石灰水变成饱和溶液,具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤恒温蒸发水。其中正确的是( )A、①②④ B、①③④ C、①③⑤ D、①②⑤
⑤(无固体剩余)A、只有②是饱和溶液 B、③⑤溶液组成完全一样 C、②④⑤的溶液为饱和溶液 D、①②一定饱和,⑤可能饱和25. 氢氧化钙的溶解能力随温度的升高而减弱。将一瓶接近饱和的石灰水变成饱和溶液,具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤恒温蒸发水。其中正确的是( )A、①②④ B、①③④ C、①③⑤ D、①②⑤二、填空题
-
26. 图甲、乙、丙三种固体物质的溶解度曲线,请回答下列问题.
 (1)、t1℃时,甲、乙、丙的溶解度由大到小的顺序是。(2)、P点的含义 。(3)、t3℃时,在150g水中加入100g甲,形成溶液的质量为 g。(4)、t2℃时,甲、乙、丙三种物质的饱和溶液升温至t3℃后,三种溶液的溶质质量分数由大到小的顺序是。27. t℃时,100g某硝酸钾溶液在恒温条件下经过如图所示的变化。
(1)、t1℃时,甲、乙、丙的溶解度由大到小的顺序是。(2)、P点的含义 。(3)、t3℃时,在150g水中加入100g甲,形成溶液的质量为 g。(4)、t2℃时,甲、乙、丙三种物质的饱和溶液升温至t3℃后,三种溶液的溶质质量分数由大到小的顺序是。27. t℃时,100g某硝酸钾溶液在恒温条件下经过如图所示的变化。 (1)、甲烧杯中的溶液是 溶液(选填“饱和”或“不饱和”)。(2)、甲、乙、丙、丁四个烧杯中溶液的溶质质量分数一定相等的是 。(3)、t℃时该物质的溶解度为 g。28. 溶液与人们的生产生活密切相关。
(1)、甲烧杯中的溶液是 溶液(选填“饱和”或“不饱和”)。(2)、甲、乙、丙、丁四个烧杯中溶液的溶质质量分数一定相等的是 。(3)、t℃时该物质的溶解度为 g。28. 溶液与人们的生产生活密切相关。 (1)、将少量下列物质分别放入水中,充分搅拌,可以得到无色溶液的是 (填字母)。A、食盐 B、硫酸铜 C、面粉 D、食用油(2)、在盛有水的烧杯中加入下列某种物质,在形成溶液过程中,温度没有明显变化的是 (填字母)。A、氢氧化钠 B、硝酸铵 C、氯化钠(3)、将80克M物质加入50克水中,充分溶解,测得溶液的质量随温度的变化曲线如图所示,则A点时,该溶液的溶质质量分数为。
(1)、将少量下列物质分别放入水中,充分搅拌,可以得到无色溶液的是 (填字母)。A、食盐 B、硫酸铜 C、面粉 D、食用油(2)、在盛有水的烧杯中加入下列某种物质,在形成溶液过程中,温度没有明显变化的是 (填字母)。A、氢氧化钠 B、硝酸铵 C、氯化钠(3)、将80克M物质加入50克水中,充分溶解,测得溶液的质量随温度的变化曲线如图所示,则A点时,该溶液的溶质质量分数为。三、实验探究题
-
29. 为了探究影响固体溶解性的因素,某小组同学设计并实施了如下三组实验:
因素
第一组
第二组
第三组
实验温度
20℃
20℃
20℃
20℃
80℃
加入溶剂种类
水
酒精
水
水
水
加入溶剂质量
20g
20g
10g
10g
10g
加入固体种类
硝酸钾
硝酸钾
硝酸钾
食盐
硝酸钾
加入固体质量
10g
10g
10g
10g
10g
溶解固体质量
6.2g
0g
3.1g
3.6g
10g
(1)、由上述实验可知,影响固体溶解性的因素是。(2)、在第二组实验中,该同学按照如下步骤进行实验(假设溶液损失不计):①用电子天平称取10.0g硝酸钾,放入烧杯中;
②量取10.0mL水,倒入上述烧杯中,称量烧杯、硝酸钾和水的总质量为m1g;
③搅拌至硝酸钾不再溶解为止;
④过滤,称量所得硝酸钾溶液和烧杯的总质量为m2g;
⑤计算:m1-m2=g(结合第二组实验数据进行分析)。将溶质改为食盐,重复上述步骤进行实验。由本实验可推知,20℃时食盐的溶解能力(填“>”“=”“<”)硝酸钾的溶解能力。
(3)、根据上述实验,以下推论正确的是 。A、20℃时,氯化钠的溶解度为36g B、20℃的任意一杯饱和硝酸钾溶液中,溶质与溶剂的质量比一定相等30. 硝酸钾是工业生产中一种重要原料,也是实验室里常见的一种药品。下表是60℃时,硝酸钾溶解于水的实验数据。图甲为其溶解度随温度变化的曲线,M点表示在60℃时硝酸钾饱和溶液的浓度,底部无固体残留。回答下列问题:实验序号
水的质量(克)
加入硝酸钾的质量(克)
溶液的质量(克)
①
10
4
14
②
10
8
18
③
10
12
21
④
20
25
m
(1)、根据实验①②③,计算第④次实验中,溶液质量m=克。(2)、20℃时,实验室把100g溶质质量分数为28%的硝酸钾溶液稀释成10%的硝酸钾溶液,需加水克?(3)、当条件改变时,溶液新的状态在图中对应的点的位置可能也随之变化,将M溶液升温10℃,请你在图甲坐标系上标出此时溶液浓度的对应点N。 31. 如图所示是三种物质的溶解度曲线。请回答下列问题。
31. 如图所示是三种物质的溶解度曲线。请回答下列问题。 (1)、溶解度随温度升高而降低的是;30 ℃时溶解度最大的是。(2)、80 ℃时硝酸钠饱和溶液的溶质质量分数为。使硝酸钠不饱和溶液变为饱和溶液,可采取的措施有(写一种)。(3)、某硝酸钾固体中混有少量硫酸铈杂质,分离提纯硝酸钾的操作是:配成高温下的硝酸钾饱和溶液、、过滤、洗涤、干燥。(4)、30 ℃时,用等质量的硝酸钾、硝酸钠配制两种物质的饱和溶液需要水的质量:硝酸钾(填“>”“<”或“=”)硝酸钠。(5)、配制一定溶质质量分数的硝酸钾溶液,以下操作中会导致所配制溶液的溶质质量分数偏小的是 (填字母)。A、用量筒量取水时仰视读数 B、配制好的溶液向细口瓶中转移时溅出 C、硝酸钾固体中含有杂质 D、烧杯事先用水润洗过,内壁有水
(1)、溶解度随温度升高而降低的是;30 ℃时溶解度最大的是。(2)、80 ℃时硝酸钠饱和溶液的溶质质量分数为。使硝酸钠不饱和溶液变为饱和溶液,可采取的措施有(写一种)。(3)、某硝酸钾固体中混有少量硫酸铈杂质,分离提纯硝酸钾的操作是:配成高温下的硝酸钾饱和溶液、、过滤、洗涤、干燥。(4)、30 ℃时,用等质量的硝酸钾、硝酸钠配制两种物质的饱和溶液需要水的质量:硝酸钾(填“>”“<”或“=”)硝酸钠。(5)、配制一定溶质质量分数的硝酸钾溶液,以下操作中会导致所配制溶液的溶质质量分数偏小的是 (填字母)。A、用量筒量取水时仰视读数 B、配制好的溶液向细口瓶中转移时溅出 C、硝酸钾固体中含有杂质 D、烧杯事先用水润洗过,内壁有水四、解答题
-
32. 某固体混合物中含有硝酸钾和不溶性杂质,把它们加入一定量的水中充分溶解,其结果 如下表:
温度( ℃)
10
40
65
75
剩余固体(克)
261
175
82
82
硝酸钾的溶解度见下表:
温度( ℃)
10
40
50
55
60
65
75
80
溶解度(克)
20.9
63.9
85.5
95
110
126
150
169
求:
(1)、10℃时, 硝酸钾的溶解度克(2)、所加水的质量;(3)、该固体混合物中硝酸钾的质量。33. 某兴趣小组用硝酸钾进行实验,下图甲是硝酸钾的溶解度与温度关系。 (1)、10℃时,100g水中最多可溶解硝酸钾的质量为g(2)、20℃时,将15g硝酸钾加入50g水中,所得溶液的溶质质量分数为(结果保留一位小数)(3)、请写出一种能实现如图乙所示结果的操作方法,并写出计算过程 (结果保留一位小数)34. 下表为硫酸密度与硫酸溶液中的溶质的质量分数对照表(20℃)有一物块A,其体积为500cm3 , 密度为1.30g/cm3。一只容器中盛有某硫酸溶液5千克,将物块A放入该溶液中静止后如图所示,此时物块A有2/15的体积露出液面。
(1)、10℃时,100g水中最多可溶解硝酸钾的质量为g(2)、20℃时,将15g硝酸钾加入50g水中,所得溶液的溶质质量分数为(结果保留一位小数)(3)、请写出一种能实现如图乙所示结果的操作方法,并写出计算过程 (结果保留一位小数)34. 下表为硫酸密度与硫酸溶液中的溶质的质量分数对照表(20℃)有一物块A,其体积为500cm3 , 密度为1.30g/cm3。一只容器中盛有某硫酸溶液5千克,将物块A放入该溶液中静止后如图所示,此时物块A有2/15的体积露出液面。
密度(g/mL)
1.01
1.07
1.14
1.22
1.30
1.40
1.50
1.61
1.73
1.81
1.84
质量分数(%)
1
10
20
30
40
50
60
70
80
90
98
(1)、求物块A静止时受到的浮力大小?(2)、求这种硫酸溶液的溶质质量分数是多少?(3)、要使物块A全部浸入溶液中,至少需要往容器中加水多少千克?(容器足够大,加水后溶液不溢出。)35. 在农业生产上往往用质量分数为18%的氯化钠溶液选种。现要配制该氯化钠溶液100 kg,需要氯化钠固体的质量多少?现有100克溶质质量分数为18%的氯化钠溶液,将它稀释成溶质质量分数为0.9%的盐水,需加水多少毫升?36. 如表是某学校实验室从化学试剂商店买回的硫酸试剂的标签上的部分内容,阅读后计算:(1)、欲配制600克溶质质量分数为19.6%的稀硫酸,需要这种浓硫酸多少毫升?再加水多少毫升?(2)、50毫升该硫酸与150毫升水混合后所得溶液的质量分数为多少?浓硫酸(H2SO4) 500毫升
浓度(质量分数)
98%
密度
1.84克/厘米2
相对分子质量
98
强腐蚀性,阴冷,密封贮藏
37. 某兴趣小组用硝酸钾进行了图甲所示的实验,硝酸钾溶解度与温度的关系如图乙。 (1)、①中未溶解的硝酸钾质量为克。(2)、②中硝酸钾溶液为(填“饱和”或“不饱和”)溶液。(3)、求②中溶液的溶质质量分数。
(1)、①中未溶解的硝酸钾质量为克。(2)、②中硝酸钾溶液为(填“饱和”或“不饱和”)溶液。(3)、求②中溶液的溶质质量分数。