江苏省南京市协同体七校2022-2023学年高一下学期期中化学试卷
试卷更新日期:2023-06-14 类型:期中考试
一、单选题
-
1. 化学与科技、社会、环境密切相关。下列有关说法不正确的是( )A、以高纯硅制成的光导纤维内窥镜可直接窥视有关器官部位的变化 B、汽车排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2 C、向煤中加入适量石灰石,使煤燃烧产生的SO2最终转化为CaSO4 , 可减少对大气的污染 D、在食品袋中放入盛硅胶的透气小袋,可防止食物因受潮而变质2. 据报道,上海某医院正在研究用放射性同位素治疗肿瘤。该同位素原子核外的电子数是( )A、125 B、72 C、53 D、1783. 下列物质中属于共价化合物的是( )A、 B、NaClO C、 D、NaOH
二、多选题
-
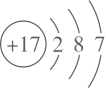
4. 反应2NH3+3Cl2=6HCl+N2 , NH3+HCl=NH4Cl(白烟)可用于氯气管道泄漏的检查。下列表示反应中的相关微粒的化学用语正确的是( )A、氯离子的结构示意图:
 B、HCl的电子式:
B、HCl的电子式: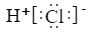 C、中子数为20的氯原子:
D、氮气的结构式:
C、中子数为20的氯原子:
D、氮气的结构式:
三、单选题
-
5. 下列现象或事实可用同一原理解释的是A、浓硫酸和浓盐酸长期暴露在空气中浓度降低 B、浓氨水遇浓盐酸、浓硝酸都产生白烟 C、SO2、漂白粉都能使品红溶液褪色 D、铜在冷的浓硫酸中和铝在冷的浓硝酸中都没有明显变化6. 常温下,下列各组离子在溶液中能大量共存的是( )A、、、 B、、、 C、、、 D、、、7. 下列物质的变化,不能通过一步化学反应完成的是( )A、 B、 C、 D、8. 下列有关物质的性质与用途具有对应关系的是( )A、具有氧化性,可用于漂白纸浆 B、CaO能与水反应,可用作食品干燥剂 C、氨气易溶于水,可用作制冷剂 D、浓硝酸具有酸性,可用于洗涤附有银镜的试管9. 下列除去杂质的操作方法正确的是( )A、NO中有少量的NO2:用水洗涤后再干燥 B、食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干 C、N2中有少量的O2:通过足量灼热的氧化铜 D、硝酸中溶有少量BaCl2 , 可向硝酸中加入适量硫酸溶液10. 下列装置用于进行指定实验时,能达到实验目的的是
 A、用装置甲制备氨气 B、用装置乙除去氨气中的水蒸气 C、用装置丙收集氨气 D、用装置丁吸收多余的氨气11. 下列反应的离子方程式书写正确的是( )A、氯气与氢氧化钠溶液反应: B、铁与过量的稀硝酸反应: C、在氨水中加盐酸: D、将氨水加入氯化铝溶液中:12. 已知某物质X能发生如下转化:
A、用装置甲制备氨气 B、用装置乙除去氨气中的水蒸气 C、用装置丙收集氨气 D、用装置丁吸收多余的氨气11. 下列反应的离子方程式书写正确的是( )A、氯气与氢氧化钠溶液反应: B、铁与过量的稀硝酸反应: C、在氨水中加盐酸: D、将氨水加入氯化铝溶液中:12. 已知某物质X能发生如下转化: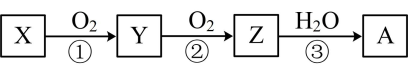
下列有关上述转化关系中物质及其反应的叙述错误的是( )
A、若X为 , 则A为硝酸 B、若X为S,则A为硫酸 C、反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应 D、若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y13. 有关反应的说法正确的是( )A、是还原剂 B、得到电子 C、是氧化剂 D、发生还原反应14. 下列有关反应说法错误的是( )A、升高温度,可加快反应速率 B、增大压强,可加快反应速率 C、达平衡时, D、达平衡时,不再改变15. 为放热反应,下列说法正确的是( )A、断开放出热量 B、吸热反应都需要加热 C、放热反应都不需要加热 D、反应物的总能量大于生成物的总能量16. 依据图中氮元素及其化合物的转化关系,判断下列说法不正确的是( ) A、X是N2O5 B、工业上以NH3、空气、水为原料生产硝酸 C、可用排空气法收集NO气体 D、由NH3→N2 , 从原理上看,NH3可与NO2反应实现17. 普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理、化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为。下列有关说法正确的是( )
A、X是N2O5 B、工业上以NH3、空气、水为原料生产硝酸 C、可用排空气法收集NO气体 D、由NH3→N2 , 从原理上看,NH3可与NO2反应实现17. 普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理、化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为。下列有关说法正确的是( ) A、负极的电极反应式为 B、测量原理示意图中,电子从电极经导线流向Cu C、电池工作时,向Cu电极移动 D、电池工作时,浓度增大18. 氨是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱、制药等工业。实验室用加热NH4Cl 和Ca(OH)2固体混合物的方法制取少量氨气。侯氏制碱法以氯化钠、二氧化碳、氨和水为原料,发生反应NaCl + NH3+CO2+H2O= NaHCO3↓+ NH4Cl。将析出的固体灼烧获取纯碱,向析出固体后的母液中加入食盐可获得副产品氯化铵。下列有关氨的说法不正确的是( )A、液氨可做制冷剂 B、NH3极易溶于水 C、NH3的水溶液能导电 D、氨催化氧化制硝酸是利用了NH3的氧化性19. 下列实验操作和现象得出的实验结论正确的是
A、负极的电极反应式为 B、测量原理示意图中,电子从电极经导线流向Cu C、电池工作时,向Cu电极移动 D、电池工作时,浓度增大18. 氨是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱、制药等工业。实验室用加热NH4Cl 和Ca(OH)2固体混合物的方法制取少量氨气。侯氏制碱法以氯化钠、二氧化碳、氨和水为原料,发生反应NaCl + NH3+CO2+H2O= NaHCO3↓+ NH4Cl。将析出的固体灼烧获取纯碱,向析出固体后的母液中加入食盐可获得副产品氯化铵。下列有关氨的说法不正确的是( )A、液氨可做制冷剂 B、NH3极易溶于水 C、NH3的水溶液能导电 D、氨催化氧化制硝酸是利用了NH3的氧化性19. 下列实验操作和现象得出的实验结论正确的是实验操作
实验现象
实验结论
A
将通入盛有2mL新制氯水的试管中
新制氯水褪色
有氧化性
B
常温下,将铁片、铜片分别插入浓硝酸中
铁无明显变化铜片剧烈反应
金属活动性:Cu>Fe
C
取少量待测液于试管中,加入浓NaOH溶液并加热,将一片湿润的红色石蕊试纸放在试管口
试纸变蓝
溶液中含有
D
取少量待测液于试管中,滴加几滴溶液
产生白色沉淀
溶液中含有
A、A B、B C、C D、D20. 含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( ) A、该过程中可得到化工产品 B、该工艺流程是除去煤燃烧时产生的 C、该过程中化合价发生改变的元素为Fe和S D、图中涉及的反应之一为
A、该过程中可得到化工产品 B、该工艺流程是除去煤燃烧时产生的 C、该过程中化合价发生改变的元素为Fe和S D、图中涉及的反应之一为四、填空题
-
21. 如图为某化学兴趣小组探究不同条件下化学能转变为电能的装置。请根据原电池原理回答问题:
 (1)、若电极a为Zn、电极b为Ag、电解质溶液为硝酸银,该原电池工作时,负极的电极反应式为 , 向极(填a或b)移动。(2)、若电极a为Fe、电极b为Ag、电解质溶液为浓硝酸,则Ag为 , (填正极或负极)外电路中电子流动方向。(用Fe、Ag表示)(3)、用反应,设计一个原电池。负极材料选用电解液为
(1)、若电极a为Zn、电极b为Ag、电解质溶液为硝酸银,该原电池工作时,负极的电极反应式为 , 向极(填a或b)移动。(2)、若电极a为Fe、电极b为Ag、电解质溶液为浓硝酸,则Ag为 , (填正极或负极)外电路中电子流动方向。(用Fe、Ag表示)(3)、用反应,设计一个原电池。负极材料选用电解液为五、工业流程题
-
22. 工业上由含铜废料(含有Cu、CuS、等)制备硝酸铜晶体的流程如下:
 (1)、“焙烧”在600℃时进行,写出CuS转化为CuO和的化学方程式:。(2)、写出“酸化”时发生的离子反应方程式。(3)、“淘洗”所用的溶液A可以是_______(填字母)。A、稀硫酸 B、浓硫酸 C、稀硝酸 D、浓硝酸(4)、“反应”这一步所用的试剂是20%和10% , 反应过程中无红棕色气体生成,该反应的化学方程式:。(5)、根据题图分析从“反应”所得溶液中析出的方法是。
(1)、“焙烧”在600℃时进行,写出CuS转化为CuO和的化学方程式:。(2)、写出“酸化”时发生的离子反应方程式。(3)、“淘洗”所用的溶液A可以是_______(填字母)。A、稀硫酸 B、浓硫酸 C、稀硝酸 D、浓硝酸(4)、“反应”这一步所用的试剂是20%和10% , 反应过程中无红棕色气体生成,该反应的化学方程式:。(5)、根据题图分析从“反应”所得溶液中析出的方法是。
六、实验题
-
23. 氮及其化合物在生产生活中有着广泛的应用,但同时随意排放氮的化合物也会造成环境污染问题。
Ⅰ.某研究性学习小组设计用如图所示实验装置(夹持仪器省略)制取干燥的氨气并验证具有还原性,请回答下列问题:
 (1)、实验室制备氨气有多种方法,现欲用与熟石灰反应制取 , 则该反应的化学方程式为。(2)、实验进行一段时间后,观察到加热的硬质玻璃管内黑色氧化铜粉末变为红色,盛无水的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的。则该反应的化学方程式为。(3)、Ⅱ.氨是工业生产硝酸的重要原料,请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:
(1)、实验室制备氨气有多种方法,现欲用与熟石灰反应制取 , 则该反应的化学方程式为。(2)、实验进行一段时间后,观察到加热的硬质玻璃管内黑色氧化铜粉末变为红色,盛无水的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的。则该反应的化学方程式为。(3)、Ⅱ.氨是工业生产硝酸的重要原料,请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:

氨气在“氧化炉”中被催化氧化为NO,反应的化学方程式为。(4)、为避免硝酸生产尾气中的氮氧化物污染环境,人们开发了溶液吸收、催化还原等尾气处理方法。前者使用具有碱性的纯碱溶液等吸收尾气,后者使用将氨氧化物还原为。①纯碱溶液吸收法。请以尾气中处理为例,写出该反应的离子方程式。
②氨转化法。已知氨恰好能将含NO和共的混合气体完全转化为 , 则混合气体中NO和的物质的量之比为。
(5)、Ⅲ.国家规定地下水中氮氧化物的排放标准不超过 , 可以用酸性硫酸亚铁溶液来吸收,反应原理为 。现测定某地下水脱硝过程中 的排放量:收集 排放的气体,缓慢通过 酸性 溶液(过量),充分反应,量取吸收气体后的溶液 置于锥形瓶中,用 酸性 溶液反应过量的 (还原产物为 ),消耗酸性 溶液的体积为 。
试通过计算分析地下水脱硝过程中氮氧化物的排放是否符合国家标准?。(写出计算过程)
-
-
-