湖北省部分省级示范高中2022-2023学年高一下学期期中测试化学试卷
试卷更新日期:2023-06-14 类型:期中考试
一、单选题
-
1. 下列叙述错误的是( )A、高纯度的硅用于制造芯片 B、硅在自然界主要以单质形式存在 C、碳纳米材料是一种新型无机非金属材料 D、二氧化硅可用来生产光导纤维2. 下列说法正确的是( )A、伴有能量变化的物质变化都是化学变化 B、废旧电池最好的处理方法是深埋入地下 C、雷雨发庄稼每步反应属于自然固氮 D、煤、石油属于化石能源3. 只用一种试剂将四种溶液区分开,这种试剂是( )A、溶液 B、溶液 C、溶液 D、溶液4. 现有以下几种措施:①煤燃烧前向煤中加适量生石灰;②少用原煤作燃料;③燃煤时鼓入足量空气;④开发清洁能源。其中能减少酸雨产生的措施是( )A、①②④ B、②③④ C、②③ D、②④5. 利用下列实验装置能达到实验目的的是( )



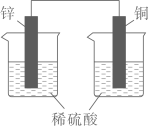
A.检验氨气极易溶于水
B.制取并干燥氨气
C.制取并收集二氧化硫
D.将化学能转化为电能
A、A B、B C、C D、D6. 下列关于C、N、、S等元素及其化合物的说法正确的是( )A、它们的单质都是非金属单质,都不能导电 B、浓硫酸可用于干燥等气体,但不能用于干燥氨气 C、四种元素的所有氧化物都是酸性氧化物 D、它们的最高价氧化物都能与强碱反应生成含氧酸盐7. 化学反应可用微观示意图形象化地表示。如图为处理汽车尾气中两种有毒气体(和)的微观示意图(未配平),其中不同颜色的球代表不同种原子。下列说法正确的是( ) A、甲和丙中同种元素化合价不可能相等 B、该反应属于置换反应 C、黄色球表示氮原子 D、乙物质被还原8. 在密闭系统中有反应能使反应速率增大的措施是( )
A、甲和丙中同种元素化合价不可能相等 B、该反应属于置换反应 C、黄色球表示氮原子 D、乙物质被还原8. 在密闭系统中有反应能使反应速率增大的措施是( )①恒容条件下分离出一氧化碳 ②升高温度 ③将炭粉碎 ④恒容条件下通入 ⑤增加炭的量
A、①②③④ B、②③④⑤ C、②③④ D、①②③④⑤9. 如图为中学化学教材上的喷泉实验装置。在烧瓶中充满了干燥气体,胶头滴管及烧杯中分别盛有液体,下列各组中能形成这样的喷泉但液体不能充满烧瓶的是( )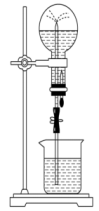 A、和氢氧化钠溶液 B、相同条件下体积比的的混合气体和 C、和 D、和饱和氯化钠溶液10. 在酸性溶液中,下列各组离子能大量共存的是( )A、 B、 C、 D、11. 吸热反应 , 若在恒容绝热的容器中发生,下列情况下能判断反应一定达到平衡状态的是( )A、容器内混合气体摩尔质量不再改变 B、容器内的压强不再改变 C、容器内各气体浓度相等时 D、断开键的同时断裂键12. 在一密闭容器中进行反应: , 已知反应过程中某一时刻的浓度分别为 , 当反应达到平衡时,可能存在的数据是( )A、为为 B、为 C、均为 D、为13. 的密闭容器中,充入和发生反应 , 经后B的浓度减少。对此反应的正确表示是( )A、用A表示的反应速率是 B、当 C、D浓度之比为时说明反应达平衡
A、和氢氧化钠溶液 B、相同条件下体积比的的混合气体和 C、和 D、和饱和氯化钠溶液10. 在酸性溶液中,下列各组离子能大量共存的是( )A、 B、 C、 D、11. 吸热反应 , 若在恒容绝热的容器中发生,下列情况下能判断反应一定达到平衡状态的是( )A、容器内混合气体摩尔质量不再改变 B、容器内的压强不再改变 C、容器内各气体浓度相等时 D、断开键的同时断裂键12. 在一密闭容器中进行反应: , 已知反应过程中某一时刻的浓度分别为 , 当反应达到平衡时,可能存在的数据是( )A、为为 B、为 C、均为 D、为13. 的密闭容器中,充入和发生反应 , 经后B的浓度减少。对此反应的正确表示是( )A、用A表示的反应速率是 B、当 C、D浓度之比为时说明反应达平衡C.反应时密闭容器中气体的总物质的量是
D、在末B的转化率:14. 二氧化碳用不同催化剂催化生成一氧化碳的历程中能量的转化如图所示(吸附在催化剂表面的用“·”表示),下列说法错误的是( ) A、从两种催化剂解吸为能量变化不同 B、经过还原反应得到 C、反应过程中存在极性键的断裂和生成 D、二氧化碳被催化剂吸附需吸热15. 如图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是( )
A、从两种催化剂解吸为能量变化不同 B、经过还原反应得到 C、反应过程中存在极性键的断裂和生成 D、二氧化碳被催化剂吸附需吸热15. 如图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是( )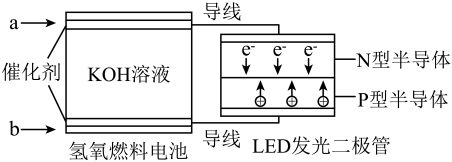 A、电极a上的气体物质发生还原反应 B、该装置中只涉及两种形式的能量转化 C、电池内向电极b定向移动 D、N型半导体连接的是电池正极
A、电极a上的气体物质发生还原反应 B、该装置中只涉及两种形式的能量转化 C、电池内向电极b定向移动 D、N型半导体连接的是电池正极二、填空题
-
16. 我国考古学家对“南澳一号”沉船进行了考古探索,从沉船中发现了大量宋代精美瓷器,体现了灿烂的中华文明。青花瓷胎体的原料——高岭土 , 可掺进瓷石制胎,青花瓷釉料的成分主要是钾长石 , 在左右一次烧成的釉可形成精美的青花瓷。(1)、求高岭土化学式中。(2)、硅酸盐可以改写成氧化物形式,如钾长石可写成 , 写出高岭土的氧化物形式。(3)、以高岭土为原料可以提取高纯度的二氧化硅,二氧化硅性质很稳定,但常温下可以溶于氢氧化钠溶液和氢氟酸,写出其溶于氢氟酸的化学方程式。(4)、与硅同周期的某元素的氧化物常温下是一种常见气体,足量的该气体依次通过A.品红溶液 B.高锰酸钾溶液 C.氢氧化钠溶液(滴有酚酞),发现三种溶液都褪色了,则该气体在三种溶液中表现的性质依次是:A;B;C。写出该气体与B溶液反应的离子方程式。
三、元素或物质推断题
-
17. 已知有如图所示转化关系(反应条件略)。已知:①X、Y、Z、W均为氧化物,M为单质。常温下,X是红棕色气体;Y能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲<乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:
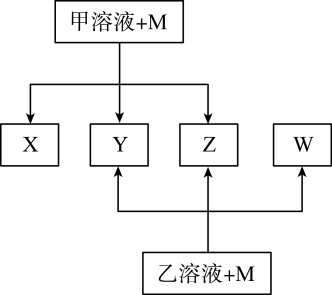 (1)、Z是(写分子式):。(2)、将甲的浓溶液露置在空气中一段时间,质量减小浓度降低,说明甲有性,甲的浓溶液盛放在棕色试剂瓶中,其原因是(用化学方程式表示)。(3)、在X与Z的反应中,被氧化的X与被还原的X的物质的量之比是。(4)、欲除去Y中混有的W,下列试剂可供选用的是___________。A、品红溶液 B、酸性高锰酸钾溶液 C、氢氧化钠溶液 D、饱和溶液(5)、工业上运输甲、乙两种浓溶液可选用(金属名称)金属材料的运输罐,所选用的金属能做运输罐的理由是。(6)、写出M与乙的浓溶液在加热条件下反应的化学方程式:。
(1)、Z是(写分子式):。(2)、将甲的浓溶液露置在空气中一段时间,质量减小浓度降低,说明甲有性,甲的浓溶液盛放在棕色试剂瓶中,其原因是(用化学方程式表示)。(3)、在X与Z的反应中,被氧化的X与被还原的X的物质的量之比是。(4)、欲除去Y中混有的W,下列试剂可供选用的是___________。A、品红溶液 B、酸性高锰酸钾溶液 C、氢氧化钠溶液 D、饱和溶液(5)、工业上运输甲、乙两种浓溶液可选用(金属名称)金属材料的运输罐,所选用的金属能做运输罐的理由是。(6)、写出M与乙的浓溶液在加热条件下反应的化学方程式:。四、实验题
-
18. Ⅰ.的收集和吸收:(1)、若用图甲装置,排空气法收集 , 气体应从口进入(选填“m”或“n”)。(2)、已知难溶于。图乙、丙、丁、戊四种装置中,能用来吸收的是。
 (3)、Ⅱ.某实验小组学习了 ,反应的相关知识后,欲探究镁是否与 气体反应,设计了下列实验装置图(注:石棉绒是一种耐火材料,不参与反应)。
(3)、Ⅱ.某实验小组学习了 ,反应的相关知识后,欲探究镁是否与 气体反应,设计了下列实验装置图(注:石棉绒是一种耐火材料,不参与反应)。

请回答下列问题:若可供选择的固体试剂有:木炭、铜片、亚硫酸钠固体。则装置A中发生反应的化学方程式为。(4)、装置B中所盛放的药品是(填名称),作用是。(5)、仪器a的名称是 , 装置D的作用是。(6)、实验完毕后观察到石棉绒上有黄色物质生成,将石棉绒及其附着物投入到稀盐酸中,会产生具有臭鸡蛋气味的气体,则镁与除了发生反应外,还发生的反应是。五、原理综合题
-
19. Ⅰ.化学反应中伴随着能量的变化。(1)、下列变化中属于吸热反应的是___________(填字母)
①液态水汽化 ②将胆矾加热变为白色粉末 ③苛性钠固体溶于水 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰 ⑥干冰升华
A、①② B、②④ C、③ D、①②④⑥(2)、断开键、键、键分别需要吸收的能量为 , 合成氨工业中生成时理论上能(填“吸收”或“放出”)能量。(3)、以为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图甲所示,则通入b气体的电极名称为 , 通入a气体的电极反应式为。(质子交换膜只允许通过) (4)、在一定温度和催化剂作用下,与可直接转化成乙酸,这是实现“减排”的一种研究方向。
(4)、在一定温度和催化剂作用下,与可直接转化成乙酸,这是实现“减排”的一种研究方向。①在不同温度下,催化剂的催化效率与乙酸的生成速率如图乙所示,则该反应的最佳温度应控制在左右。

②该反应催化剂的有效成分为偏铝酸亚铜( , 难溶物)。将溶解在稀硝酸中生成两种盐并放出气体,其离子方程式为。
(5)、 还原法是处理气体的一种方法。已知一定条件下与气体反应转化为和 , 若标准状况下可处理气体,则x值为。
-
-
-