【高考真题】2023年高考理综化学真题试卷(新课标卷)
试卷更新日期:2023-06-12 类型:高考真卷
一、单选题
-
1. 化学在文物的研究和修复中有重要作用。下列说法错误的是A、竹简的成分之一纤维素属于天然高分子 B、龟甲的成分之一羟基磷灰石属于无机物 C、古陶瓷修复所用的熟石膏,其成分为Ca(OH)2 D、古壁画颜料中所用的铁红,其成分为Fe2O32. 光学性能优良的高分子材料聚碳酸异山梨醇酯可由如下反应制备。

下列说法错误的是
A、该高分子材料可降解 B、异山梨醇分子中有3个手性碳 C、反应式中化合物X为甲醇 D、该聚合反应为缩聚反应3. 一种可吸附甲醇的材料,其化学式为 , 部分晶体结构如下图所示,其中为平面结构。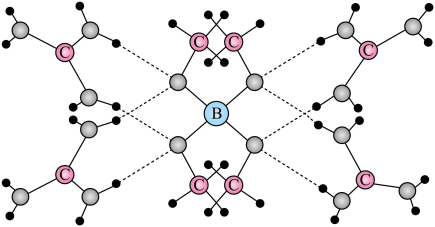
下列说法正确的是
A、该晶体中存在N-H…O氢键 B、基态原子的第一电离能: C、基态原子未成对电子数: D、晶体中B、N和O原子轨道的杂化类型相同4. 一种以和为电极、水溶液为电解质的电池,其示意图如下所示。放电时,可插入层间形成。下列说法错误的是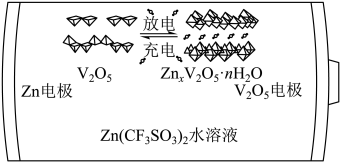 A、放电时为正极 B、放电时由负极向正极迁移 C、充电总反应: D、充电阳极反应:5. 根据实验操作及现象,下列结论中正确的是
A、放电时为正极 B、放电时由负极向正极迁移 C、充电总反应: D、充电阳极反应:5. 根据实验操作及现象,下列结论中正确的是选项
实验操作及现象
结论
常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象
稀硝酸的氧化性比浓硝酸强
取一定量样品,溶解后加入溶液,产生白色沉淀。加入浓 , 仍有沉淀
此样品中含有
将银和溶液与铜和溶液组成原电池。连通后银表面有银白色金属沉积,铜电极附近溶液逐渐变蓝
的金属性比强
向溴水中加入苯,振荡后静置,水层颜色变浅
溴与苯发生了加成反应
A、A B、B C、C D、D6. “肼合成酶”以其中的配合物为催化中心,可将与转化为肼(),其反应历程如下所示。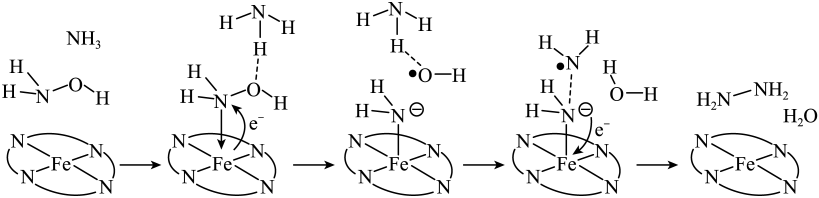
下列说法错误的是
A、、和均为极性分子 B、反应涉及、键断裂和键生成 C、催化中心的被氧化为 , 后又被还原为 D、将替换为 , 反应可得7. 向饱和溶液(有足量固体)中滴加氨水,发生反应和 , 与的关系如下图所示(其中M代表、、或)。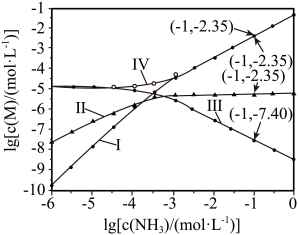
下列说法错误的是
A、曲线I可视为溶解度随浓度变化曲线 B、的溶度积常数 C、反应的平衡常数K的值为 D、时,溶液中二、工业流程题
-
8. 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:

已知:最高价铬酸根在酸性介质中以存在,在碱性介质中以存在。
回答下列问题:
(1)、煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为(填化学式)。(2)、水浸渣中主要有和。(3)、“沉淀”步骤调到弱碱性,主要除去的杂质是。(4)、“除硅磷”步骤中,使硅、磷分别以和的形式沉淀,该步需要控制溶液的以达到最好的除杂效果,若时,会导致;时,会导致。(5)、“分离钒”步骤中,将溶液调到1.8左右得到沉淀,在时,溶解为或在碱性条件下,溶解为或 , 上述性质说明具有_______(填标号)。A、酸性 B、碱性 C、两性(6)、“还原”步骤中加入焦亚硫酸钠()溶液,反应的离子方程式为。三、实验题
-
9. 实验室由安息香制备二苯乙二酮的反应式如下:
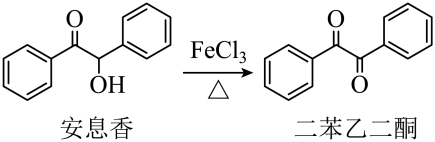
相关信息列表如下:
物质
性状
熔点/℃
沸点/℃
溶解性
安息香
白色固体
133
344
难溶于冷水
溶于热水、乙醇、乙酸
二苯乙二酮
淡黄色固体
95
347
不溶于水
溶于乙醇、苯、乙酸
冰乙酸
无色液体
17
118
与水、乙醇互溶
装置示意图如下图所示,实验步骤为:
①在圆底烧瓶中加入冰乙酸、水及 , 边搅拌边加热,至固体全部溶解。
②停止加热,待沸腾平息后加入安息香,加热回流。
③加入水,煮沸后冷却,有黄色固体析出。
④过滤,并用冷水洗涤固体3次,得到粗品。
⑤粗品用的乙醇重结晶,干燥后得淡黄色结晶。
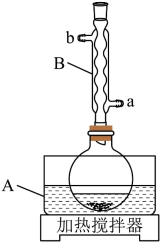
回答下列问题:
(1)、仪器A中应加入(填“水”或“油”)作为热传导介质。(2)、仪器B的名称是;冷却水应从(填“a”或“b”)口通入。(3)、实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是。(4)、在本实验中,为氧化剂且过量,其还原产物为;某同学尝试改进本实验:采用催化量的并通入空气制备二苯乙二酮。该方案是否可行?简述判断理由。(5)、本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是防止。(6)、若粗品中混有少量未氧化的安息香,可用少量洗涤的方法除去(填标号)。若要得到更高纯度的产品,可用重结晶的方法进一步提纯。a.热水 b.乙酸 c.冷水 d.乙醇
(7)、本实验的产率最接近于(填标号)。a. b. c. d.
四、原理综合题
-
10. 氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:(1)、根据图1数据计算反应的。
 (2)、研究表明,合成氨反应在催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,表示被吸附于催化剂表面的)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为(填步骤前的标号),理由是。(3)、合成氨催化剂前驱体(主要成分为)使用前经还原,生成包裹的。已知属于立方晶系,晶胞参数 , 密度为 , 则晶胞中含有的原子数为(列出计算式,阿伏加德罗常数的值为)。(4)、在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为 , 另一种为。(物质i的摩尔分数:)
(2)、研究表明,合成氨反应在催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,表示被吸附于催化剂表面的)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为(填步骤前的标号),理由是。(3)、合成氨催化剂前驱体(主要成分为)使用前经还原,生成包裹的。已知属于立方晶系,晶胞参数 , 密度为 , 则晶胞中含有的原子数为(列出计算式,阿伏加德罗常数的值为)。(4)、在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为 , 另一种为。(物质i的摩尔分数:)
①图中压强由小到大的顺序为 , 判断的依据是。
②进料组成中含有情性气体的图是。
③图3中,当、时,氮气的转化率。该温度时,反应的平衡常数(化为最简式)。
五、有机推断题
-
11. 莫西赛利(化合物K)是一种治疗脑血管疾病的药物,可改善脑梗塞或脑出血后遗症等症状。以下为其合成路线之一。
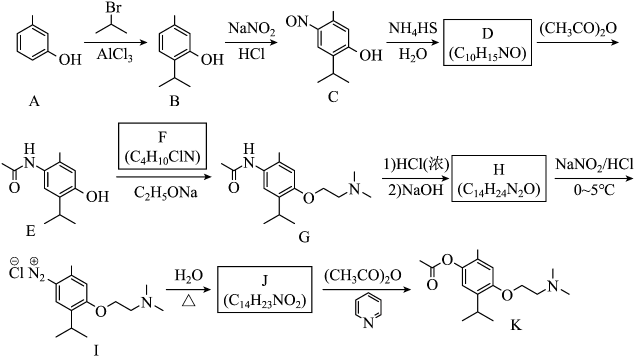
回答下列问题:
(1)、A的化学名称是。(2)、C中碳原子的轨道杂化类型有种。(3)、D中官能团的名称为、。(4)、E与F反应生成G的反应类型为。(5)、F的结构简式为。(6)、I转变为J的化学方程式为。(7)、在B的同分异构体中,同时满足下列条件的共有种(不考虑立体异构);①含有手性碳;②含有三个甲基;③含有苯环。
其中,核磁共振氢谱显示为6组峰,且峰面积比为的同分异构体的结构简式为。
-
-
-