北京市延庆区2023年中考一模化学试题
试卷更新日期:2023-06-08 类型:中考模拟
一、单选题
-
1. 垃圾分类人人有责。桔子皮属于( )A、可回收物 B、厨余垃圾 C、其他垃圾 D、有害垃圾2. 一些食物的pH范围如下,其中酸性最强的是( )A、橘子汁(3-4) B、西瓜汁(5-6) C、牛奶(6~7) D、鸡蛋清(7~8)3. 下列人体所必需的元素中,缺乏会引起骨质疏松的是()A、铁 B、钙 C、碘 D、锌4. 下列化学式表示的物质是某化学肥料的主要成分,其中属于氮肥的是( )A、K2CO3 B、NH4NO3 C、Ca(H2PO4)2 D、K3PO45. 汽车中部分构件的材料如下,其中属于有机合成材料的是( )A、气缸体——生铁 B、车体——特殊钢 C、发动机——铝合金 D、轮胎——合成橡胶6. 铜可用于制造传统的炭火锅,下列性质与此用途无关的是( )
 A、熔点高 B、导热性好 C、延展性好 D、导电性好7. 生产生活中离不开能源。下列属于新型能源的是( )A、煤 B、石油 C、氢气 D、天然气8. 赤铁矿(主要成分是Fe2O3)用于工业炼铁。Fe2O3中铁元素的化合价为( )A、-3 B、-2 C、+2 D、+39. 下列做法不正确的是( )A、不慎将燃着的酒精灯碰倒,立即用湿布盖灭 B、家用电器着火,立即切断电源 C、天然气泄漏,立即关闭阀门并开窗通风 D、将鼻孔凑到容器口,闻药品的气味10. 空气成分中,体积分数约占78%的是( )
A、熔点高 B、导热性好 C、延展性好 D、导电性好7. 生产生活中离不开能源。下列属于新型能源的是( )A、煤 B、石油 C、氢气 D、天然气8. 赤铁矿(主要成分是Fe2O3)用于工业炼铁。Fe2O3中铁元素的化合价为( )A、-3 B、-2 C、+2 D、+39. 下列做法不正确的是( )A、不慎将燃着的酒精灯碰倒,立即用湿布盖灭 B、家用电器着火,立即切断电源 C、天然气泄漏,立即关闭阀门并开窗通风 D、将鼻孔凑到容器口,闻药品的气味10. 空气成分中,体积分数约占78%的是( )
A、氮气 B、氧气 C、二氧化碳 D、稀有气体11. 下列符号中,能表示两个氧分子的是( )A、2O B、2O2 C、O2 D、O2-12. 布洛芬(中文别名异丁苯丙酸)的分子式是C13H18O2 , 是一种常用的解热镇痛类非处方药,具有抗炎、镇痛、解热作用。下列说法正确的是( )A、1个布洛芬分子中共含有33个原子 B、布洛芬从物质的分类上属于混合物 C、布洛芬中碳、氢元素的质量比为13:18 D、布洛芬中氢元素的质量分数最大13. 如图所示的图标表示( ) A、禁止吸烟 B、禁止燃放鞭炮 C、禁止带火种 D、禁止堆放易燃物14. 下列食品富含蛋白质的是( )A、鸡蛋
A、禁止吸烟 B、禁止燃放鞭炮 C、禁止带火种 D、禁止堆放易燃物14. 下列食品富含蛋白质的是( )A、鸡蛋 B、米饭
B、米饭 C、苹果
C、苹果 D、西红柿
D、西红柿 15. 下列实验操作正确的是( )A、给液体加热
15. 下列实验操作正确的是( )A、给液体加热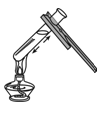 B、倾倒液体
B、倾倒液体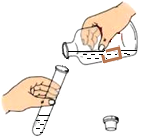 C、检查气密性
C、检查气密性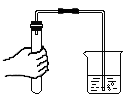 D、稀释浓硫酸
D、稀释浓硫酸 16. 中国古代文明与技术,促进了世界文明发展。下列古代工艺主要发生化学变化的是( )A、活字印刷 B、海水晒盐 C、彩陶烧制 D、机杼织布17. 电解水实验如图所示。下列说法不正确的是( )
16. 中国古代文明与技术,促进了世界文明发展。下列古代工艺主要发生化学变化的是( )A、活字印刷 B、海水晒盐 C、彩陶烧制 D、机杼织布17. 电解水实验如图所示。下列说法不正确的是( ) A、试管甲中的气体是氢气 B、试管乙中的气体能使带火星的木条复燃 C、正负两极产生气体的体积比为2:1 D、该实验说明水由氢、氧两种元素组成18. 下列物质敞口放置,质量会减少的是( )A、氧化钙 B、氢氧化钠 C、浓硫酸 D、浓盐酸19. 用下图装置可验证空气中氧气的含量。下列现象能表明氧气含量的是( )
A、试管甲中的气体是氢气 B、试管乙中的气体能使带火星的木条复燃 C、正负两极产生气体的体积比为2:1 D、该实验说明水由氢、氧两种元素组成18. 下列物质敞口放置,质量会减少的是( )A、氧化钙 B、氢氧化钠 C、浓硫酸 D、浓盐酸19. 用下图装置可验证空气中氧气的含量。下列现象能表明氧气含量的是( ) A、集气瓶中产生大量白烟 B、红磷燃烧一段时间后熄灭 C、烧杯中的水倒吸进入集气瓶 D、集气瓶中水面最终上升至 2 处20. 如图是元素周期表中金元素的信息,下列说法不正确的是( )
A、集气瓶中产生大量白烟 B、红磷燃烧一段时间后熄灭 C、烧杯中的水倒吸进入集气瓶 D、集气瓶中水面最终上升至 2 处20. 如图是元素周期表中金元素的信息,下列说法不正确的是( ) A、质子数为79 B、金的相对原子质量是197.0g C、原子核外有79个电子 D、金元素属于金属元素21. 下列化学方程式书写正确的是( )A、2Fe + O22FeO B、Fe+H2SO4=FeSO4+H2↑ C、Fe2O3 +HCl=FeCl3 + H2O D、Fe2O3+3CO=2Fe+3CO222. 下列实验操作不能达到相应目的的是( )
A、质子数为79 B、金的相对原子质量是197.0g C、原子核外有79个电子 D、金元素属于金属元素21. 下列化学方程式书写正确的是( )A、2Fe + O22FeO B、Fe+H2SO4=FeSO4+H2↑ C、Fe2O3 +HCl=FeCl3 + H2O D、Fe2O3+3CO=2Fe+3CO222. 下列实验操作不能达到相应目的的是( )A
B
C
D
 验证质量守恒定律
验证质量守恒定律 比较铜和黄铜的硬度
比较铜和黄铜的硬度 检验鸡蛋壳和白醋反应是否生成CO2
检验鸡蛋壳和白醋反应是否生成CO2 证明分子在不断运动A、A B、B C、C D、D23. 天宫课堂“点水成冰”实验中用到了醋酸钠。20℃时按下表配制溶液,完成下面小题。
证明分子在不断运动A、A B、B C、C D、D23. 天宫课堂“点水成冰”实验中用到了醋酸钠。20℃时按下表配制溶液,完成下面小题。已知:20℃时醋酸钠溶解度为124g,60℃时,醋酸钠溶解度为140g。
序号
①
②
③
④
醋酸钠的质量/g
100
120
140
160
水的质量/g
100
100
100
100
(1)、所得溶液中为饱和溶液的是( )A、① B、①② C、③④ D、④(2)、下列说法不正确的是( )A、①中溶质质量分数为50% B、②中溶液质量为220g C、③中溶质和溶剂的质量比为7:5 D、④中溶液升温至60℃,溶质质量分数增大24. 为了探究铁制品锈蚀的条件,小明用普通铁钉,纯铁钉同时进行如图的四组实验,一段时间后只有实验Ⅰ中观察到了锈斑,其他均无明显变化。下列说法正确的是( ) A、Ⅰ和Ⅱ说明铁制品锈蚀需要水 B、Ⅰ和Ⅲ说明铁制品锈蚀需要O2 C、Ⅰ和Ⅳ说明铁制品锈蚀跟铁制品内部结构有关 D、通过以上实验证明,要防止铁生锈,必须同时隔绝氧气和水
A、Ⅰ和Ⅱ说明铁制品锈蚀需要水 B、Ⅰ和Ⅲ说明铁制品锈蚀需要O2 C、Ⅰ和Ⅳ说明铁制品锈蚀跟铁制品内部结构有关 D、通过以上实验证明,要防止铁生锈,必须同时隔绝氧气和水二、生活现象解释
-
25. 从A或B两题中任选一个作答,若两题均作答,按A计分。
A
B
将物质与对应俗称连线

3%的过氧化氢溶液可用于伤口消毒。①H2O2属于 (填“纯净物”或“混合物”)。
②H2O2中氢元素与氧元素的质量比为。
26. 2023年3月22日是第三十一届“世界水日”,我国的活动主题为“强化依法治水 携手共护母亲河”。北京是极度缺水的城市。(1)、下列做法与节约用水、防治水污染相符的是____(填字母符号)A、将园林的漫灌改为喷灌、滴灌 B、加强工业废水的排放监控,保证达标排放 C、合理使用农药、化肥,以减少水体污染(2)、2023年4月1日,我国将实施《生活饮用水卫生标准》(GB5749-2022)①净水时常用活性炭除去水中的色素和异味,说明其具有性。
②家庭中常用的方法降低水硬度。
(3)、冷凝是从空气中取水的方法。水由气态变为液态,其分子间隔 (填“变小”或“变大”)。27. 空间站中水、氧气等是循环使用的。应用“萨巴蒂尔反应器”进行反应的微观示意图如下,请在方框中补全另一种产物的微粒图示。 (1)、请在方框中补全另一种生成物的微粒图示。(2)、该反应的另一个优点是解决了(填物质名称或化学式)的消除。
(1)、请在方框中补全另一种生成物的微粒图示。(2)、该反应的另一个优点是解决了(填物质名称或化学式)的消除。三、科普阅读题
-
28. 阅读下面科普短文。
大豆异黄酮(C15H10O4),浅黄色粉末,气味微苦,略有涩味,是大豆生长中形成的一类次生代谢产物,是一种植物雌激素,可以影响到激素分泌、代谢生物学活性、蛋白质合成、生长因子活性,是天然的癌症化学预防剂。
豆腐中含异黄酮27.74毫克,其干物质含异黄酮200毫克以上。点浆是制作豆腐的关键工序。点浆时常用到的凝固剂有盐类凝固剂,如石膏(主要成分为硫酸钙)或盐卤(如氯化镁等);酸类凝固剂,如葡萄糖酸―δ―内酯(化学式为 C6H10O6 , 简称 GdL)。
凝固剂种类对豆腐中异黄酮含量有影响。二者的关系如图1所示。
凝固剂添加量对豆腐的品质也有影响。将大豆泡发后,与水按1:4的比例磨成豆浆,以MgCl2为例,研究结果如图2所示。


豆腐中还含有丰富的蛋白质和钙,不含胆固醇,容易消化吸收。但过量食用,会阻碍人体对铁的吸收,而且容易出现腹胀、腹泻等症状。
依据文章内容回答下列问题。
(1)、大豆异黄酮的物理性质有 (写出一条即可)。(2)、大豆异黄酮中碳元素的质量分数计算式为。(3)、由图1可知,用凝固剂制作的豆腐异黄酮含量最高。(4)、判断下列说法是否正确(填“对”或“错”)。①MgCl2添加的越多,豆腐的保水性越好。
②豆腐营养丰富,多吃对身体无害。
(5)、由图2可知,豆腐产率与MgCl2添加量的关系为:其他条件相同时,MgCl2添加量在0.35%~0.71%之间时, 。四、生产实际分析
-
29. 氟化工产品生产过程中产生的副产品盐酸可制备氯化钙,其主要工艺流程如下图所示。
 (1)、化灰池中发生的反应还广泛用于自热食品,因为该反应过程。(填“吸热”或“放热”)(2)、写出中和锅中发生反应的化学方程式。(3)、上述流程中,用于分离的设备有。30. 以黄铁矿(主要成分为FeS2)为原料生产硫酸的工艺流程如下图。
(1)、化灰池中发生的反应还广泛用于自热食品,因为该反应过程。(填“吸热”或“放热”)(2)、写出中和锅中发生反应的化学方程式。(3)、上述流程中,用于分离的设备有。30. 以黄铁矿(主要成分为FeS2)为原料生产硫酸的工艺流程如下图。 (1)、黄铁矿进入沸腾炉之前需要粉碎,目的是。(2)、流程中涉及的氧化物有(写出两种)。(3)、接触室中发生化合反应,反应过程中化合价改变的元素有 (填元素符号)。
(1)、黄铁矿进入沸腾炉之前需要粉碎,目的是。(2)、流程中涉及的氧化物有(写出两种)。(3)、接触室中发生化合反应,反应过程中化合价改变的元素有 (填元素符号)。五、基本实验及其原理分析
-
31. 根据下图实验回答问题。
 (1)、实验室用甲装置制O2 , 发生反应的化学方程式为。(2)、关于甲的实验操作,下列说法正确的是____。A、先检查装置的气密性,再装药品 B、导气管口有气泡产生,开始用集气瓶收集气体 C、实验结束后,先熄灭酒精灯,再将导管移出水槽(3)、乙中的现象为:木炭燃烧,。32. 用如图装置进行实验。
(1)、实验室用甲装置制O2 , 发生反应的化学方程式为。(2)、关于甲的实验操作,下列说法正确的是____。A、先检查装置的气密性,再装药品 B、导气管口有气泡产生,开始用集气瓶收集气体 C、实验结束后,先熄灭酒精灯,再将导管移出水槽(3)、乙中的现象为:木炭燃烧,。32. 用如图装置进行实验。 (1)、Y型管左侧反应的化学方程式为;右侧可观察到澄清石灰水变浑浊。(2)、为验证CO2与水反应等性质,可以在C处放有(填“湿润”或“干燥”)的紫色石蕊试纸,可依据的现象是。(3)、该实验还可得出CO2度比空气大,证据是 。33. 从下图选择仪器,配制100 g溶质质量分数为16%的NaCl溶液。
(1)、Y型管左侧反应的化学方程式为;右侧可观察到澄清石灰水变浑浊。(2)、为验证CO2与水反应等性质,可以在C处放有(填“湿润”或“干燥”)的紫色石蕊试纸,可依据的现象是。(3)、该实验还可得出CO2度比空气大,证据是 。33. 从下图选择仪器,配制100 g溶质质量分数为16%的NaCl溶液。 (1)、需要称量NaCl的质量为 g。(2)、还缺少的仪器有(写名称)。34. 用下图装置研究酸、碱、盐、金属的性质。
(1)、需要称量NaCl的质量为 g。(2)、还缺少的仪器有(写名称)。34. 用下图装置研究酸、碱、盐、金属的性质。
 (1)、A中发生反应的化学方程式为。(2)、有气体产生的试管为(填序号)。(3)、D中证明发生了化学反应的现象为。(4)、为验证铁、铜、银的金属活动性顺序,X为 (填化学式或名称)溶液。35. 用如图装置探究可燃物燃烧的条件。(已知着火点:白磷40℃,红磷240℃)
(1)、A中发生反应的化学方程式为。(2)、有气体产生的试管为(填序号)。(3)、D中证明发生了化学反应的现象为。(4)、为验证铁、铜、银的金属活动性顺序,X为 (填化学式或名称)溶液。35. 用如图装置探究可燃物燃烧的条件。(已知着火点:白磷40℃,红磷240℃) (1)、对比铜片上白磷燃烧、红磷不燃烧的现象,可知可燃物燃烧的条件之一是。(2)、要使烧杯中的白磷燃烧,可采用的操作是____(填序号)。A、将80℃水加热至90℃ B、将白磷从80℃水中取出 C、将导管对准烧杯中的白磷,通入氧气
(1)、对比铜片上白磷燃烧、红磷不燃烧的现象,可知可燃物燃烧的条件之一是。(2)、要使烧杯中的白磷燃烧,可采用的操作是____(填序号)。A、将80℃水加热至90℃ B、将白磷从80℃水中取出 C、将导管对准烧杯中的白磷,通入氧气六、科学探究题
-
36. 实验小组同学对维C泡腾片非常感兴趣。把一颗维C泡腾片药片丢入水中,发现药片表面产生大量的气泡。
【查阅资料】维C泡腾片是一种较新的药物剂型,主要成分有:维生素C(C4H6O6)、碳酸氢钠(NaHCO3)、柠檬酸(C6H8O7)等。
维生素C主要增强机体抵抗力,用于预防和治疗坏血病。温度超过80℃被破坏。
探究1:维C泡腾片水溶液酸碱性
(1)、【进行实验一】取1mL溶液于试管中,滴加2滴紫色石蕊溶液,发现溶液变红,说明泡腾片与水发生反应后,溶液显性。
(2)、探究2:反应产生的气体是什么?【提出猜想】该气体可能是CO2、CO、O2、H2和N2中的一种或几种
小明认真思考后认为:从药品安全角度考虑,排除了CO和H2;从元素守恒角度考虑,产生的气体也不可能是N2 , 因为。
(3)、【进行实验二】实验序号
实验操作
实验现象
实验结论
实验①
操作1
澄清石灰水变浑浊
气体中含有CO2
实验②

带火星的木条不燃烧
气体中不含有O2
补全实验报告:操作1。
(4)、实验②中足量的氢氧化钠溶液是为了排除干扰,发生反应的化学方程式为。(5)、探究3:温度、泡腾片的形状对产生气体速率的影响【进行实验三】将泡腾片与50mL水混合,利用压强传感器测量从0s至60s时增大的压强值。
实验序号
泡腾片的数目
泡腾片的形状
温度/℃
60s时增大的压强值/kPa
①
4
每颗切成4等份
25
10.67
②
4
每颗切成4等份
37
18.75
③
4
每颗研碎成粉末
37
23.58
④
6
每颗切成4等份
25
13.86
⑤
6
每颗研碎成粉末
25
20.57
⑥
6
每颗研碎成粉末
37
25.46
【解释与结论】
探究泡腾片形状会影响产生气体的速率的实验是(填实验序号)。
(6)、通过对比实验①、②或⑤、⑥,得出的结论是。(7)、【结论与反思】通过实验,你对维C泡腾片的保存或使用注意事项等提出一项建议。
七、实际应用定量计算
-
37. 尿素是一种重要的化肥。工业上制备尿素的反应方程式如下:2NH3+ CO2CO(NH2)2+H2O,计算理论上生产120 kg尿素需要的二氧化碳的质量。
-
-