北京市西城区2023年中考一模化学试题
试卷更新日期:2023-06-08 类型:中考模拟
一、单选题
-
1. 空气中体积分数约占78%的是( )A、氮气 B、氧气 C、稀有气体 D、二氧化碳2. 下列物质能用作氮肥的是( )A、NH4NO3 B、K2SO4 C、KCl D、Ca(H2PO4)23. 垃圾分类是建设生态文明的重要措施。废弃旧报纸属于( )A、厨余垃圾 B、可回收物 C、有害垃圾 D、其他垃圾4. 下列食品的生产过程中,没有发生化学变化的是( )A、高粱酿酒 B、大米酿醋 C、海水晒盐 D、黄豆酿酱油5. 下列现象中,不属于铁丝在氧气中燃烧的是( )A、蓝色火焰 B、火星四射 C、放出热量 D、生成黑色固体6. 下列仪器中不可直接加热的是( )A、试管 B、烧杯 C、燃烧匙 D、蒸发皿7. 下列实验操作正确的是( )A、点燃酒精灯
 B、倾倒液体
B、倾倒液体 C、加热液体
C、加热液体 D、取固体粉末
D、取固体粉末 8. 下列药品应粘贴如图标志的是( )
8. 下列药品应粘贴如图标志的是( ) A、镁条 B、酒精 C、浓硫酸 D、高锰酸钾9. 下列物质常用于改良酸性土壤的是( )A、食盐 B、烧碱 C、熟石灰 D、硫酸铜10. 氢元素与氧元素的本质区别是( )A、质子数不同 B、中子数不同 C、核外电子数不同 D、最外层电子数不同11. 甲烷裂解是制备碳纳米管的重要步骤,反应前后微观粒子种类变化的示意图如下。
A、镁条 B、酒精 C、浓硫酸 D、高锰酸钾9. 下列物质常用于改良酸性土壤的是( )A、食盐 B、烧碱 C、熟石灰 D、硫酸铜10. 氢元素与氧元素的本质区别是( )A、质子数不同 B、中子数不同 C、核外电子数不同 D、最外层电子数不同11. 甲烷裂解是制备碳纳米管的重要步骤,反应前后微观粒子种类变化的示意图如下。
下列有关说法正确的是( )
A、该反应属于置换反应 B、反应中甲和丙的分子个数比为1:1 C、生成物均为单质 D、生成乙和丙的质量比为6:112. 水的存在可促进碳纳米管的生长,科学实验中常需对水进行净化。下列说法正确的是( )A、过滤可降低水的硬度 B、过滤是净化程度最高的操作 C、蒸馏过程中水分子种类发生改变 D、蒸馏主要利用了物质间沸点的差异13. 二氧化碳是碳纳米管纯化的重要辅助试剂。下列不属于二氧化碳用途的是( )A、扑灭火灾 B、用作燃料 C、人工降雨 D、气体肥料14. 下列物质不属于化石燃料的是( )A、石油 B、煤 C、天然气 D、酒精15. 下列化学用语的含义正确的是( )A、H — 1个氢元素 B、H2 — 1个氢分子 C、H+ — 1个氢原子 D、— 1个氢离子16. 利用如图装置可电解水制取氢气。下列说法正确的是( ) A、a管内产生的是氢气 B、与b管连接的是电源正极 C、水是由氢气和氧气组成的 D、生成H2和O2的质量比为1:817. 光电材料吸收光产生电流能分解水。在吸收相同光照的条件下,二氧化硅薄膜中嵌入纳米镍(Ni)后,电流增大,产生氢气的速率加快。下列有关说法正确的是( )
A、a管内产生的是氢气 B、与b管连接的是电源正极 C、水是由氢气和氧气组成的 D、生成H2和O2的质量比为1:817. 光电材料吸收光产生电流能分解水。在吸收相同光照的条件下,二氧化硅薄膜中嵌入纳米镍(Ni)后,电流增大,产生氢气的速率加快。下列有关说法正确的是( )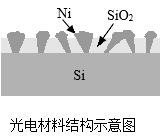 A、二氧化硅属于混合物 B、该材料可将电能转化为光能 C、纳米镍可提高二氧化硅薄膜的电阻 D、硅元素在地壳中的含量优势是其能用于光电材料的原因之一18. 铜元素在元素周期表中的信息如图。下列有关铜元素的说法不正确的是( )
A、二氧化硅属于混合物 B、该材料可将电能转化为光能 C、纳米镍可提高二氧化硅薄膜的电阻 D、硅元素在地壳中的含量优势是其能用于光电材料的原因之一18. 铜元素在元素周期表中的信息如图。下列有关铜元素的说法不正确的是( ) A、元素符号是Cu B、质子数是29 C、相对原子质量63.55 g D、属于金属元素19. 白癜风患者在治疗过程中需要补铜,这里的“铜”指的是( )A、单质 B、元素 C、分子 D、原子20. 几种矿石的主要成分如下,可用于冶炼铜的矿石是( )A、菱铁矿(FeCO3) B、软锰矿(MnO2) C、方铅矿(PbS) D、孔雀石[Cu2(OH)2CO3]21. 下列铜制品主要利用其化学性质的是( )A、导线
A、元素符号是Cu B、质子数是29 C、相对原子质量63.55 g D、属于金属元素19. 白癜风患者在治疗过程中需要补铜,这里的“铜”指的是( )A、单质 B、元素 C、分子 D、原子20. 几种矿石的主要成分如下,可用于冶炼铜的矿石是( )A、菱铁矿(FeCO3) B、软锰矿(MnO2) C、方铅矿(PbS) D、孔雀石[Cu2(OH)2CO3]21. 下列铜制品主要利用其化学性质的是( )A、导线 B、火锅
B、火锅 C、耐酸阀门
C、耐酸阀门 D、乐器
D、乐器 22. BTTAA(C19H30N10O2)是铜基催化剂的重要组成物质,下列关于BTTAA说法不正确的是( )A、由4种元素组成 B、由61个原子构成 C、氢、氧元素质量比为15:16 D、氮元素的质量分数计算式为23. 下列实验操作能达到实验目的的是( )
22. BTTAA(C19H30N10O2)是铜基催化剂的重要组成物质,下列关于BTTAA说法不正确的是( )A、由4种元素组成 B、由61个原子构成 C、氢、氧元素质量比为15:16 D、氮元素的质量分数计算式为23. 下列实验操作能达到实验目的的是( )实验目的
实验操作
A
鉴别生石灰和熟石灰
取样,加入少量水
B
鉴别二氧化碳和氮气两瓶气体
将燃着的木条分别伸入集气瓶中
C
除去氯化钠固体中少量碳酸钠
加入过量稀硫酸
D
除去氧气中的水蒸气
通过过量稀硫酸
A、A B、B C、C D、D24. 如图为硫酸锌的溶解度曲线,下列说法正确的是( ) A、20 ℃时,向100 g水中加入60 g硫酸锌,得到160 g溶液 B、30 ℃时,硫酸锌饱和溶液中溶质的质量分数为60% C、将80 ℃的硫酸锌饱和溶液降温至60 ℃,溶液仍饱和 D、60 ℃的硫酸锌饱和溶液,无论升温或降温,均会有固体析出25. 探究浓硫酸稀释操作中浓硫酸和水的注入顺序对实验的影响,实验装置如图1,两个实验分别测得的温度变化如图2。沿漏斗缓慢加入等量液体后,观察到实验2中的湿润紫色石蕊纸条比实验1有更多红色斑点。下列有关分析不合理的是( )
A、20 ℃时,向100 g水中加入60 g硫酸锌,得到160 g溶液 B、30 ℃时,硫酸锌饱和溶液中溶质的质量分数为60% C、将80 ℃的硫酸锌饱和溶液降温至60 ℃,溶液仍饱和 D、60 ℃的硫酸锌饱和溶液,无论升温或降温,均会有固体析出25. 探究浓硫酸稀释操作中浓硫酸和水的注入顺序对实验的影响,实验装置如图1,两个实验分别测得的温度变化如图2。沿漏斗缓慢加入等量液体后,观察到实验2中的湿润紫色石蕊纸条比实验1有更多红色斑点。下列有关分析不合理的是( ) A、石蕊纸条变为红色说明硫酸易挥发 B、实验2可能更易造成酸液飞溅 C、0~30 s内,实验1比实验2放热缓慢 D、实验1的操作是浓硫酸注入水中
A、石蕊纸条变为红色说明硫酸易挥发 B、实验2可能更易造成酸液飞溅 C、0~30 s内,实验1比实验2放热缓慢 D、实验1的操作是浓硫酸注入水中二、生活现象解释
-
26. 从A或B两题中任选一个作答,若两题均作答,按A计分。
A 硝酸钾溶液的溶质是。
B 碳酸钙的主要用途是(写1条即可)。
27. “健康中国2030”规划提出推进“优质植物蛋白为主,优质动物蛋白为辅”的中国特色双蛋白工程。(1)、如图是某品牌牛奶的营养成分表,其中含量最高的营养素是____(填序号)。营养成分表
项目
每100 mL
能量
280 kJ
蛋白质
3.2 g
脂肪
3.8 g
碳水化合物
5.0 g
钠
53 mg
钙
100 mg
A、蛋白质 B、油脂 C、糖类 D、无机盐(2)、实验室常用浓硝酸(HNO3)鉴别蛋白质。硝酸中氮元素的化合价为。28. 战国时期脱碳窑遗迹的发现证明了我国古代冶铁技术的高超水平。(1)、赤铁矿(主要成分为Fe2O3)与CO在高温条件下反应的化学方程式为。高炉炼铁的尾气中含有多种可燃性气体,其中甲烷充分燃烧的化学方程式为。(2)、结合生活经验,提出一条防止铁制品生锈的措施:。29. 随着人们对生活品质的要求日益提高,室内空气质量受到越来越多的关注。 (1)、空气净化器内装填有活性炭。活性炭的主要作用是。(2)、家具和装修材料会释放有害物质甲醛(HCHO),光触媒可促进甲醛和氧气反应,生成水和X两种物质。关于X的组成说法正确的是____(填序号)。A、只有碳元素 B、一定有碳、氢元素 C、一定有碳、氧元素 D、一定有碳、氢、氧元素
(1)、空气净化器内装填有活性炭。活性炭的主要作用是。(2)、家具和装修材料会释放有害物质甲醛(HCHO),光触媒可促进甲醛和氧气反应,生成水和X两种物质。关于X的组成说法正确的是____(填序号)。A、只有碳元素 B、一定有碳、氢元素 C、一定有碳、氧元素 D、一定有碳、氢、氧元素三、科普阅读题
-
30. 阅读下面科普短文。
《中国气候变化蓝皮书(2022)》指出,全球变暖趋势仍在继续。减少CO2排放,实现碳中和迫在眉睫。
碳循环是实现碳中和的重要途径之一,研究人员提出通过促进人为碳循环实现碳中和的方法,如图1。首先,将太阳能转化为电能,用于电解水制得氢气,像这样利用可再生能源制得的氢气称为绿色氢气。然后,在催化剂的作用下,将捕捉的CO2与氢气反应制得甲醇(CH3OH)等化工产品。
开发高效、稳定的催化剂对实现上述人为碳循环至关重要。研究人员使用两种催化剂,探究了影响CO2与H2制备甲醇反应效果的因素。反应效果可用甲醇的选择性衡量,数值越大反应效果越好,结果如图2。


实现碳中和人人有责,让我们从日常点滴做起,低碳生活。
依据文章内容回答下列问题。
(1)、绿色氢气是指。(2)、补全化学方程式:CO2 + 3H2CH3OH +[]。(3)、由图1可知,捕捉的CO2来源于(写1条即可)。(4)、由图2可知:Ⅰ、①⑤⑨组实验的目的是。
II、制备甲醇反应效果与温度的关系是。
Ⅲ、实验研究的多个因素中,对反应效果影响最大的是。
四、生产实际分析
-
31. 用闪锌矿(主要成分为ZnS)制备金属锌的主要过程如下图。

资料:Zn的熔点为419.5 ℃,沸点为907 ℃。
(1)、ZnS属于____(填序号)。A、单质 B、化合物 C、氧化物 D、酸(2)、Ⅱ中发生反应的化学方程式:ZnO + C Zn↑ + CO↑,其中化合价变化的元素有。(3)、Ⅲ中从混合气中获得固体Zn的条件是。32. 用工业废弃氯化钠,实现纯碱联产的主要工艺流程如下图。 (1)、化盐桶中,加快水的循环速度的目的是。(2)、反应釜中,发生的反应属于基本反应类型中的反应。(3)、整个流程中,只发生物理变化的设备有。
(1)、化盐桶中,加快水的循环速度的目的是。(2)、反应釜中,发生的反应属于基本反应类型中的反应。(3)、整个流程中,只发生物理变化的设备有。五、基本实验及其原理分析
-
33. 根据下图所示实验回答问题。
 (1)、加热KMnO4制取O2的化学方程式为。(2)、收集O2的装置是(填序号),验满的操作是。34. 室温下,三支试管中分别盛有饱和石灰水,进行如下图所示实验。
(1)、加热KMnO4制取O2的化学方程式为。(2)、收集O2的装置是(填序号),验满的操作是。34. 室温下,三支试管中分别盛有饱和石灰水,进行如下图所示实验。 (1)、①中反应的化学方程式为。(2)、②中的实验现象是。(3)、③中溶液变浑浊,析出的固体是。35. 根据下表所示实验回答问题。已知:白磷着火点为40 ℃。
(1)、①中反应的化学方程式为。(2)、②中的实验现象是。(3)、③中溶液变浑浊,析出的固体是。35. 根据下表所示实验回答问题。已知:白磷着火点为40 ℃。实验1 配制40 g 5%的过氧化氢溶液
实验2 验证可燃物燃烧条件
可供选择的仪器:

 (1)、实验1:计算可知,需要6 mL 30%的H2O2溶液和33 mL水。配制过程中不需要的仪器是。(2)、实验2:
(1)、实验1:计算可知,需要6 mL 30%的H2O2溶液和33 mL水。配制过程中不需要的仪器是。(2)、实验2:①H2O2溶液与MnO2接触,反应的化学方程式为。
②能证明可燃物燃烧需要与氧气接触的实验现象是。
36. 用下图所示实验研究金属的性质。 (1)、实验1:
(1)、实验1:Ⅰ、④中反应的化学方程式为。
Ⅱ、①中有气泡产生。下列实验组合中,能得出镍、铜、银的金属活动性顺序的有(填序号)。
A.①③④ B.①②③ C.①④ D.②④
(2)、实验2:一段时间后,铁丝生锈,试管中液面上升。“液面上升”的原因是。37. 对比是实验探究的重要方法。(1)、实验1,向4个烧杯的液体中分别加入固体,充分溶解后,现象如下图所示。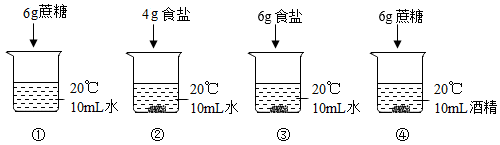
Ⅰ、对比①和④可得到的结论是。
Ⅱ、能比较出食盐和蔗糖溶解性强弱的实验组有(填序号,写全对比组)。
(2)、实验2,已知:通常情况下,1体积的水约能溶解1体积的CO2。
Ⅰ、为证明CO2与NaOH发生反应补充了实验⑥,观察到⑥中气球变鼓的程度小于⑤。⑥中集气瓶里应加入。
Ⅱ、写出CO2与NaOH发生反应的化学方程式。
六、科学探究题
-
38. 胃酸过多会引起不适,不同病症需要服用不同的抗酸药。实验小组同学对抗酸药选择进行探究。
【查阅资料】
①抗酸药主要利用有效成分与胃液中的过量盐酸反应,药品用量一般为1~2片(约0.5 g~1 g)。
②氧化镁和氧化铁均属于金属氧化物,与盐酸反应的原理相似。
③胃蛋白酶是胃中唯一的消化性蛋白酶,当pH为3~5时活性较好,当pH超过6时,因变性而失去活性。
④理想抗酸药应具备起效快速,避免产生气体刺激溃疡面等特点。
【进行实验】
I、是否引起胃内压强的变化
锥形瓶中模拟胃酸过多的环境。将气球中的抗酸药加入锥形瓶中、
装置及药品
序号
抗酸药
现象

1-1
氢氧化铝片
气球无明显变化
1-2
碳酸氢钠片
气球明显膨胀
1-3
铝碳酸镁咀嚼片
气球无明显变化
1-4
氧化镁粉末
气球无明显变化
II、是否引起胃内温度和pH的变化
利用图1进行实验。向4个烧瓶中分别加入抗酸药,打开恒压滴液漏斗,滴加0.37%的足量稀盐酸。传感器测得的相关结果见图2、3、4。




【解释与结论】
(1)、碳酸氢钠的俗称是。(2)、I中,1-1发生反应的化学方程式为。(3)、药品用量在1~2片内,针对“严重胃溃疡患者”不建议选用的抗酸药及理由是。(4)、下列关于氧化镁粉末、氢氧化铝片分别与盐酸反应的叙述正确的是____(填序号)。A、氧化镁粉末的反应会引起温度上升 B、反应后溶液均显碱性 C、氢氧化铝片的反应更快 D、均有水生成(5)、由上述实验可知,铝碳酸镁咀嚼片的优势有。(6)、【反思与评价】查阅资料发现I中实验1-3无明显现象是与物质的用量有关。小明同学设计实验证明了铝碳酸镁咀嚼片中含有碳酸根离子,实验操作和现象:取6片铝碳酸镁咀嚼片于试管中,。
七、实际应用定量计算
-
39. 锂及其化合物在新能源、航天航空等领域应用广泛。从盐湖中提取锂盐的化学方程式为2LiCl + Na2CO3=Li2CO3↓+ 2NaCl。若制得74 kg Li2CO3 , 计算参加反应的LiCl的质量(写出计算过程及结果)。
-
-