广东省深圳市龙岗区2023年4月多校联考化学试题
试卷更新日期:2023-06-08 类型:中考模拟
一、单选题
-
1. 化学与生活密切相关,下列实验或应用中是化学变化的是( )




A.水油分离
B.氢气燃烧
C.冰灯熔化
D.石油的分馏
A、A B、B C、C D、D2. 学好化学能促进人的全面发展。下列项目所涉化学知识不正确的是( )选项
项目
化学知识
A
“德”:废旧电池分类投放
废旧电池中的重金属会污染环境
B
“体”:剧烈运动后喝淡盐水
补充人体所需无机盐
C
“美”:紫色石蕊溶液遇食醋溶液变红,遇炉具清洁剂变蓝
紫色石蕊溶液在不同pH环境中显色不同
D
“劳”:小苏打发面,蒸馒头
碳酸钠分解产生二氧化碳使面团松软
A、A B、B C、C D、D3. 用浓硫酸配制一定浓度的稀硫酸并制取氢气,下列实验操作不正确的是( )A、 量取
B、
量取
B、 稀释
C、
稀释
C、 产生H2
D、
产生H2
D、 收集H2
4. 化学用语是学习和研究化学的工具。下列表达正确的是( )A、3个氧原子:O3 B、铵根离子: C、硫酸铝的化学式:AlSO4 D、单质钙中钙元素的化合价:5. 北斗三号卫星采用了铷原子钟,使时间更精准。铷元素化元素周期表的相关信息和原子结构示意图如图所示。下列有关铷的说法正确的是( )
收集H2
4. 化学用语是学习和研究化学的工具。下列表达正确的是( )A、3个氧原子:O3 B、铵根离子: C、硫酸铝的化学式:AlSO4 D、单质钙中钙元素的化合价:5. 北斗三号卫星采用了铷原子钟,使时间更精准。铷元素化元素周期表的相关信息和原子结构示意图如图所示。下列有关铷的说法正确的是( ) A、铷原子的中子数为37 B、铷的原子质量为85.47 C、铷元素位于元素周期表中第五周期 D、铷的氧化物的化学式RbO6. 《本草纲目》记载:“三七近时始出,南人军中,用为金疮要药,云有奇功”。三七中止血的活性成分主要是田七氨酸(C5H8N2O5),下列说法正确的是( )A、田七氨酸是由四种元素组成的有机物 B、田七氨酸中含一个N2分子 C、田七氨酸中氢元素的质量分数最大 D、田七氨酸中碳、氢、氮、氧元素的质量比为5:8:2:57. 中国芯片蚀刻技术国际领先。NF3进行硅芯片蚀刻时的产物均为气体,在蚀刻物表面不留任何残留物。该反应微观示意图如下,下列说法正确的是( )
A、铷原子的中子数为37 B、铷的原子质量为85.47 C、铷元素位于元素周期表中第五周期 D、铷的氧化物的化学式RbO6. 《本草纲目》记载:“三七近时始出,南人军中,用为金疮要药,云有奇功”。三七中止血的活性成分主要是田七氨酸(C5H8N2O5),下列说法正确的是( )A、田七氨酸是由四种元素组成的有机物 B、田七氨酸中含一个N2分子 C、田七氨酸中氢元素的质量分数最大 D、田七氨酸中碳、氢、氮、氧元素的质量比为5:8:2:57. 中国芯片蚀刻技术国际领先。NF3进行硅芯片蚀刻时的产物均为气体,在蚀刻物表面不留任何残留物。该反应微观示意图如下,下列说法正确的是( ) A、上述四种物质均由分子构成 B、反应前后分子、原子的种类和数目均不变 C、反应生成的丙和丁微粒数之比为3:2 D、空气中物质丁的质量分数为78%8. 某汽车尾气中可能含有H2、CO和CO2中的一种或几种,为检验其成分,小深同学按下图装置进行实验时,观察到黑色固体变红,澄清石灰水变浑浊,由此实验现象得出汽车尾气的组成情况。下列说法错误的是( )
A、上述四种物质均由分子构成 B、反应前后分子、原子的种类和数目均不变 C、反应生成的丙和丁微粒数之比为3:2 D、空气中物质丁的质量分数为78%8. 某汽车尾气中可能含有H2、CO和CO2中的一种或几种,为检验其成分,小深同学按下图装置进行实验时,观察到黑色固体变红,澄清石灰水变浑浊,由此实验现象得出汽车尾气的组成情况。下列说法错误的是( )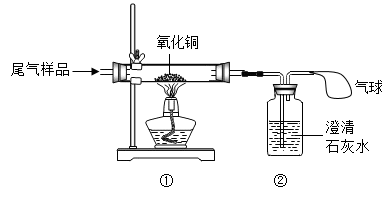 A、该汽车尾气可能有5种情况 B、装置①中的反应一定是置换反应 C、②处的反应为 D、尾部的气球可以用燃着的酒精灯代替9. 表格所示的实验操作、现象与结论对应关系正确的是( )
A、该汽车尾气可能有5种情况 B、装置①中的反应一定是置换反应 C、②处的反应为 D、尾部的气球可以用燃着的酒精灯代替9. 表格所示的实验操作、现象与结论对应关系正确的是( )实验操作

 (改为溶液不没过铁钉)
(改为溶液不没过铁钉)

现象
溶液变红
Ⅱ中铁钉锈蚀更严重
Ⅱ中快速产生气泡
滴有石蕊的溶液呈蓝色,加入稀盐酸后蓝色变为红色
结论
X一定是CO2
盐溶液会加快金属锈蚀
MnO2能增加O2产量
反应后的溶液中一定含碱性物质
选项
A
B
C
D
A、A B、B C、C D、D10. 下列实验方案不能达到实验目的的是( )实验目的
实验方案
A
除去H2中的CO2
将混合气体依次通过盛有足量NaOH溶液和浓硫酸的洗气瓶
B
检验散口放置在空气中的NaOH溶液是否变质
取样,滴加BaCl2溶液
C
鉴别NaOH、NaCl、NH4NO3三种白色固体
取样,分别加水溶解
D
验证金属活动性Al>Cu>Ag
将除去氧化膜的Al丝分别浸入Cu(NO3)2溶液和AgNO3溶液中
A、A B、B C、C D、D11. 下列图像不能正确反映对应变化关系的是( )A、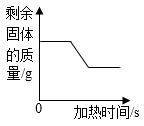 加热高锰酸钾制取氧气过程中剩余固体的质量
B、
加热高锰酸钾制取氧气过程中剩余固体的质量
B、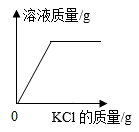 一定温度下,向接近饱和的氯化钾溶液中加入氯化钾固体
C、
一定温度下,向接近饱和的氯化钾溶液中加入氯化钾固体
C、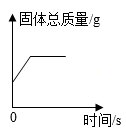 在密闭容器中用足量红磷燃烧测定空气中氧气的含量
D、
在密闭容器中用足量红磷燃烧测定空气中氧气的含量
D、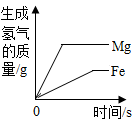 向等质量的铁粉和镁粉中分别加入足量的稀盐酸
12. 某同学设计了“化学消消乐”游戏,点击灰色格,与该格中物质能反应的相邻物质就一起消失。点击下图灰色格,剩余物质最少的是( )A、
向等质量的铁粉和镁粉中分别加入足量的稀盐酸
12. 某同学设计了“化学消消乐”游戏,点击灰色格,与该格中物质能反应的相邻物质就一起消失。点击下图灰色格,剩余物质最少的是( )A、 B、
B、 C、
C、 D、
D、
二、非选择题
-
13. 掌握实验室制取气体的一般思路和方法是化学学习的必备能力。请根据如图所示装置回答问题。
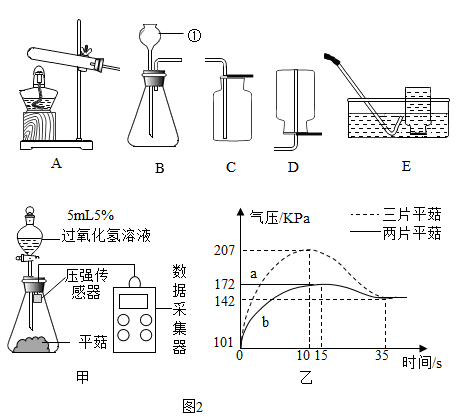 (1)、写出装置B中仪器①的名称。(2)、实验室制取的二氧化碳,应选择的发生和收集装置是(填字母),发生反应的化学方程式是。(3)、实验小组用图2中的甲装置研究浓度为5%的过氧化氢溶液与平菇接触时发生的化学反应,用传感器测定装置中压强的变化并用数据采集器记录数据如图2中乙所示。
(1)、写出装置B中仪器①的名称。(2)、实验室制取的二氧化碳,应选择的发生和收集装置是(填字母),发生反应的化学方程式是。(3)、实验小组用图2中的甲装置研究浓度为5%的过氧化氢溶液与平菇接触时发生的化学反应,用传感器测定装置中压强的变化并用数据采集器记录数据如图2中乙所示。①写出实验甲装置的化学方程式:。
②结合实验甲和乙图的曲线a、b,影响化学反应速率的因素是。
14. 纯碱是一种重要的化工原料,广泛用于玻璃、造纸、纺织和洗涤剂的生产。某化学兴趣小组对纯碱的制备、性质及用途等开展项目式学习。(1)、任务一了解纯碱的制备一一“侯氏制碱法”“侯氏制碱法”主要化学原理是利用饱和氯化钠溶液吸收两种气体,生成碳酸氢钠和氯化铵,再加热碳酸氢钠即可制得纯碱。
纯碱属于(填“酸”“碱”或“盐”)。(2)、任务二探究纯碱的性质——Na2CO3溶液呈碱性
【查阅资料】①溶液呈碱性,是因为溶液中存在较多的OH-。②Na2CO3在水中全部解离出Na+和。
③CaCl2溶液呈中性,Ca2+、Cl-对溶液的酸碱性没有影响。
【提出猜想】猜想一:H2O单独起作用,产生较多的OH- , 使溶液呈碱性。
猜想二:Na+与H2O作用,产生较多的OH- , 使溶液呈碱性。
猜想三:和H2O作用,产生较多的OH- , 使溶液呈碱性。
【实验探究】
实验操作
实验现象
实验结论
A.向试管中加入一定量的蒸馏水,滴入2滴酚酞溶液
溶液无明显变化
猜想一不成立
B.向试管中加入一定量的NaCl溶液,滴入2滴酚酞溶液
溶液无明显变化
猜想二不成立
C.①向试管中加入一定量的Na2CO3溶液,滴入2滴酚酞溶液
②往①所得溶液中逐滴加入CaCl2溶液至过量
①溶液由无色变红色
②
猜想三成立
写出实验操作C中步骤②发生反应的化学方程式:。
【解释与结论】同学们和老师交流,得知碳酸钠中的和H2O作用,产生较多的OH-和 , 从而形成氢氧化钠和碳酸氢钠
(3)、【拓展与延伸】结合任务二的所有信息和结论,运用初中化学所学知识,经过分析推理可得出:Na2CO3与水作用的化学方程式:。
(4)、任务三探究纯碱的用途一一用于生产洗涤剂
【查阅资料】Na2CO3可用于生产洗涤剂。Na2CO3溶液呈碱性,可清洗油污,溶液碱性越强,去油污效果越好。
【实验探究】兴趣小组继续对影响Na2CO3溶液去油污效果的因素进行探究。
用不同温度的水,配制溶质质量分数分别为2%、6%和10%的Na2CO3溶液,并测定溶液pH,记录数据如下表:
实验编号
①
②
③
④
⑤
⑥
⑦
⑧
⑨
溶质质量分数
2%
2%
2%
6%
6%
6%
10%
10%
10%
溶液温度(℃)
20
40
60
20
50
60
20
40
70
溶液pH
10.90
11.18
11.26
11.08
11.27
11.30
11.22
11.46
11.50
【解释与结论】实验①、②、③对比,可得出的结论是。
(5)、【拓展与应用】下列物质可用于去油污的是____(填字母)。
A、食盐 B、苛性钠 C、草木灰 D、石灰石三、流程题
-
15. 中国将在2030年前实现“碳达峰”:2060年前实现“碳中和”。为了实现“双碳”目标,全社会各个领域开始行动起来。其中碳转化和碳封存是实现碳中和的主要途径之一(1)、I、碳转化
科学家已经研究出多种方式来实现二氧化碳的转化。例如我国研发的“液态太阳燃料合成技术”,甲醇(CH3OH)等液体燃料被形象地称为“液态阳光”。利用二氧化碳和氢气作为原料在纳米纤维催化剂的作用下,生成甲醇(CH3OH)和水,请写出该反应的化学方程式。
(2)、Ⅱ、碳封存化学链燃烧技术是利用载氧体(金属氧化物)将空气中的氧传输至燃料的新技术,利用化学链燃烧技术捕捉甲烷(CH4)燃烧所产生的CO2 , 再利用NaOH溶液喷淋捕捉CO2的工艺流程图如下:
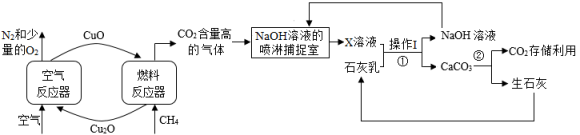
氧元素的质量分数:Cu2OCuO(填“>”“<”或“=”)
(3)、请写出空气反应器的物质在加热条件下的化学方程式:该反应属于(填基本反应类型)。(4)、操作I的名称是 , 反应②中的化学方程式为。(5)、北京冬奥会速滑馆“冰丝带”制冰采用了世界上最先进的二氧化碳跨临界直冷制冰技术。固态二氧化碳的俗称。16. 化学小组参与“铅蓄废电池中硫酸回收”的研学项目,回收时需要测定电池废液中硫酸的质量分数。向装有50g废液的锥形瓶中加入质量分数为10%的氢氧化钠溶液,并充分搅拌,利用pH计等电子设备采集信息并绘制成下图,请据图回答相关问题。(杂可溶但不参加反应)
配制上述实验所用的氢氧化钠溶液:
(1)、称量g NaOH固体,溶解,配制40g10%的NaOH溶液。(2)、如图乙,a点溶液中含有的溶质是。(3)、请计算废液中H2SO4的质量分数。(请写出详细的计算过程)(4)、若配制氢氧化钠溶液时,用量筒量水时俯视读数,会导致测定废液中硫酸的质量分数结果(选填“偏大”、“偏小”或“不变”)。