四川省德阳市中江县2022-2023学年九年级下学期课改教学质量监控化学练习二
试卷更新日期:2023-06-01 类型:月考试卷
一、单选题
-
1. 浩瀚的海洋中含量最多的物质是( )A、NaCl B、MgCl2 C、CaCl2 D、H2O2. 海洋是一个巨大的宝藏,期待着人们的开发和利用.下列物质不经过化学变化就能从海水中获得的是( )A、纯碱 B、单质镁 C、烧碱 D、粗盐3. 下列各组中的物质化学式与俗名、名称均一致的是( )A、、消石灰、氧化钙 B、、纯碱、氢氧化钠 C、、苏打、碳酸钠 D、、酒精、乙醇4. 下列物质的名称、俗称、化学式完全对的是( )A、氯化钠、食盐、NaCl2 B、碳酸氢钠、纯碱、Na2CO3 C、氢氧化钙、熟石灰,CaO D、氢氧化钠、火碱、NaOH5. 下列表示的实验操作中,可以将食盐结晶出来的是( )A、
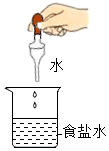 B、
B、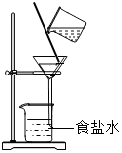 C、
C、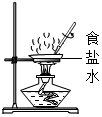 D、
D、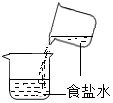 6. 下列推论正确的是( )A、碳酸盐与盐酸反应有气体放出,所以与盐酸反应有气体放出的物质一定是碳酸盐 B、酸与碱反应生成盐和水的反应叫中和反应,所以有盐和水生成的反应一定是中和反应 C、酸能使紫色石蕊试液变红,通入CO2后的紫色石蕊试液变红,所以CO2是酸 D、碱性溶液能使石蕊试液变蓝,所以能使石蕊试液变蓝的溶液呈碱性7. 下表是所测得某些食物的近似 , 下列说法中正确的是( )
6. 下列推论正确的是( )A、碳酸盐与盐酸反应有气体放出,所以与盐酸反应有气体放出的物质一定是碳酸盐 B、酸与碱反应生成盐和水的反应叫中和反应,所以有盐和水生成的反应一定是中和反应 C、酸能使紫色石蕊试液变红,通入CO2后的紫色石蕊试液变红,所以CO2是酸 D、碱性溶液能使石蕊试液变蓝,所以能使石蕊试液变蓝的溶液呈碱性7. 下表是所测得某些食物的近似 , 下列说法中正确的是( )物质
柠檬汁
鸡蛋清
苹果
西红柿
牛奶
2.3
7.9
3.1
4.2
6.5
A、牛奶和鸡蛋清均呈碱性 B、胃酸过多的人应少食苹果 C、柠檬汁能使酚酞试液变红色 D、西红柿的酸性比苹果强8. 下列叙述正确的是( )A、凡是均一,透明的液体就是溶液 B、一定温度下,某固体物质的饱和溶液,其溶质的质量分数为最大值 C、固体物质的溶解度都是随温度的升高而增大 D、浓溶液一定是饱和溶液,稀溶液一定是不饱和溶液9. “厨房化学”可理解为利用家庭生活用品来进行化学实验,从而对化学进行学习和探讨活动。下列实验不能在“厨房化学”中完成的是( )A、探究铁制品在什么条件下生锈 B、蛋壳能否溶于酸 C、鉴别食盐和纯碱 D、检验自来水是否含氯离子10. 某蔬菜种植基地原计划每亩菜田施用氮肥碳酸氢铵7.9kg,因缺货现改施尿素[CO(NH2)2]。若要达到同样的施肥效果,则每亩菜田所需尿素的质量是( )A、3kg B、3.95kg C、6kg D、7.9kg11. 下列实验操作正确的是( )A、用托盘天平称量固体时,应将药品放在右盘上,砝码放在左盘上 B、将试剂瓶中的液体倒入试管中,操作过程如图所示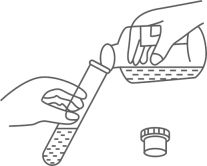 C、用排水法收集满氧气的集气瓶,应在水下用玻璃片盖好,再取出正立在桌面上
D、用pH试纸测定溶液pH时,先用蒸馏水将试纸润湿后,再用玻璃棒蘸取待测滴在pH试纸上,然后将试纸显示的颜色跟标准比色卡对照即可
12. 根据你所学的化学知识,下列做法中正确的是( )A、用食醋除去水瓶中的水垢 B、常用水冲洗铁器表面,可以防止生锈 C、用亚硝酸钠做食品调味剂 D、碳酸氢铵与草木灰(K2CO3)混合使用13. 下列括号中的物质是除去杂质所用的试剂,其中错误的是( )A、Na2CO3溶液中混有NaCl(盐酸) B、NaNO3溶液中混有NaCl(AgNO3) C、NaCl溶液中混有Na2SO4(BaCl2溶液) D、CO中混有CO2(浓碱溶液)14. 将过量的铁粉放入含AgNO3和Zn(NO3)2的混合溶液里,搅拌,使其充分反应后过滤,滤纸上留下的金属是( )A、Ag B、Fe、Ag C、Fe、Zn D、Ag、Zn、Fe15. 下列各组内的离子在溶液中不能大量共存的是( )A、H+ , , Ba2+ , B、Ca2+ , H+ , , Cl- C、Mg2+ , K+ , , Cl- D、K+ , Na+ , Mg2+ ,16. 鱼胆弄破后,会使鱼肉粘上一种叫胆汁液(一种酸)的物质,它难溶于水,使鱼肉变苦,要消除这种苦味,可用下列何种溶液冲洗最适宜( )A、纯碱溶液 B、醋酸 C、食盐水 D、氢氧化钠溶液17. 根据下面实验内容和实验现象推出的结论中,错误的是( )
C、用排水法收集满氧气的集气瓶,应在水下用玻璃片盖好,再取出正立在桌面上
D、用pH试纸测定溶液pH时,先用蒸馏水将试纸润湿后,再用玻璃棒蘸取待测滴在pH试纸上,然后将试纸显示的颜色跟标准比色卡对照即可
12. 根据你所学的化学知识,下列做法中正确的是( )A、用食醋除去水瓶中的水垢 B、常用水冲洗铁器表面,可以防止生锈 C、用亚硝酸钠做食品调味剂 D、碳酸氢铵与草木灰(K2CO3)混合使用13. 下列括号中的物质是除去杂质所用的试剂,其中错误的是( )A、Na2CO3溶液中混有NaCl(盐酸) B、NaNO3溶液中混有NaCl(AgNO3) C、NaCl溶液中混有Na2SO4(BaCl2溶液) D、CO中混有CO2(浓碱溶液)14. 将过量的铁粉放入含AgNO3和Zn(NO3)2的混合溶液里,搅拌,使其充分反应后过滤,滤纸上留下的金属是( )A、Ag B、Fe、Ag C、Fe、Zn D、Ag、Zn、Fe15. 下列各组内的离子在溶液中不能大量共存的是( )A、H+ , , Ba2+ , B、Ca2+ , H+ , , Cl- C、Mg2+ , K+ , , Cl- D、K+ , Na+ , Mg2+ ,16. 鱼胆弄破后,会使鱼肉粘上一种叫胆汁液(一种酸)的物质,它难溶于水,使鱼肉变苦,要消除这种苦味,可用下列何种溶液冲洗最适宜( )A、纯碱溶液 B、醋酸 C、食盐水 D、氢氧化钠溶液17. 根据下面实验内容和实验现象推出的结论中,错误的是( )选项
实验内容
实验现象
实验结论
A
滴加酚酞试液
溶液变红色
溶液为碱溶液,pH>7
B
滴加石蕊试液
溶液变红色
溶液为酸性溶液,pH<7
C
通入澄清石灰水
出现白色浑浊
该气体可能是CO2
D
滴加氯化钡试剂
有白色沉淀
溶液中可能含有CO32﹣或SO42﹣等离子
A、A B、B C、C D、D18. 等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应后,都生成+2价的硫酸盐,其产生氢气的体积与反应时间的关系如图所示,则下列说法正确的是( )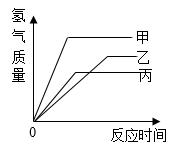 A、三种金属的活动性大小为甲>乙>丙 B、反应时消耗硫酸的质量一定相同 C、三种金属的相对原子质量是甲>乙>丙 D、反应速率最快的是甲,最慢的是乙19. 下图表示向一定量CaCl2和盐酸的混合溶液中滴加Na2CO3溶液的变化过程,x表示Na2CO3溶液的质量,则y可能表示( )
A、三种金属的活动性大小为甲>乙>丙 B、反应时消耗硫酸的质量一定相同 C、三种金属的相对原子质量是甲>乙>丙 D、反应速率最快的是甲,最慢的是乙19. 下图表示向一定量CaCl2和盐酸的混合溶液中滴加Na2CO3溶液的变化过程,x表示Na2CO3溶液的质量,则y可能表示( )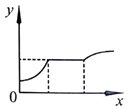 A、气体的体积 B、沉淀的质量 C、NaCl的质量 D、混合溶液的pH20. 在由NaHS、MgSO4、NaHSO3组成的混合物中,已知S元素的质量分数为a%,则O元素的质量分数为( )A、1.75 a% B、1-1.75 a% C、1.25 a% D、无法计算
A、气体的体积 B、沉淀的质量 C、NaCl的质量 D、混合溶液的pH20. 在由NaHS、MgSO4、NaHSO3组成的混合物中,已知S元素的质量分数为a%,则O元素的质量分数为( )A、1.75 a% B、1-1.75 a% C、1.25 a% D、无法计算二、填空题
-
21. 酸、碱反应与人们的日常生活和生产有密切关系(1)、由于人胃液的主要成分是。因此胃液过多分泌时会引起胃病,服用含氢氧化铝的药物可以缓解病痛。其治疗的化学原理是(用化学方程式表示)反应的类型是。(2)、蒸馒头时,面团经过发酵后生成一酸,此时可以加入一些纯碱溶液,用力揉合面团后再蒸时使其变得疏松多孔原因是。(3)、未成熟的水果大多有涩味,这是因为水果中含有鞣酸。脱涩的方法之一是:先用少量水将生石灰转化为石灰乳,该变化的化学方程式是 , 然后把它加清水稀释,浸泡水果几天就可除去涩味。(4)、痕检是公安机关提取犯罪嫌疑人指纹的一种重要方法,硝酸银显现法就是其中一种:人的手上有汗迹,用手动白纸后,手指纹线就留在纸上。如果将硝酸银溶液小心地涂在纸上,它就会与汗液中的氯化钠作用而显出纸纹,其反应的化学方程式为。22. 在氢、氧、碳、钠四种元素中选择适当的元素组成符合下列要求的物质:(1)、由H、O、C、Na组成的常见化合物中,属于酸性氧化物的是 , 属酸的是 , 属于碱的是 , 属于有机物的是(只写两种)(以上各空填写化学式)(2)、氢气作为高能燃料具有三个优点;
①;
②;
③;
(3)、冬天用煤取暖,因排气不良,易发生煤气中毒,一氧化碳使人中毒的原因是。潜水艇中必须配备氧气再生装置,利用过氧化钠(Na2O2)与CO2反应生成碳酸钠和氧气,该反应的化学方程式为。(4)、早在西汉时期,就有“曾青得铁则化为铜”的记载,其中涉及反应的化学方程式为。23. 南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源,我国制碱工业先驱侯德榜发明了“侯氏制碱法”,在充分利用海洋资源的基础上,结合“侯氏制碱法”的基本原理,可模拟实现工业生产纯碱的过程如下(某些反应产物以略去):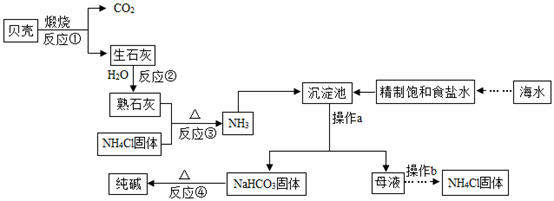
回答下列问题:
(1)、操作a的名称是。(2)、反应②的化学方程式为。(3)、反应④的化学方程式为;请列举小苏打在生活中的一种常见用途。(4)、向精制饱和食盐水中通入两种气体的顺序是:先通氨气形成饱和氨盐水,然后在加压条件下通入二氧化碳。这样操作的目的是。(5)、仔细观察流程图,其中可循环利用的物质除二氧化碳之外,还有。三、综合题
-
24. 小红同学在进行酸碱中和反应的实验时向烧杯中氢氧化钠溶液滴加稀盐酸一会儿后,发现忘了滴加指示剂。为确定盐酸与氢氧化钠是否恰好完全反应,小红从烧杯中取少量反应后的溶液注入于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡、观察其不变色。于是就得出了两种物质已恰好完全中和的结论。(1)、你认为其结论是否正确,并说明原因?。(2)、写该反应的化学方程式:。(3)、请你补充一个实验,探究上述烧杯中的溶液是否恰好完全中和,并填写下表
实验
可能观察到的现象
结论
(4)、亚硝酸钠外观与食盐一样,误将其当成食盐用而引起中毒的事件屡有发生。因亚硝酸钠易诱发癌症而严重影响人们的健康,有人设想:先向含有NaNO2的腌制食品中加入过量的氯化铵,共热后生成无毒、无害的氮气、水、氯化钠;然后再持续加热,使过量的氯化铵生成氯化氢和氨气,经过样样处理就放心了。请写出设想中这两个反应的化学方程式:①; ② 。(5)、将X溶液滴入Y溶液中,在滴加过程中,Y溶液的pH变化情况如下图所示。
溶液
A
B
C
D
X
盐酸
氢氧化钠
盐酸
氢氧化钠
Y
水
水
氢氧化钠
盐酸
表格中符合图中变化情况的是(填写编号),理由是
25. 请同学们搭乘“化学地铁”一起畅游物质世界吧!如图所示,列车上的物质可与各站的对应物质发生一步进行的反应,方可驶向下一站。2~5号站各站的对应物质属于不同类别的纯净物。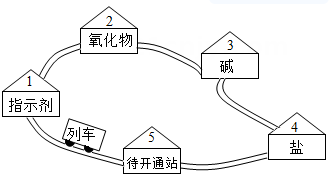 (1)、若列车上的物质为“碳酸钠溶液”。
(1)、若列车上的物质为“碳酸钠溶液”。①列车途经“1号站”时,若指示剂为紫色石蕊溶液,溶液变色。
②列车途经“2号站”时,若氧化物为二氧化碳,二氧化碳与碳酸钠溶液反应生成碳酸氢钠(NaHCO3)的化学方程式为。
③列车途经“3号站”时,反应的化学方程式为
(写一个)。
(2)、“碳酸钠溶液”列车抵达“4号站”时,将列车上的物质更换为“稀盐酸”后出发。①与“碳酸钠溶液”和“稀盐酸”都能反应的“4号站”的对应物质为(填一种)。
②“稀盐酸”列车途经“5号站”时,反应的化学方程式为(写一个)。
26. 完成下列小题(1)、请选择仪器的序号填空:①量筒②烧杯③玻璃棒④试管⑤蒸发皿
常用作少量药品反应的仪器是用于量取一定体积的液体的仪器是。
(2)、为完成过滤操作,除选用(1)中的部分仪器外,还缺少的玻璃仪器是。四、计算题
-
27. 某同学为测定石灰石中碳酸钙的质量分数,取5.5g石灰石粉末,进行四次高温加热(杂质不参加反应),冷却、称量剩余固体的重复操作。记录操作如下:
操作次序
第一次
第二次
第三次
第四次
剩余固体质量/g
4.25
3.95
3.35
3.35
请计算:
(1)、完全反应生成二氧化碳g。(2)、求石灰石中碳酸钙的质量分数。(3)、该同学为了其他研究的需要,另取一定的碳酸钙粉末与镁粉混合,在空气中加热至反应完全,测得反应前后质量不变。计算碳酸钙粉末和镁粉的质量比。